File word Đề thi vào 10 Môn Hóa Chuyên Hạ Long – Quảng Ninh – Năm học 2023
File word Đề thi vào 10 Chuyên Hạ Long – Quảng Ninh – Năm học 2023
Câu 1: (2,5 điểm)
1. a. Có ba gói phân bón hóa học bị mất nhãn. Mỗi gói đựng riêng biệt mộ trong ba loại phân bón hóa học sau: kali clorua, amoni nitrat, supephotphat. Chỉ được dùng thêm một thuốc thử, hãy trình bày phương pháp hóa học nhận biết các gói đựng phân bón trên và viết các PTHH xảy ra.
b. Phân kali thúc đẩy nhanh quá trình tạo ra chất đường, bột, chất xơ…tăng cường sức chống rét, chống sâu bệnh và chịu hạn của cây. Độ dinh dưỡng của phân kali được đánh giá theo tỉ lệ phần trăm khối lượng $\mathrm{K}_2 \mathrm{O}$ tương ứng với lượng $\mathrm{K}$ có trong thành phần của nó. Một loại phân kali trong thành phần có chứa $67,05 \% \mathrm{KCl}$; $31,05 \% \mathrm{~K}_2 \mathrm{CO}_3$ về khối lượng, còn lại là tạp chất không chứa nguyên tố kali. Hãy tính độ dinh dưỡng của loại phân kali trên.
2. Nêu hiện tượng và viết $\mathrm{PTHH}$ của phản ứng xảy ra khi tiến hành các thí nghiệm sau:
– Cho mẩu nhỏ $\mathrm{Na}$ vào dung dịch sắt (III) nitrat – Sục khí $\mathrm{SO}_2$ tới dư vào dung dịch $\mathrm{Br}_2$
– Cho từ từ dung dịch $\mathrm{NaHSO}_4$ vào dung dịch $\mathrm{Ba}\left(\mathrm{HCO}_3\right)_2$ tới dư.
Hướng dẫn
1. a. Lây mẫu từng loại phân bón, đánh số thứ tự để thuận tiện đối chiếu kết quả thực nghiệm
– Cho dung dịch $\mathrm{Ca}(\mathrm{OH})_2$ vào từng mẫu, quan sát hiện tượng ta thấy mẫu có khí mùi khai thoát ra là:
$2 \mathrm{NH}_4 \mathrm{NO}_3+\mathrm{Ca}(\mathrm{OH})_2 \rightarrow \mathrm{Ca}\left(\mathrm{NO}_3\right)_2+2 \mathrm{NH}_3+2 \mathrm{H}_2 \mathrm{O}$; mẫu xuất hiện kết tủa trắng là:
$\mathrm{Ca}\left(\mathrm{H}_2 \mathrm{PO}_4\right)_2+2 \mathrm{Ca}(\mathrm{OH})_2 \rightarrow \mathrm{Ca}_3\left(\mathrm{PO}_4\right)_2+4 \mathrm{H}_2 \mathrm{O} ;$ mẫu còn lại không hiện tượng là $\mathrm{KCl}$.
b. Để đơn giản mà không thay đổi bài toán, giả sử khối lượng phân là $100 \mathrm{gam}$.
$
\text { Phân } \mid \begin{aligned}
& \mathrm{KCl}^{67,05 \mathrm{~g}} \rightarrow \mathrm{K}^{0,9(\mathrm{~mol})} \rightarrow \mathrm{K}_2 \mathrm{O}^{0,45(\mathrm{~mol})} \rightarrow 42,3(\mathrm{~g}) \\
& \mathrm{K}_2 \mathrm{CO}_3{ }^{31,05 \mathrm{~g}} \rightarrow \mathrm{K}^{0,45(\mathrm{~mol})} \rightarrow \mathrm{K}_2 \mathrm{O}^{0,225(\mathrm{~mol})} \rightarrow 21,15(\mathrm{~g})
\end{aligned} \rightarrow \text { Độ dinh dưỡng }=\frac{\mathrm{m}_{\mathrm{K}_2 \mathrm{O}}}{\mathrm{m}_{\text {Phân }}} \cdot 100 \%=63,45 \%
$
2. Cho mẩu $\mathrm{Na}$ vào dung dịch $\mathrm{Fe}\left(\mathrm{NO}_3\right)_3$ ta thấy mẩu $\mathrm{Na}$ chạy trên mặt dung dịch, phản ứng kèm khí không màu không mùi thoát ra, dung dịch xuất hiện kết tủa nâu đỏ: $3 \mathrm{Na}+3 \mathrm{H}_2 \mathrm{O}+\mathrm{Fe}\left(\mathrm{NO}_3\right)_3 \rightarrow 3 \mathrm{NaNO}_3+\mathrm{Fe}(\mathrm{OH})_3+1,5 \mathrm{H}_2$ – Sục khí $\mathrm{SO}_2$ tới dư vào dung dịch $\mathrm{Br}_2$ ta thấy dung dịch mất màu nâu: $\mathrm{SO}_2+\mathrm{Br}_2+2 \mathrm{H}_2 \mathrm{O} \rightarrow 2 \mathrm{HBr}+\mathrm{H}_2 \mathrm{SO}_4$ – Cho từ từ $\mathrm{NaHSO}_4$ vào dung dịch $\mathrm{Ba}\left(\mathrm{HCO}_3\right)_2$ ta thây có bọt khí không màu, không mùi bay ra đồng thời xuất hiện kết tủa trắng không tan trong axit: $2 \mathrm{NaHSO}_4+\mathrm{Ba}\left(\mathrm{HCO}_3\right)_2 \rightarrow \mathrm{Na}_2 \mathrm{SO}_4+\mathrm{BaSO}_4+2 \mathrm{CO}_2+2 \mathrm{H}_2 \mathrm{O}$
3. Hòa tan hỗn hợp chất rắn $\mathrm{A}$ gồm $\mathrm{Na}_2 \mathrm{O}, \mathrm{NaHCO}_3, \mathrm{CaCl}_2$ có số mol bằng nhau vào bình chứa nước dư thu được dung dịch $\mathrm{B}$, kết tủa $\mathrm{D}$. Nhỏ tiếp dung dịch $\mathrm{FeCl}_2$ vào bình phản ứng thu được kết tủa $\mathrm{E}$. Lọc tách kết tủa $\mathrm{E}$, nung trong không khí đến khối lượng không đổi thu được chất rắn $\mathrm{F}$. Khử chất rắn $\mathrm{F}$ bằng khí $\mathrm{CO}$ dư, nung nóng được chất rắn $\mathrm{G}$. Xác định thành phần của $\mathrm{B}, \mathrm{D}, \mathrm{E}, \mathrm{F}, \mathrm{G}$. Viết các $\mathrm{PTHH}$ xảy ra. Biết các phản ứng xảy ra hoàn toàn.
Hướng dẫn
Để đơn giản bài toán, chọn số mol mỗi chất trong $\mathrm{A}$ là 1 (mol).
$
\begin{aligned}
& \mathrm{Na}_2 \mathrm{O}+\mathrm{H}_2 \mathrm{O} \rightarrow 2 \mathrm{NaOH} \quad \mathrm{NaOH}+\mathrm{NaHCO}_3 \rightarrow \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{H}_2 \mathrm{O} \quad \mathrm{CaCl}_2+\mathrm{Na}_2 \mathrm{CO}_3 \rightarrow 2 \mathrm{NaCl}+\mathrm{CaCO}_3 \\
& \mathrm{FeCl}_2+2 \mathrm{NaOH} \rightarrow \mathrm{Fe}(\mathrm{OH})_2+2 \mathrm{NaCl} \quad 2 \mathrm{Fe}(\mathrm{OH})_2+1 / 2 \mathrm{O}_2 \rightarrow \mathrm{Fe}_2 \mathrm{O}_3+2 \mathrm{H}_2 \mathrm{O} \quad \mathrm{Fe}_2 \mathrm{O}_3+3 \mathrm{CO} \rightarrow 2 \mathrm{Fe}+3 \mathrm{CO}_2 \\
&
\end{aligned}
$
Câu 2: (1,75 điểm)
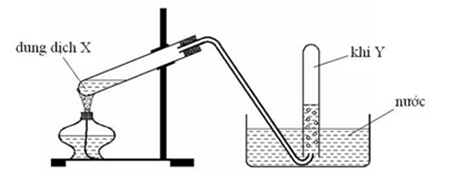
1. Hình vẽ dưới đây mô tả thí nghiệm điều chế khí $X$.
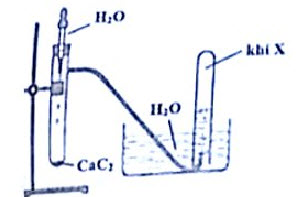
a. Hãy viết PTHH xảy ra trong thí nghiệm. Xác định CTCT và tên gọi của khí $X$.
b. Viết phương trình phản ứng của khí $X$ với dung dịch brom dư và phản ứng đốt cháy của khí $X$.
c. Đất đèn ngoài thành phần chính là $\mathrm{CaC}_2$ còn có thêm tạp chất. Khi thực hiện phản ứng trên với đất đèn thường sinh ra $\mathrm{H}_2 \mathrm{~S}$ là khí rất độc, có mùi khó chịu. Hãy nêu cách loại bỏ $\mathrm{H}_2 \mathrm{~S}$ trước khi thu khí $\mathrm{X}$.
2. Iot là một trong những nguyên tố vi lượng cần có trong chế độ dịnh dưỡng của con người. Chế độ ăn uống thiếu hụt Iot sẽ dẫn tới phì đại tuyến giáp gây ra căn bệnh bướu cổ. Một loại nguyên tử của nguyên tố Iot có tổng số hạt là 180 hạt, trong đó số hạt mang điện gấp $53: 37$ lần số hạt khống mang điện. Xác định số hạt proton, notron và electron trong nguyên tử của nguyên tố Iot trên.
3. Cho từ từ 274,4 gam dung dịch $\mathrm{Na}_2 \mathrm{CO}_3 \mathrm{a} \%$ vào 292 gam dung dịch $\mathrm{HCl} \mathrm{b} \%$. Sau khi kết thúc phản ứng thu được dung dịch chỉ chứa một chất tan duy nhất có nồng độ $13 \%$. Tìm giá trị a, b.
Hướng dẫn
1. $\mathrm{CaC}_2+2 \mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{Ca}(\mathrm{OH})_2+\mathrm{CH} \equiv \mathrm{CH}$ (khí axetilen)
PTHH: $\mathrm{CH} \equiv \mathrm{CH}+2 \mathrm{Br}_2 \rightarrow \mathrm{CH}\left(\mathrm{Br}_2\right)-\mathrm{CH}\left(\mathrm{Br}_2\right) \quad \mathrm{CH} \equiv \mathrm{CH}+2,5 \mathrm{O}_2 \rightarrow 2 \mathrm{CO}_2+\mathrm{H}_2 \mathrm{O}$
Cho hỗn hợp $\left(\mathrm{H}_2 \mathrm{~S}, \mathrm{C}_2 \mathrm{H}_2\right)$ đi qua dung dịch $\mathrm{Pb}\left(\mathrm{NO}_3\right)_2$ dư, khí đi ra khỏi dung dịch ta thu được $\mathrm{C}_2 \mathrm{H}_2$ tinh khiết.
2. $\left|\begin{array}{l}2 \mathrm{p}+\mathrm{n}=180 \\ 2 \mathrm{p}=(53: 37) \mathrm{n}\end{array} \rightarrow\right| \begin{aligned} & \mathrm{p}=53 \\ & \mathrm{n}=74\end{aligned}$
3. Chất tan duy nhất là $\mathrm{NaCl}: \mathrm{Na}_2 \mathrm{CO}_3+2 \mathrm{HCl} \rightarrow 2 \mathrm{NaCl}+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O}$
Câu 3: (2,25 điểm)
1. Giải thích các trường hợp sau và viết $\mathrm{PTHH}$ của các phản ứng xảy ra (nếu có):
– Than hoạt tính được dùng làm mặt nạ phòng độc, làm chất khử màu, khử mùi…
– Khí hidro được sử dụng làm nhiên liệu thay thế cho than đá, dầu mỏ, khí thiên nhiên…
– Cho bột $\mathrm{NaHCO}_3$ vào cốc thủy tinh đựng dung dịch $\mathrm{CH}_3 \mathrm{COOH}$. Nghiêng miệng cốc về phía ngọn nến nhỏ đang cháy thì ngọn nến bị tắt.
Hướng dẫn
– Than hoạt tính cấu tạo xốp nên có tính hấp phụ, có khả năng khử màu, khử mùi.
– Nhiên liệu từ khí hidro thải ra hơi nước không ô nhiễm môi trường nên thay thế cho than đá, dầu mở, khí đốt.
– Cho bột $\mathrm{NaHCO}_3$ vào cốc đựng $\mathrm{CH}_3 \mathrm{COOH}$ thì tạo ra khí $\mathrm{CO}_2$ không duy trì sự cháy, khi nghiêng cốc về phía ngọn nến thì nến bị tắt.
2. Cho 5,28 gam hỗn hợp $\mathrm{X}$ gồm hai kim loại $\mathrm{Mg}$ và $\mathrm{Fe}$ vào $500 \mathrm{ml}$ dung dịch $\mathrm{Cu}\left(\mathrm{NO}_3\right)_2$. Kết thúc phản ứng thu được dung dịch $\mathrm{Y}$ và 7,2 gam chất rắn $\mathrm{Z}$ chứa tối đa hai kim loại. Cho dung dịch $\mathrm{Y}$ tác dụng với $\mathrm{NaOH}$ dư thu được kết tủa $T$. Lọc lấy $\mathrm{T}$, rửa sạch rồi đem nung trong không khí đến khối lượng không đổi thu được $3 \mathrm{gam}$ chất rắn $\mathrm{Q}$. Biết các phản ứng xảy ra hoàn toàn.
a. Xác định thành phần \% theo khối lượng của mỗi kim loại trong hỗn hợp ban đầu.
b. Tính nồng độ mol của dung dịch $\mathrm{Cu}\left(\mathrm{NO}_3\right)_2$ đã dùng.
$
\begin{aligned}
& \text { Hướng dẫn } \\
& \mathrm{Mg}+\mathrm{Cu}\left(\mathrm{NO}_3\right)_2 \rightarrow \mathrm{Mg}\left(\mathrm{NO}_3\right)_2+\mathrm{Cu} \quad \mathrm{Fe}+\mathrm{Cu}\left(\mathrm{NO}_3\right)_2 \rightarrow \mathrm{Fe}\left(\mathrm{NO}_3\right)_2+\mathrm{Cu} \\
& \mathrm{Mg}\left(\mathrm{NO}_3\right)_2+2 \mathrm{NaOH} \rightarrow \mathrm{Mg}(\mathrm{OH})_2+2 \mathrm{NaNO}_3 \quad \mathrm{Fe}\left(\mathrm{NO}_3\right)_2+2 \mathrm{NaOH} \rightarrow \mathrm{Fe}(\mathrm{OH})_2+2 \mathrm{NaNO}_3 \\
& \mathrm{Mg}(\mathrm{OH})_2 \stackrel{\mathrm{t}^{\circ}}{\longrightarrow} \mathrm{MgO}+\mathrm{H}_2 \mathrm{O} \\
& 2 \mathrm{Fe}(\mathrm{OH})_2+1 / 2 \mathrm{O}_2 \stackrel{\mathrm{t}^{\mathrm{o}}}{\longrightarrow} \mathrm{Fe}_2 \mathrm{O}_3+2 \mathrm{H}_2 \mathrm{O} \\
& \mathrm{X}\left|\begin{array}{l}
\mathrm{Mg}^{\mathrm{a}} \\
\mathrm{Fe}^{\mathrm{b}}
\end{array} \rightarrow \mathrm{Z}\right| \begin{array}{l}
\mathrm{Fe}^{\mathrm{c}} \\
\mathrm{Cu}^{\mathrm{a}+\mathrm{b}-\mathrm{c}}
\end{array} ; \mathrm{ddY}\left|\begin{array}{l}
\mathrm{Mg}\left(\mathrm{NO}_3\right)_2^{{ }^a} \\
\mathrm{Fe}\left(\mathrm{NO}_3\right)_2^{\mathrm{b}-\mathrm{c}}
\end{array} \rightarrow \mathrm{Rắ} \mathrm{n}\right| \begin{array}{l}
\mathrm{MgO}^{\mathrm{a}} \\
\mathrm{Fe}_2 \mathrm{O}_3{ }^{0,5(b-c)}
\end{array} \rightarrow\left|\begin{array}{l}
24 \mathrm{a}+56 \mathrm{~b}=5,28 \\
56 \mathrm{c}+64(\mathrm{a}+\mathrm{b}-\mathrm{c})=7,2 \\
40 \mathrm{a}+80(\mathrm{~b}-\mathrm{c})=3
\end{array} \rightarrow\right| \begin{array}{l}
\mathrm{a}=0,045 \\
\mathrm{~b}=0,075 \rightarrow \mathrm{Mg}^{20,45 \%} \\
\mathrm{c}=0,06
\end{array} \mid \begin{array}{l}
\mathrm{Fe}^{79,55 \%} \\
\mathrm{C}_{\mathrm{M}}=0,12
\end{array} \\
&
\end{aligned}
$
Câu 4: (2,25 điểm)
1. Từ $8,1 \mathrm{~kg}$ gạo nếp (giả sử có chứa $80 \%$ tinh bột) có thể sản xuất được 11,5 lít rượu etylic $30^{\circ}$. Cho biết khối lượng riêng của rượu etylic nguyên chất là $0,8 \mathrm{~g} / \mathrm{ml}$. Tính hiệu suất của toàn bộ quá trình sản xuất rượu trên. 2. Đốt cháy hoàn toàn 9,3 gam một chất hữu cơ $\mathrm{A}$ (chỉ chứa các nguyên tố $\mathrm{C}, \mathrm{H}, \mathrm{O}$ ). Toàn bộ sản phẩm cháy đem hấp thụ hết vào một lượng dung dịch $\mathrm{Ca}(\mathrm{OH})_2$ thu được 15 gam kết tủa và dung dịch $\mathrm{B}$. Sau phản ứng thấy khối lượng dung dịch $\mathrm{Ca}(\mathrm{OH})_2$ tăng 4,22 gam. Đun nóng dung dịch $\mathrm{B}$ đến khi phản ứng kết thúc thu được 8 gam kết tủa.
a. Tìm CTPT của $\mathrm{A}$. Biết ở cùng điều kiện về nhiệt độ và áp suất, thể tích hơi của 4,65 gam chất $\mathrm{A}$ bằng thể tích của 2,48 gam khí oxi.
b. Cho 0,1 mol chất A phản ứng hết với $\mathrm{m}$ gam dung dịch XOH $12 \%$ (lượng XOH được lấy dư $20 \%$ so với lượng cần dùng). Cô cạn dung dịch sau phản ứng thu được 9 gam chất rắn khan. Tìm kim loại $\mathrm{X}$ và giá trị của m. Biết dung dịch của $\mathrm{A}$ làm quỳ tím hóa đỏ.
Hướng dẫn
1. $\left(\mathrm{C}_6 \mathrm{H}_{10} \mathrm{O}_5\right)_{\mathrm{n}}+\mathrm{nH}_2 \mathrm{O} \underset{\mathrm{t}^{\circ}}{\stackrel{\mathrm{H}^{+}}{\longrightarrow}} \mathrm{nC}_6 \mathrm{H}_{12} \mathrm{O}_6 \quad \mathrm{C}_6 \mathrm{H}_{12} \mathrm{O}_6 \underset{\text { mẹ̛̛̣u }}{\stackrel{\text { rut }}{\longrightarrow}} 2 \mathrm{C}_2 \mathrm{H}_5 \mathrm{OH}+2 \mathrm{CO}_2$
Thể tích rượu etylic sản xuất được: $\frac{8,1.80 \% \cdot 2 . \mathrm{H} \% \cdot 46}{162.0,8.30 \%}=11,5 \rightarrow \mathrm{H}=75 \%$
2. a. Đun nóng dung dịch $\mathrm{B}$ thu được kết tủa nên $\mathrm{B}$ chứa $\mathrm{Ca}\left(\mathrm{HCO}_3\right)_2$
$
\begin{aligned}
& \mathrm{Ca}\left(\mathrm{HCO}_3\right)_2 \rightarrow \mathrm{CaCO}_3+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O} \quad 2 \mathrm{CO}_2+\mathrm{Ca}(\mathrm{OH})_2 \rightarrow \mathrm{Ca}\left(\mathrm{HCO}_3\right)_2 \quad \mathrm{CO}_2+\mathrm{Ca}(\mathrm{OH})_2 \rightarrow \mathrm{CaCO}_3+\mathrm{H}_2 \mathrm{O} \\
& 0,08 \leftarrow 0,08 \quad 0,16 \leftarrow 0,08 \quad 0,15 \quad \leftarrow 0,15 \\
&
\end{aligned}
$
Suy ra: $\mathrm{nCO}_2=0,31 ; \mathrm{m}_{\text {dd tãng }}=\mathrm{m}\left(\mathrm{CO}_2, \mathrm{H}_2 \mathrm{O}\right)-\mathrm{m} \downarrow \rightarrow \mathrm{nH}_2 \mathrm{O}=0,31$ và: $\mathrm{mA}=12 \mathrm{nCO}_2+2 \mathrm{nH}_2 \mathrm{O}+16 \mathrm{nO} \rightarrow \mathrm{nO}=0,31$
Vậy $\mathrm{C}: \mathrm{H}: \mathrm{O}=1: 2: 1 \rightarrow \mathrm{A}:\left(\mathrm{CH}_2 \mathrm{O}\right)_{\mathrm{n}}$ mà $\mathrm{M}_{\mathrm{A}}=60 \rightarrow \mathrm{A}: \mathrm{C}_2 \mathrm{H}_4 \mathrm{O}_2$
Câu 5: (2,0 điểm)
1. Hiện nay, để tận dụng chất thải chăn nuôi đồng thời giảm chi phí năng lượng và hạn chế ô nhiễm môi trường, người ta thường dùng bếp Biogas. Loại bếp này sử dụng nhiên liệu là khí metan được sinh ra từ quá trình phân hủy các chất thải chăn nuôi. Nhiệt lượng tỏa ra khi đốt cháy hoàn toàn 1 mol khí metan là $889,6 \mathrm{~kJ}$ theo $\mathrm{PTHH}$ : $\mathrm{CH}_4+2 \mathrm{O}_2 \stackrel{\mathrm{t}^{\circ}}{\longrightarrow} \mathrm{CO}_2+2 \mathrm{H}_2 \mathrm{O}$. Tính thể tích khí metan (đktc) cần đem đốt cháy để đun 1 lít nước từ $25^0$ lên
$100^{\circ} \mathrm{C}$. Cho biết khối lượng riêng của nước là $1 \mathrm{~g} / \mathrm{ml}$ và muốn nâng 1 gam nước lên $1^0$ cần tiêu tốn nhiệt lượng là $4,18 \mathrm{~J}$. Giả sử khi đốt cháy khí metan, $80 \%$ nhiệt lượng sinh ra làm tăng nhiệt độ của nước.
2. Cho thành phần $\%$ về khối lượng của nguyên tố kim loại $\mathrm{R}$ trong hốn hợp $\mathrm{X}$ gồm $\mathrm{RCl}_2$ và $\mathrm{R}^{\left(\mathrm{NO}_3\right)_2}$ là $17,81 \%$. Xác định thành phần \% về khối lượng của nguyên tố oxi trong hỗn hợp $X$.
Hướng dẫn
1. Nhiệt lượng cần đun 1 lít nước: $\mathrm{Q}=\mathrm{C} \cdot \mathrm{m} .\left(\mathrm{t}_2-\mathrm{t}_1\right)=4,18 \cdot 1000.75=313,5 \mathrm{~kJ}$
Thể tích khí metan là: $\mathrm{V}=313,5: 889,6: 80 \%=9,867$ (lít).
2. Giả sử $\mathrm{RCl}_2: 1(\mathrm{~mol})$
$\rightarrow\left|\begin{array}{l}\mathrm{RCl}_2{ }^1 \\ \mathrm{R}\left(\mathrm{NO}_3\right)_2{ }^{\mathrm{a}}\end{array} \rightarrow\right| \begin{aligned} & \mathrm{R}(1+\mathrm{a})=0,1781 .(\mathrm{R}+\mathrm{Ra}+71+124 \mathrm{a}) \\ & 4,615 \cdot \mathrm{R}(1+\mathrm{a})=71+124 \mathrm{a}\end{aligned} \rightarrow \mathrm{R}=\frac{71+124 \mathrm{a}}{4,615 .(1+\mathrm{a})}<27-\frac{53}{4,615 .(1+\mathrm{a})} \rightarrow \mid \begin{aligned} & 15<\mathrm{R}<27 \\ & \mathrm{R}=24 ; \mathrm{a}=3\end{aligned}$
Phần trăm khối lượng của nguyên tố oxi trong $X$ là: 53,43\%.