Đề HSG Hóa 9 Đề thi vào 10 Chuyên Đồng Nai – Năm học 2020 – 2021
Đề HSG Hóa 9 Đề thi vào 10 Chuyên Đồng Nai – Năm học 2020 – 2021
Cho biết nguyên tử khối của các nguyên tố: H = 1; C = 12; O = 16; Mg = 24; Al = 27; S = 32; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ba = 137.
(Thí sinh không được sử dụng Bảng hệ thống tuần hoàn các nguyên tố Hóa học)
Câu 1 (2,25 điểm)
1.1 Cho kim loại Natri tác dụng hoàn toàn với 200 ml dung dịch H2SO4 a M (loãng) thu được dung dịch A và 0,4a mol khí thoát ra. Cho lần lượt từng chất Fe, Zn, HCl, Ba(OH)2, KHSO4, Al(OH)3, (NH4)2CO3, Ba(HCO3)2 vào dung dịch A. Trường hợp nào xảy ra phản ứng? Viết phương trình hóa học của các phản ứng xảy ra.
1.2 Có 5 lọ dung dịch riêng biệt chứa các chất: Na2CO3, BaCl2, AlCl3, H2SO4, NaOH được đánh số bất kỳ (1), (2), (3), (4), (5). Thực hiện một số thí nghiệm được kết quả như sau:
| (1) | (2) | (3) | (4) | (5) | |
| (1) | x | x | x | ↓ | x |
| (2) | x | x | x | ↓ | ↓ và ↑ |
| (3) | x | x | x | x | x |
| (4) | ↓ | ↓ | x | x | x |
| (5) | X | ↓ và ↑ | x | x | X |
Với các kí hiệu: “x” không thực hiện thí nghiệm, “↓” có kết tủa, “↑” có khí thoát ra.
Hãy xác định tên chất tan có trong lọ (1), (2), (3), (4), (5). Giải thích và viết phương trình hóa học của các phản ứng xảy ra.
Câu 2 (2,25 điểm)
Bôxít là một quặng khá phổ biến ở vùng Tây Nguyên. Quá trình sản xuất nhôm từ quặng bôxít thường thông qua hai giai đoạn: tinh chế quặng và điện phân nóng chảy nhôm oxit.
a) Al2O3 được tách ra từ quặng bôxít thường lẫn các tạp chất Fe2O3, SiO2. Trình bày cách tinh chế Al2O3 và viết phương trình hóa học minh họa.
b) Al2O3 có nhiệt độ nóng chảy cao vì vậy trong quá trình điện phân người ta thêm Criolit (Na3AlF6) với tác dụng cơ bản là hạ thấp nhiệt độ nóng chảy và tiết kiệm năng lượng. Criolit thiên nhiên khá hiếm nên được điều chế bằng cách hòa tan Al(OH)3 và Na2CO3 trong dung dịch HF. Viết phương trình hóa học điều chế Criolit. Biết rằng ngoài Criolit phản ứng trên còn sinh ra khí CO2.
Quá trình điện phân Al2O3 được thực hiện trong thùng điện phân (hình bên) với hai điện cực bằng than chì ở nhiệt độ 960OC, điện áp khoảng 5V và cường độ dòng điện 1,4.105 Ampe. Sau quá trình điện phân thu được kim loại ở cực âm và khí thoát ra ở cực dương.
c. Viết phương trình hóa học của phản ứng điện phân Al2O3 nóng chảy. Tại sao trong quá trình điện phân người ta phải thường xuyên hạ thấp điện cực dương? Viết phương trình hóa học minh họa, (điện cực dương là những thỏi than chì nối với nhau, được cắm vào thùng điện phân).
d. Giả sử điện phân m (kg) nhôm oxit thu được 22,4 m3 (đktc) hỗn hợp khí X có tỉ khối với hidro bằng 16. Lấy 11,2 lít khí X (đktc) dẫn qua dung dịch nước vôi trong dư thu được 10 gam kết tủa. Tính giá trị của m. Biết hiệu suất của quá trình điện phân đạt 80%.
Câu 3 (2,00 điểm)
3.1. Cho 21,00 gam muối cacbonat của kim loại M có hóa trị 2 tác dụng vừa đủ với dung dịch H2SO4 24,50% thu được dung dịch muối có nồng độ 27,27% (dung dịch X). Xác định kim loại M.
Biết: muối Epsom (MSO4.nH2O) có nhiều lợi ích cho sức khỏe, thường được dùng để pha chế thuốc nhuận tràng, chất làm vườn như một loại phân bón cho cây, hay dung dịch khử khuẩn.
3.2. Khi làm lạnh dung dịch X thấy có 12,30 gam muối Epsom tách ra, phần dung dịch bão hòa có nồng độ 24,56%. Xác định công thức muối Epsom.
3.3. Tính khối lượng muối Epsom được tách ra khi làm lạnh 1548 gam dung dịch bão hòa MSO4 từ 80oC xuống 20oC. Biết: độ tan của MSO4 tại 80oC và 20oC lần lượt là 54,80 và 35,10.
Câu 4 (1,75 điểm)
Trong cấu tạo phân tử hợp chất hữu cơ có 3 loại liên kết cơ bản: Liên kết đơn “ – ”; liên kết đôi “ = ”; liên kết ba “ ≡ ”.
a. Viết các công thức cấu tạo có thể của X (C4H10); Y (C4H8); Z (C4H6). Biết: X, Y, Z đều có mạch cacbon hở, không phân nhánh.
Theo lý thuyết liên kết hiện đại, liên kết đơn thuộc loại liên kết s, liên kết đôi gồm có 1 liên kết s và 1 liên kết p, liên kết ba gồm 1 liên kết s và 2 liên kết p.
b. Tính số liên kết s và liên kết p trong phân tử X, Y, Z.
X có tên gọi là butan được sử dụng làm khí đốt để cung cấp nhiệt lượng cho các mục đích dân dụng, được nén ở áp suất cao trong các bình thép, mỗi bình như vậy chứa 13 kg butan.
c. Khi đốt cháy hoàn toàn 13 kg khí butan (khí gas) nhiệt lượng tỏa ra làm nóng bình đun chứa m (kg) nước từ 27oC lên 75o Tính giá trị m, biết rằng để nâng nhiệt độ của 1 gam nước lên 1oC cần cung cấp lượng nhiệt là 4,186 J. Để nâng nhiệt độ của bình đun lên 1oC cần cung cấp lượng nhiệt là 6750 J. Năng lượng tỏa ra khi đốt cháy hoàn toàn 1 mol butan (C4H10) là 2496,925 kJ và lượng nhiệt bị hao hụt do tỏa ra môi trường xung quanh là 10%. Giả thiết nước trong bình đun bay hơi không đáng kể trong điều kiện đã cho.
Câu 5 (1,75 điểm)
Etyl axetat là chất lỏng, mùi thơm, được sản xuất ở quy mô lớn làm dung môi trong công nghiệp.
a. Viết phương trình hóa học điều chế etyl axetat bằng cách đun nóng hỗn hợp rượu etylic và axit axetic với xúc tác H2SO4 đặc.
b. Sơ đồ thí nghiệm bên mô tả quá trình thực hiện phản ứng trên. Hãy cho biết vai trò của cốc nước lạnh trong thí nghiệm? Sau khi kết thúc phản ứng ta thêm một ít nước vào ống nghiệm B, lắc nhẹ thì có hiện tượng gì xảy ra?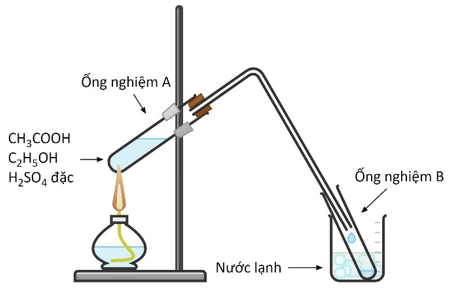
c. Sản phẩm của phản ứng trên ngoài etyl axetat còn lẫn rượu etylic và axit axetic. Trình bày phương pháp tách riêng từng chất.
d. Mỗi ngày để một nhà máy sản xuất được 1000 lít etyl axetat thì lượng thể tích (lít) rượu etylic và axit axetic tiêu thụ tối thiểu là bao nhiêu? Biết rằng hao hụt trong quá trình sản xuất trên là 34%.
Cho: Khối lượng riêng (g/cm3) của etyl axetat, rượu etylic và axit axetic lần lượt là: 0,902; 0,789; 1,049.
HẾT
Năm học mới đã đến gần tặng thầy cô Kế hoạch bài dạy KHTN 8 – Cánh Diều – Năm học 2023 – 2024





