File word Đề thi vào 10 Môn Hóa Chuyên Hạ Long – Quảng Ninh – Năm học 2023
File word Đề thi vào 10 Chuyên Hạ Long – Quảng Ninh – Năm học 2023
Câu 1: (2,5 điểm)
1. a. Có ba gói phân bón hóa học bị mất nhãn. Mỗi gói đựng riêng biệt mộ trong ba loại phân bón hóa học sau: kali clorua, amoni nitrat, supephotphat. Chỉ được dùng thêm một thuốc thử, hãy trình bày phương pháp hóa học nhận biết các gói đựng phân bón trên và viết các PTHH xảy ra.
b. Phân kali thúc đẩy nhanh quá trình tạo ra chất đường, bột, chất xơ…tăng cường sức chống rét, chống sâu bệnh và chịu hạn của cây. Độ dinh dưỡng của phân kali được đánh giá theo tỉ lệ phần trăm khối lượng
2. Nêu hiện tượng và viết
– Cho mẩu nhỏ
– Cho từ từ dung dịch
Hướng dẫn
1. a. Lây mẫu từng loại phân bón, đánh số thứ tự để thuận tiện đối chiếu kết quả thực nghiệm
– Cho dung dịch
b. Để đơn giản mà không thay đổi bài toán, giả sử khối lượng phân là
2. Cho mẩu
3. Hòa tan hỗn hợp chất rắn
Hướng dẫn
Để đơn giản bài toán, chọn số mol mỗi chất trong
Câu 2: (1,75 điểm)
1. Hình vẽ dưới đây mô tả thí nghiệm điều chế khí
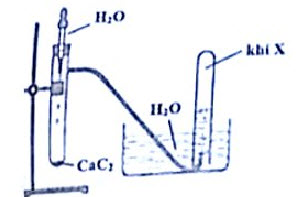
a. Hãy viết PTHH xảy ra trong thí nghiệm. Xác định CTCT và tên gọi của khí
b. Viết phương trình phản ứng của khí
c. Đất đèn ngoài thành phần chính là
2. Iot là một trong những nguyên tố vi lượng cần có trong chế độ dịnh dưỡng của con người. Chế độ ăn uống thiếu hụt Iot sẽ dẫn tới phì đại tuyến giáp gây ra căn bệnh bướu cổ. Một loại nguyên tử của nguyên tố Iot có tổng số hạt là 180 hạt, trong đó số hạt mang điện gấp
3. Cho từ từ 274,4 gam dung dịch
Hướng dẫn
1.
PTHH:
Cho hỗn hợp
2.
3. Chất tan duy nhất là
Câu 3: (2,25 điểm)
1. Giải thích các trường hợp sau và viết
– Than hoạt tính được dùng làm mặt nạ phòng độc, làm chất khử màu, khử mùi…
– Khí hidro được sử dụng làm nhiên liệu thay thế cho than đá, dầu mỏ, khí thiên nhiên…
– Cho bột
Hướng dẫn
– Than hoạt tính cấu tạo xốp nên có tính hấp phụ, có khả năng khử màu, khử mùi.
– Nhiên liệu từ khí hidro thải ra hơi nước không ô nhiễm môi trường nên thay thế cho than đá, dầu mở, khí đốt.
– Cho bột
2. Cho 5,28 gam hỗn hợp
a. Xác định thành phần \% theo khối lượng của mỗi kim loại trong hỗn hợp ban đầu.
b. Tính nồng độ mol của dung dịch
Câu 4: (2,25 điểm)
1. Từ
a. Tìm CTPT của
b. Cho 0,1 mol chất A phản ứng hết với
Hướng dẫn
1.
Thể tích rượu etylic sản xuất được:
2. a. Đun nóng dung dịch
Suy ra:
Vậy
Câu 5: (2,0 điểm)
1. Hiện nay, để tận dụng chất thải chăn nuôi đồng thời giảm chi phí năng lượng và hạn chế ô nhiễm môi trường, người ta thường dùng bếp Biogas. Loại bếp này sử dụng nhiên liệu là khí metan được sinh ra từ quá trình phân hủy các chất thải chăn nuôi. Nhiệt lượng tỏa ra khi đốt cháy hoàn toàn 1 mol khí metan là
2. Cho thành phần
Hướng dẫn
1. Nhiệt lượng cần đun 1 lít nước:
Thể tích khí metan là:
2. Giả sử
Phần trăm khối lượng của nguyên tố oxi trong






