File word Đề thi vào 10 Chuyên Hóa Tỉnh Bắc Giang – Năm học 2023 – 2024
File word Đề thi vào 10 Chuyên Hóa Tỉnh Bắc Giang – Năm học 2023 – 2024
Cho biết nguyên tử khối của các nguyên tố: H = 1; Li = 7:C-1;N=14:0=1a:Na=23, Mg = 2 Al=27; P=31; S=32; Cl=35,5; K=39; Ca=40; Fe=56; Cu=64; Zn=65; Br=80. Ag=108; Ba=137
Cho biết số hiệu nguyên tử của các nguyên tố: H=1; He=2; Na=11; Mg=12; Al=13; Si=14; CI=17; K=19.
(Thí sinh không được sử dụng Bảng tuần hoàn các nguyên tố hóa học)
Câu 1 (4,0 điểm)
1.1. Nguyên tử nguyên tố X có tổng số ba loại hạt (electron, proton, notron) là 40. Trong hạt nhân nguyên tử X, số hạt mang điện ít hơn số hạt không mang điện là 1 hạt.
- Xác định nguyên tố X.
- Cho phương trình biến đổi hạt nhân: ${}_{Z}^{A}X+{}_{1}^{1}H\xrightarrow{{}}{}_{Z’}^{A’}T+{}_{2}^{4}He$. Xác định nguyên tử T và hoàn thành phương trình.
1.2. Cho m gam Li vào 300 ml dung dịch HCl x M, thu được 0,672 lít H2 (đktc) và dung dịch A. Cho dung dịch A vào 50 ml dung dịch AICl3 0,25M, thu được 0,78 gam kết tủa và dung dịch B. Biết các phản ứng xảy ra hoàn toàn.
- Viết phương trình hóa học các phản ứng có thể xảy ra.
- Xác định m và X.
Câu 2 (4,0 điểm)
2.1. Viết phương trình hóa học giải thích các phát biểu sau:
a) Trong phòng thí nghiệm, dùng bột lưu huỳnh rắc lên thuỷ ngân rơi vãi khi nhiệt kế thủy ngân bị vỡ.
b) Không dùng khí CO2 để dập tắt đám cháy kim loại Mg.
c) Khi dùng nước giếng chứa muối Ca(HCO3)2 sau một thời gian thấy có lớp chất cặn rắn bám ở đáy dụng cụ đun nuớc.
d) Khi điều chế khí sunfurơ để tránh khí thừa thoát ra ngoài thường để miếng bông tẩm xút trên miệng bình thu khí.
e) Thuốc chữa đau dạ dày chứa muối NaHCO3 có tác dụng trung hòa bớt lượng axit HCl trong dạ dày
f) Sục khi SO2 vào dung dịch KMnO4 thì màu tím bị nhạt dần.
g) Điều chế etilen trong phòng thí nghiệm từ rượu etylic.
h) Trong công nghiệp có thể sản xuất giấm ăn từ rượu etylic bằng phương pháp lên men.
2.2. Đốt cháy hoàn toàn m gam hợp chất hữu cơ X (mạch hở, bền) bằng 6,72 lít khí oxi (đktc) chỉ thu được CO2 và H2O. Dẫn toàn bộ sản phẩm cháy vào dung dịch nước vôi trong, sau khi phản ứng xảy ra hoàn toàn thu được 10 gam kết tủa và 200 ml dung dịch muối nồng độ 0,5M có khối lượng lớn hơn dung dịch ban đầu là 8,6 gam. Xác định công thức phân tử và viết các công thức cấu tạo có thể có của X, biết 40 < MX < 74.
Câu 3 (4,0 điểm)
3.1. Cho các dung dịch muối A, B, C, D chứa các gốc axit khác nhau (trong đó B, C là muối của kali)
Cho biết:
– A tác dụng với B thu được dung dịch muối, kết tủa trắng E (không tan trong nước và axit HCl), khí F (không màu, không mùi). Tỉ khối hơi của F so với H2 bằng 17.
– C tác dụng với B thu được dung dịch muối không màu và khí G (không màu, mùi hắc, gây ngạt, nặng hơn không khí, làm nhạt màu dung dịch nước brom).
– D tác dụng với B thu được kết tủa trắng E. Mặt khác, D tác dụng với dung dịch AgNO3 tạo thành kết tủa trắng.
Hãy tìm A, B, C, D, E, F, G và viết phương trình hóa học của các phản ứng xảy ra
3.2. Sục từ từ V lit CO2 (10,08 ≤ V1 ≤ 13,44, ở đktc) vào dung dịch có chứa 0,4 mol Ca(OH)2 thu được m gam kết tủa và dung dịch A. Để phản ứng vừa đủ với dung dịch A cần V2 lít dung dịch gồm HCl 0,3M và HNO3 0,2M. Tìm m và V2, biết các phản ứng xảy ra hoàn toàn.
3.3. Xác định các chất: A, B, D, E, F, G, H, X, Y và viết phương trình hóa học theo sơ đồ chuyển hóa dưới đây (ghi rõ điều kiện của phản ứng nếu có, mỗi mũi tên là 1 phản ứng).
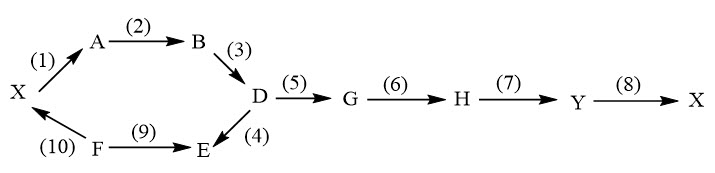
Biết rằng:
– X, Y là các hợp chất vô cơ; A, B, D, E, F, G, H là các hợp chất hữu cơ.
– Đốt cháy hoàn toàn 1,84 gam D thì chỉ thu được 3,52 gam CO2 và 2,16 gam nước.
– Khối lượng mol các chất D, E, F, G, X, Y thỏa mãn điều kiện MD < MF < ME; MD + ME = MY; MG = 2MX
Câu 4 (4,0 điểm)
4.1. Để xác định công thức của một khoáng vật X, tiến hành hai thí nghiệm sau:
– Thí nghiệm 1: Cho 4,44 gam X tác dụng với dung dịch axit HCl (dư), thu được 0,5376 lít (đktc) khí Y (không màu, không mùi, làm đục nước vôi trong nhưng không làm mất màu nước brom).
– Thí nghiệm 2: Nung m gam X đến khối lượng không đổi thu được gam chất rắn Z (chỉ chứa một chất), hỗn hợp gồm khí và hơi không màu, không mùi. Lấy 1,325 gam Z cho tác dụng với dung dịch axit HCl (dư), thu được 0,28 lít khí Y (đktc).
Xác định công thức của X. Biết các phản ứng xảy ra hoàn toàn.
4.2. Đun nóng 19,0 gam hợp chất hữu cơ X (no, mạch hở, phản ứng được với Na) với nước (dư, có mặt xúc tác thích hợp), sau khi phản ứng xảy ra hoàn toàn thu được a gam chất Y (chứa 2 loại nhóm chức) và b gam chất Z (số mol của Y lớn hơn số mol của Z).
+ Đốt cháy hoàn toàn a gam Y cần vừa đủ 0,6 mol O2 chỉ thu được 0,6 mol CO2 và 0,6 mol H2O.
+ Đốt cháy hoàn toàn b gam Z cần vừa đủ 0,3 mol O2 chỉ thu được 0,2 mol CO2 và 0,3 mol H2O.
Xác định công thức phân tử, viết công thức cấu tạo của X, Y, Z (biết X có công thức phân tử trùng với công thức đơn giản nhất).
Câu 5 (4,0 điểm)
5.1. Trong phòng thí nghiệm, khí Z được điều chế như hình 1
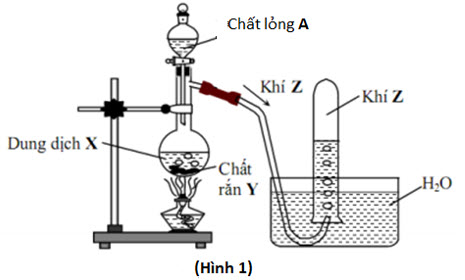
- Nếu nguyên tắc điều chế khí Z.
- Khí Z có thể là khí nào trong số các khí sau: H2, Cl2, C2H2, CO2, SO2, CH4? Viết các phương trình hóa học của phản ứng điều chế khí Z đã chọn.
5.2. Đốt cháy hoàn toàn hỗn hợp X gồm hai hidrocacbon mạch hở (có cùng số nguyên tử cacbon trong phân tử và số mol bằng nhau), thu được 8,8 gam CO2 và 4,5 gam H2O. Xác định công thức cấu tạo của hai hidrocacbon trong X.
5.3. Hòa tan hết m gam hỗn hợp rắn A gồm Mg, Cu(NO3)2, Fe, FeCO3 bằng dung dịch chứa H2SO4 và 0,054 mol NaNO3, thu được dung dịch B chỉ chứa 75,126 gam các muối (không có ion Fe3+) và 7,296 gam hỗn hợp khí X (gồm N2, N2O, NO, H2, CO2; trong đó có 0,024 mol H2). Cho dung dịch NaOH 1M vào dung dịch B đến khi thu được lượng kết tủa lớn nhất là 38,064 gam thì dùng hết 1038 ml dung dịch NaOH. Mặt khác, cho dung dịch BaCl2 vào dung dịch B vừa đủ để kết tủa hết SO42-, sau đó thêm tiếp dụng dịch AgNO3 (dư) vào thì thu được 307,248 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Xác định thành phần phần trăm khối lượng của kim loại Fe có trong hỗn hợp A.
—HẾT—
Cán bộ coi thi không giải thích gì thêm.





