File word Đề thi vào 10 Chuyên Hóa Hải Phòng – Năm học 2023 – 2024
File word Đề thi vào 10 Chuyên Hóa Hải Phòng – Năm học 2023 – 2024


Cho nguyên tử khối của các nguyên tố sau: II = 1; C = 12; 0= 16; Na = 23; Mg = 24; Al = 27; S = 32; CI=35,5; K = 39; Ca= 40; Mn 55; Fe–56; Cu=64; Ba = 137.
Câu 1. (1,0 điểm)
Nguyên tử nguyên tố X có tổng số các hạt proton, electron và notron là 82. Trong hạt nhân nguyên tử X, số hạt mang điện ít hơn số hạt không mang điện là 4.
a) Xác định tên nguyên tố X.
b) Cho đơn chất X tác dụng với dung dịch H2SO4 loãng, dư thu được dung dịch Y. Cho Y tác dụng với Cl2, dung dịch KOH, dung dịch KMnO4. Viết các phương trình hoá học (nếu có).
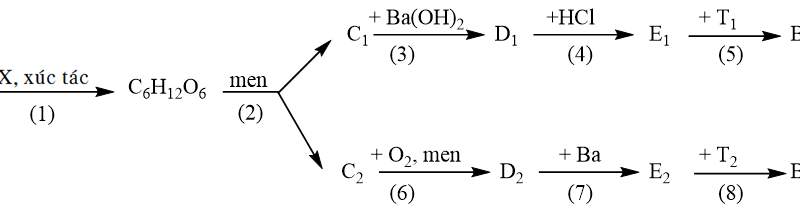
Câu 2. (1,0 điểm)
Cho các dung dịch và chất lỏng đựng trong các lọ riêng biệt: Hồ tinh bột, axit axetic, rượu etylic, etyl axetat, glucozơ được đánh kí hiệu ngẫu nhiên (X), (Y), (Z), (T), (G). Biết:
(X) tham gia phản ứng tráng bạc. (Y) tác dụng được với Na và NaHCO3.
(Z) có thể điều chế trực tiếp từ (X). (T) bị thuỷ phân tạo thành (X).
(G) không tan trong nước, nhẹ hơn nước.
a) Xác định các chất ứng với (X), (Y), (Z), (T), (G) và viết các phương trình hóa học đã nêu ở trên.
b) Chất (X) có ứng dụng trong nhiều lĩnh vực: thực phẩm, sản xuất dược phẩm, tơ nhân tạo, chất dẻo, thuốc diệt côn trùng… Viết phương trình hoá học điều chế chất (Y) từ C4H10 và từ C2H5
Câu 3. (1,0 điểm)
3.1. Nêu hiện tượng và giải thích bằng phương trình hoá học (nếu có) trong các thí nghiệm sau:
a) Ngâm lá Zn vào dung dịch FeCl3 dư.
b) Cho một mẫu kim loại Ba vào dung dịch CuSO4.
c) Sục khí SO2 vào dung dịch KMnO4.
d) Nhỏ dung dịch Ba(HSO3)2 dư vào dung dịch KHSO4.
3.2. Từ Fe, S, dung dịch HCl và các dụng cụ, điều kiện cần thiết, lập hai sơ đồ điều chế khí H2S. Viết các phương trình hoá học theo mỗi sơ đồ.
Câu 4. (1,0 điểm)
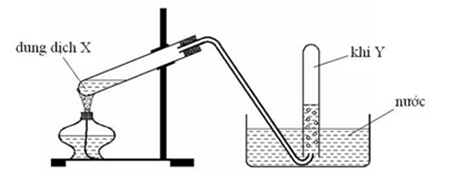
4.1. Trong phòng thí nghiệm, etyl axetat được điều chế bằng cách đun nóng ống nghiệm A gồm: rượu etylic, axit axetic và một ít H2SO4 đặc (Hình 1).
a) Viết phương trình hóa học của phản ứng xảy ra trong thí nghiệm trên. Hãy cho biết vai trò của H2SO4 đặc và cốc nước lạnh trong thí nghiệm.
b) Sau khi kết thúc phản ứng, thêm một ít nước vào ống nghiệm B, lắc nhẹ thì có hiện tượng gì xảy ra?
4.2. Nhận biết sự có mặt của mỗi chất trong hỗn hợp; CH2=CH-CH=CH2, CH≡CH, CH3–CH2–CH3.
Câu 5. (1,0 điểm)
5.1. Cho 2,24 gam hỗn hợp gồm CaCO3, MgCO3, Mg(OH)2, K2CO3 tác dụng vừa đủ với 10,95 gam dung dịch HCl 20%, thu được 0,224 lít khí CO2 (ở đktc) và dung dịch chứa m gam muối. Viết các phương trình hoá học và tính m.
5.2. Dẫn hơi nước qua than nóng đỏ, thu được hỗn hợp khí X gồm CO2, CO, H2. Tỉ khối hơi của X so với H2 là 7,8. X tác dụng vừa đủ với 24 gam hỗn hợp Y gồm CuO và Fe2O3 nung nóng, thu được chất rắn Z chỉ có hai kim loại. Cho Z vào dung dịch HCl dư thu được 4,48 lít khí H2 (ở đktc). Tính thành phần phần trăm về thể tích của mỗi khí trong X. Biết các phản ứng xảy ra hoàn toàn.
Câu 6. (1,0 điểm)
Cho hai hiđrocacbon mạch hở A (CnHn+2) và B (CmHn). Tổng phân tử khối của A và B là 70 đvC.
a) Xác định công thức phân tử của A và B.
b) Hỗn hợp T gồm 0,2 mol A; 0,1 mol B và 0,3 mol H2. Nung nóng T có xúc tác Ni một thời gian (chỉ xảy ra phản ứng hiđro hoá), thu được hỗn hợp D có tỉ khối so với H2 là 16,25. Dẫn D qua dung dịch brom dư, sau khi phản ứng kết thúc thấy có a mol Br2 tham gia phản ứng. Tính a.
Câu 7. (1,0 điểm)
Nung hỗn hợp X (gồm Al và Fe3O4) một thời gian, trong điều kiện không có không khí thu được 54,5 gam hỗn hợp Y. Giả sử chỉ xảy ra phản ứng khử Fe3O4 thành Fe. Hòa tan hoàn toàn Y bằng lượng dư dung dịch H2SO4 đặc, nóng. Sau khi phản ứng kết thúc, thu được dung dịch Z và 12,32 lít khí SO2 (ở đktc).
a) Tính khối lượng mỗi chất trong X.
b) Cho Y tác dụng với dung dịch NaOH dư, sau khi phản ứng kết thúc, thu được 3,36 lít khí H2 (ở đktc). Tính hiệu suất phản ứng nung hỗn hợp X.
Câu 8. (1,0 điểm)
Cho hai chất béo A và B. Phản ứng xà phòng hóa A, B trong dung dịch NaOH xảy ra như sau:
A + NaOH$\xrightarrow{{}}$ C3H5(OH)3 + RCOONa (1)
B + NaOH$\xrightarrow{{}}$ C3H5(OH)3 + RCOONa + C17H33COONa (2)
Đốt cháy hoàn toàn 6,12 gam RCOONa thu được Na2CO3; 7,84 lít khí CO2 (ở đktc) và 6,3 gam H2O.
a) Xác định công thức phân tử của A.
b) Để sản xuất 127,5 kg xà phòng (chứa 72% RCOONa về khối lượng) từ phản ứng (1) cần m1 kg NaOH và m2 kg chất béo A. Biết hiệu suất toàn bộ quá trình là 89%. Tính m1, m2.
c) Xác định công thức cấu tạo của B nếu xà phòng hoá hoàn toàn B thu được sản phẩm gồm: 9,2 gam C3H5(OH)3; 61,2 gam RCOONa và 30,4 gam C17H33
Câu 9. (1,0 điểm)
Mẫu quặng X có thành phần gồm: Na2CO3, NaHCO3 và H2O. Tiến hành hai thí nghiệm sau:
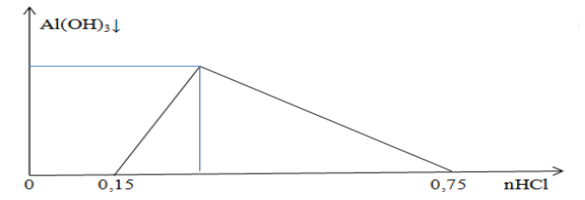
– Thí nghiệm 1: Nung 226 gam X đến khối lượng không đổi. Sự phụ thuộc khối lượng chất rắn (m gam) thu được theo thời gian (t) được biểu diễn như đồ thị hình bên.
– Thí nghiệm 2: Cho 56,5 gam X tác dụng với dung dịch HCl dư, sau khi kết thúc phản ứng thu được 11,2 lít khí CO2 (ở đktc).
a) Viết phương trình hoá học xảy ra.
b) Tính thành phần phần trăm về khối lượng của Na2CO3 trong quặng X.
Câu 10. (1,0 điểm)
10.1. Một bình gas (cho loại bếp gas du lịch) chứa 190 gam butan (C4H10). Biết:
– Đốt cháy 1 mol butan toả ra nhiệt lượng 2850 kJ.
– Để 1 gam nước tăng 1°C cần dùng nhiệt lượng 4,18 J (${{D}_{{{H}_{2}}O}}$ = 1 g/ml).
– Nhiệt lượng bị thất thoát ra môi trường xung quanh là 25%.
Tính số lít nước (từ 20°C) có thể đun sôi (100°C) khi dùng toàn bộ lượng butan trong bình gas.
10.2. Nước thải của một nhà máy có pH < 7. Bằng thí nghiệm thấy rằng cứ 5 lít nước thải cần dùng 1 gam Ca(OH)2 để trung hoà. Tính khối lượng CaO cần dùng để trung hoà lượng nước thải mỗi ngày. Biết nhà máy hoạt động 24 giờ/ngày, mỗi giờ nhà máy thải ra 100 000 lít nước.
———-HẾT ————
– Thí sinh được sử dụng Bảng tuần hoàn Hóa học do NXB GDVN phát hành.
– Thi sinh làm bài trên giấy thi, không sử dụng tài liệu.