Ảo thuật Hóa học – Thí nghiệm vui cùng hóa học
Ảo thuật Hóa học hay các thí nghiệm đa dạng và độc đáo, mang đến những phản ứng hóa học đầy màu sắc và kỳ diệu. Từ tạo bong bóng khói cho đến biến nước thành màu sắc khác nhau, mỗi thí nghiệm đều khiến bạn cảm thấy thích thú và kinh ngạc.
Đặc biệt, thí nghiệm hóa học vui còn giúp tăng cường khả năng quan sát, logic và kỹ năng thực hành của bạn. Nó không chỉ là giải trí mà còn là cách tuyệt vời để khám phá và khơi gợi sự tò mò của mình.
A. MỘT SỐ THÍ NGHIỆM VỚT KHÍ AMONIAC
Không có lửa.. mà lại có khói
Lấy hai đũa thủy tinh ở đầu có quấn một ít bông. Nhúng một đũa vào dung dịch axit nitric (hoặc axit clohiđric) đậm đặc và nhúng đũa thứ hai vào dung dịch amoniac $25 \%$. Đưa hai đầu đũa lại gần nhau. Khói trắng sẽ xuất hiện ở hai đầu đũa do sự tạo thành amoni nitrat (amoni clorua).
NH3 + HNO3 —> NH4NO3
Nhóm bếp than bằng đũa thủy tinh
Xếp một ít than gỗ vào bếp như để nhóm lò, xong lấy đầu đũa thủy tinh châm vào đống than lập tức đống than bốc khói nghi ngút.
Cách làm: Bỏ than gỗ vào túi bằng vải màu rồi treo trong bình rộng miệng bên dưới có đựng dung dịch NH3 đậm đặc trong vài ngày. Khí NH3 sẽ bị hút vào than. Khi biểu diễn thí nghiệm, đũa thủy tinh cần được nhúng vào axit HCl đặc. Khí HCl gặp NH3 sẽ tạo ra khói trắng là những hạt nhỏ NH4Cl theo phản ứng:
NH3 + HCl —> NH4Cl
Lửa và khói
Đặt bốn miếng bông lềnmiếng kính. Các miếng bông đã tẩm các dung dịch sau: Miếng thứ nhất tẩm cồn, mổeng thứ hai – dung dịch $\mathrm{NH}_{3}$ đậm đặc, miếng thứ ba benzen, miếng thứ tư – dưng dịch $\mathrm{HCl}$ (pha 1 thể tích dung dịch $\mathrm{HCl}$ đậm đặc với một thể tích nước). Để bốn miếng kính đó cách xa nhau khoảng $25-30 \mathrm{~cm}$, miểng kính đặt bông tẩm dung dịch $\mathrm{NH}_{3}$ aà HCli phải đặt ở hai đầu.
Sau đó giới thiệu ngọn lửa không có khói, ngọn lửa có khói và có khói nhưng không có lửa.
Châm lửa đốt bông tẩm cồn trước, rồi tới bông tẩm benzen, sau cùng gắp miếng bông tẩm $\mathrm{HCl}$ đặt lên miếng bông tẩm dung dịch $\mathrm{NH}_{3}$.
Chú ý:
– – Có thể thay cồn bằng các chất khác như axeton, dietyl ete.
– – Nên tẩm ít benzen vì benzen cháy rất nhiều khói, rất rõ và lâu. – – Dung dịch $\mathrm{HCl}$ nên pha tỉ lệ 1 : 1 như trên để không có khí HCl bay ra quá nhiều, người xem dễ nhận thấy có khói trước.
Mưa lửa
Rót $100 \mathrm{ml}$ dung dịch amoniac vào một bình miệng rộng rồi đun nhẹ, sau đó đổ từ từ vào bình bột $\mathrm{Cr}_{2} \mathrm{O}_{3}$ đã được đun nóng trên một miếng kim loại. Những đốm lửa sáng như sao lả tả rơi xuống giống như trận mưa lửa.
Nếu ta đổ vào dung dịch amoniac một ít rượu etylic, phản ứng sẽ xảy ra mạnh hơn.
Giải thích: Ở đây không phải $\mathrm{Cr}_{2} \mathrm{O}_{3}$ tác dụng với $N_{3}$ mà là quá trình oxi hóa $\mathrm{NH}_{3}$ bởi oxi của không khí có $\mathrm{Cr}_{2} \mathrm{O}_{3}$ làm xúc tác.
$$
4 \mathrm{NH}_{3}+3 \mathrm{O}_{2}–>2 \mathrm{~N}_{2}+6 \mathrm{H}_{2} \mathrm{O}
$$
Phản ứng xảy ra trên bề mặt của các hạt $\mathrm{Cr}_{2} \mathrm{O}_{3}$ và tỏa ra rất nhiều nhiệt làm các hạt này nóng sáng lên.
Tạo ra màu hông vang nưóc lã
Thêm vài $\mathrm{ml}$ dung dịch amoniac đậm đặc $(25 \%)$ và 2 – 3 giọt dung dịch phenoltalein vào cốc đựng $50 \mathrm{ml}$ rượu etylickban. Hỗn hợp không có màu.
Khi biểu diễn, bạn nhờ một khán giả nào đó múc một cốc nước lã để pha dần vào hỗn hợp trên. Khi đổ nước màu hồng xuất)hiện và càng đổ thêm nước thì màu hồng càng đậm hơn.
Giải thích: Khi đổ thêm nước, $\mathrm{NH}_{3}$ sẽ tác dụng với nước theo phản ứng sau:
$$
\mathrm{H}_{2} \mathrm{O}<—>\mathrm{NH}_{4}^{+}+\mathrm{OH}^{-}
$$
Ion $\mathrm{OH}^{-}$làm cho phenoltalein chuyển sang màu hồng. Càng đổ thêm nước càng xuất hiện thêm nhiềujion $\mathrm{OH}^{-}$.
Làm đổi màu hoa giấy
Cắm ngược bó hoa giấy màu trắng vào một chiếc bình cỡ lớn, lập tức nó sẽ biến thành bó hoa có màu sặc sỡ.
Cách làm: Làm một bó hoa bằng giấy thấm trắng. Chia bó hoa đó thành bốn phần. phần thứ nhất để nguyên. Phần thứ hai tâm dung dịch phenoltalein. Phần thứ ba tẩm dung dịch $\mathrm{CuSO}_{4}$ loãng. Phần thứ tư tẩm dung dịch $\mathrm{Hg}\left(\mathrm{NO}_{3}\right)_{2}$. Để khô rồi xếp xen kẽ các bông hoa đã tẩm các dung dịch khác nhau, cả bó hoa vẫn có màu trắng.
Cắm ngược bó hoa vào bình lớn chứa đầy khí $\mathrm{NH}_{3}$, lập tức bó hoa trắng biến thành bó hoa màu.
Những bông tẩm phenoltalein có màu hồng; tẩm $\mathrm{CuSO}_{4}$ có màu xanh; tẩm $\mathrm{Hg}\left(\mathrm{NO}_{3}\right)_{2}$ có màu đen và những bông không tẩm gì, tất nhiên vẫn có màu trắng.
Để có khí $\mathrm{NH}_{3}$ và chỉ việc rót vài $\mathrm{ml}$ dung dịch $\mathrm{NH}_{3}$ đậm đặc vào bình rồi đun nóng.
Giải thích: Màu hồng do ion $\mathrm{OH}^{-}$tác dụng với phenoltalein $\left(\mathrm{OH}^{-}\right.$sinh ra do $\mathrm{NH}_{3}$ tác dụng với hơi nước). Màu xanh do ion $\mathrm{Cu}^{2+}$ tạo với các phâñ tử $\mathrm{NH}_{3}$ thành ion phức $\mathrm{Cu}\left(\mathrm{NH}_{3}\right)_{4}{ }^{2+}$, còn ion $\mathrm{Hg}_{2}\left(\mathrm{NO}_{3}\right)_{2}$ bị phân hủy:
$$
2 \mathrm{Hg}^{+}—>\mathrm{Hg}^{2+}+\mathrm{Hg}
$$
Thủy ngân kim loại được giải phóng dưới dạng bột mịn màu đen.
B. MỘT SỐ THİ NGHIÊAM DỨA TRÊN TÍNH CHẤT CỦA MUỐI COBAN (II)
Mực bí mật
Dùng mực là dung dịch muốicopan màu hồng để viết lên giấy pơluyza hồng sẽ không nhìn thấy nét chữ.
Hơ bức thư lên bếp than, nét chữ sẽ có màu xanh vì nhiệt làm muối coban mất nước và chuyển sang dạng khan
\section{Chùlp ảnh bằng bàn là (bàn ủi)}
Vẽ một bức châñung lên giấy hồng bằng dung dịch muối coban.
Dùng bàn lâ nóng là lên tờ giấy, bức chân dung màu xanh sẽ xuất hiện.
\section{3. Đỏ kết hơp với trắng thành xanh}
Dùng cặp kẹp một mảnh to canxi clorua khan (màu trắng) nhúng một nửa mảnh đó trong 1/2 giây vào dung dịch coban (II) clorua đậm đặc (màu đỏ) đựng trong cốc thủy tinh. Sau đó rút ngay mảnh canxi clorua ra khỏi dung dịch. Phần bị ngập của mảnh canxi clorua trong chốc lát bị nhuộm thành xanh. Giải thích: Canxi clorua khan có tính háo nước nên đã hút nước của muối coban (II) clorua (đehiđrat hóa) biến nó thành thành khan nên có màu xanh.
\section{Tù một chất pha được hai màu}
Bạn hãy lấy một chất rắn, hòa tan vào hai cốc “nước” trong suốt giống hệt nhau, rồi khuấy đều. Hai cốc nước trông giống nhau đó sẽ bị nhuộm thành hai màu khác hẳn nhau: Một cốc màu hồng và một cốc màu xanh.
Giải thich: Chất rắn đem hòa tan là tinh thể của muối coban (II) khan. Còn hai cốc, thật ra chỉ có một cốc là nước còn cốc kia là axeton.
Khi hòa tan vào nước nó có màu hồng, màu của ion coban hiđrat hóa. Còn khi hòa tan vào trong axeton nó có màu xanh, màu của muối khan.
\section{Nóng và nguọi cũngłk̂́c màu}
Một dung dịch màu hồng, đun nóng nó chuyển sang màu tím, để nguội nó lại trở về màu hồng.
Cách làm: Hòa tan $1 \mathrm{~g}$ muối coban (II) clorua vào 2 – $3 \mathrm{ml}$ nước rồi cho thêm vào $1 \mathrm{ml}$ glixerin sẽ được dung dịch có tính chất trên.
Glixerin là chất rất háo nước, nó hự các phân tử nước hiđrat của các ion $\mathrm{Co}^{2+}$ làm thay đổi màu của ion này. Khả năng hút các phân tử nước của glixeron phụ thuộc vào nhiệt độ.

Dùng dung dịch $\mathrm{CoCl}_{2}$ đđậm đặc vẽ lên giấy trắng sẽ được một bức tranh có màu hồng. Căng bức tranh lên bảng bay lên dây. Đặt một bóng đèn điện gần sát bức tranh ở phía dưới vừa để mọi ngườî quan sát cho rõ nhưng đồng thời cũng dùng nhiệt của bóng đèn điện để làm khô các nét yẽ. Nên để bóng đèn điện lệch sang một bên của bức tranh. Sau một thời gian ta sẽ được bức tranh có màu biến đổi theo khoảng cách đối với bóng đèn lần lượt là: tím xấnh, ṭ̂m xanh thẫm, tím hồng, hồng đỏ.

Sau đó ta làm ngược lại bằng cách chuyển chỗ của bóng đèn điện sang phía bên kia của bức tranh và phủ một miếng vải ẩm lên phía đặt ngọn đèn trước kia. Khoảng $2-3$ phút sau ta lại có một bức tranh đổi màu ngược với trước.
Có thể dùng bức tranh màu này để theo dõi thời tiết. Qua biến đổi màu của nó có thể biết được độ ẩm hay khô hanh của không khí.
Giải thích: Tùy theo số phân tử nước mất nhiều hay ít mà nét vẽ có những màu sắc khác nhau.
\section{MỘT SỐ THÍ NGHIÊM VÓT NATRI}
\section{1. Điệu vũ Natri}
Đổ $30 \mathrm{ml}$ nước cùng vài giọt dung dịch phenoltalein vào một cốc dung tích $100 \mathrm{ml}$ và rót $50 \mathrm{ml}$ dầu hỏa sạch lên trên mặt nước. Lấy một miếng natri cạo sạch, nhỏ bằng hạt đậu đặt cẩn thận lên lớp dầu hỏa. Natri chìm xuống, nổi lên rồi lại chìm xuống, cứ như thế khoảng 10 – 20 lần cho đến khi miếng natri tan hết. Trong khi đó lớp nước phía dưới từ trong suốt trở thành đỏ hồng.
Giải thích: Natri nặng hơn dầu hỏa nên chìm xuống. Nhưng khi tiếp xúc với nước thì nó lập tức tác dụng với nước giải phóng hiđro. Bọt khí hidro bao bọc mẩu natri và đệm khí đó đẩy nó nổi lên lớp dầu hỏa. Tại đây, các bọt khí tách ra và mẩu natri lại bị chìm xuống.
\section{Natri đốt cháy khîcocbonic}
Chúng ta đều biết rằng khí $\mathrm{CO}_{2}$ không cháy được nên được dùng làm chất chữa cháy. Thế mà natri đốt cháy được $\mathrm{CO}_{2}$ đấy! Để chưng minh điều này bạn có thể biểu diễn thí nghiệm sau đây:
Nạp đầy khí $\mathrm{CO}_{2}$ vào một bình thưy tinh, đưa que đóm đang cháy vào bình, que đóm sẽ tắt ngay.
Bây giờ bạn dùng pipet để nhỏ xuống đáy bình vài giọt nước rồi thả mẩu natri bằng hạt đỗ vào giọt nước. Natri tác dụng với nước và bốc cháy trong khí quyển $\mathrm{CO}_{2}$ theo phản ứng:
Thí nghiệm trên cũụg chứng tỏ rằng không thể dập tắt natri đang cháy bằng khí $\mathrm{CO}_{2}$ mà phải dập bằng cát hoă̆c đất khô.

Dùng loại giấy thấm nước để gấp một cái tàu chiến. Bỏ vào trong tàu một mẩu kim loại natri hoặc kali to bằng hạt đậu rồi thả vào chậu nước đã được nhỏ thêm vài giọt phenoltalein không màu. Sau vài phút, tàu sẽ tự bốc cháy và nước trong chậu có loang màu hồng từ chỗ con tàu cháy, giống như cảnh tàu chiến địch bị bắn cháy, máu giặc nhuốm đỏ dòng sông.
Giải thích: Nước thấm qua giấy, tác dụng với natri (hoặc kali) theo phương trình hóa học sau: GV: Trương Thế Thảo
$$
\begin{gathered}
2 \mathrm{Na}+2 \mathrm{H}_{2} \mathrm{O}–>2 \mathrm{NaOH}+\mathrm{H}_{2} \uparrow \\
\text { hoặc: } 2 \mathrm{~K}+2 \mathrm{H}_{2} \mathrm{O}-\cdots 2 \mathrm{KOH}+\mathrm{H}_{2} \uparrow
\end{gathered}
$$
Phản ứng trên tỏa nhiều nhiệt, làm cho khí hidro thoát ra tự bốc cháy, đồng thời $\mathrm{NaOH}$ (hoặc $\mathrm{KOH})$ tạo thành làm cho phenoltalein không màu chuyển sang màu hồng.
Chú ý: Trong thí nghiệm này, mẩu natri hoặc kali nhất thiết chỉ được lấy to bằng hạt đậu. Nếu lấy to hơn, phản ứng xảy ra mãnh liệt sẽ nổ gây nguy hiểm.
\section{Cháy trong khí cacboní}
Dùng kẹp sắt kẹp một đầu đoạn dây magie rồi đốt đầựây kia cho cháy sáng. Sau đó đưa vào trong cốc đựng khí cacbonic. Magie tiếp tục cháy sáng chói trong khí cacbonic, phản ứng tạo ra magie oxit màu trắng bám đầY xào kép sắt và rơi xuống đáy cốc, đồng thời tạo ra những vụn cacbon màu đen ở đáy cố.
$$
\text { 1. Dung dick hát quang màu đỏ }
$$
Bạn hãy cho khí clo sụo từ tữ vào dung dịch chứa $10 \mathrm{~g} \mathrm{NaOH}$ và $30 \mathrm{ml} \mathrm{H}_{2} \mathrm{O}_{2} 3 \%$ trong $100 \mathrm{ml}$ nước. Khi đó sẽ xayy ya phản ứng:
$$
\stackrel{\leftrightarrow}{4} \mathrm{Cl}_{2}+\mathrm{H}_{2} \mathrm{O}_{2}–>2 \mathrm{HCl}+\mathrm{O}_{2}
$$
Oxi sinh ra trong phảnứng luôn luôn ở trạng thái kích thích và phát ra ánh sáng màu đỏ. Nếu bạn myốn có một không gian sáng tỏ, bạn chỉ việc hướng dòng khí clo lên bề mặt dung dịch.
\section{Dung dịch huỳnh quang}
Lấy một ít lá xanh bất kỳ ngâm vào rượu để chiết lấy diệp lục tố. lọc lấy dung dịch và bảo quản trong bóng tối. Ban đêm dưới tác dụng của một chùm ánh sáng trắng, dung dịch này sẽ phát ra ánh sáng màu đỏ. GV: Trương Thế Thảo
\section{Dung dịch phát sáng trong bóng tối}
Lấy $1 \mathrm{~g}$ hidroquinon và $5 \mathrm{~g}$ potat hòa tan trong $40 \mathrm{ml}$ dung dịch fomandehit $10 \%$ đổ vào trong bình lớn hơn 1 lít và đặt ở nhiệt độ phòng.
Khi mắt đã quen với bóng tối thì thêm $15 \mathrm{ml}$ dung dịch hidropeoxit $\mathrm{H}_{2} \mathrm{O}_{2}$. Trong bình sủi bọt và xuất hiện ánh sáng màu vàng.
Sự phát quang ở đây là do hidroquinon bị oxi hóa bằng $\mathrm{H}_{2} \mathrm{O}_{2}$ trong môi trường kiềm. Năng lượng thoát ra hầu như hoàn toàn chuyển thành ánh sáng, một phần phát ra dưới dạng nhiệt và làm cho fomandehit bốc hơi (do đó không nên đậy bình).
\section{Chiếc bình phát sárîn}
Trộn $200 \mathrm{~g} \mathrm{~K}_{2} \mathrm{SO}_{4}$ với $81,5 \mathrm{~g} \mathrm{Na} \mathrm{SO}_{4}$, đổ một ít nước nớng vào hỗn hợp đến khi tất cả các tinh thể muối đều tan. Để nguội dung dịch trong phòng tối.
Sau khi nguội, trong dung dịch kết tinh khá nhiều tinh thể muối mới và sự tạo thành mỗi tinh thể kèm theo sự phát sáng. Những tia sáng yếu xuất hiện ngay từ nhiệt độ $60^{\circ} \mathrm{C}$, sau đó trở nên sáng hơn và cuối cùng xuất hiện như một trận mưa các tia sáng màu xanh lam nhạt (thời gian này phải đợi khá lâu, khoảng 1 tiếng rưỡi). Đôi khi những tia sáng hình như nhảy từ thành bình bên này sang thẳnh bình bên kia. Ghé tai vào thành bình, bạn sẽ nghe thấy những tiếng lép bép nhỏ. Thật là “cơn giông tố trong thế giới vi mô”.
Khi sự phát sáng ngừng, ta có thể tạo lại một lần nữa bằng cách lắc bình hay dùng đũa thủy tinh đảo các tinh thể muối dưới chất lỏng.
Giải thích: Trong thí nghiệm nây, sự phát sáng có liên quan tới quá trình hóa học: Sự tạo thành muối kép $2 \mathrm{~K}_{2} \mathrm{SO}_{4} \cdot \mathrm{Na}_{2} \mathrm{SO}_{4} \cdot 10 \mathrm{H}_{2} \mathrm{O}$ và quá trình kết tinh của nó. MỘT SỐ THÍ NGHIỆM VỚI CÁC CHÂT KHÁC 1. Mưc bí mật
Dựa trên tính háo nước của $\mathrm{H}_{2} \mathrm{SO}_{4}$ để làm mực bí mật.
Lấy đũa thủy tinh chấm dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ loãng để viết lên giấy một bức thư ngắn, nét chữ sẽ không có màu.
Hơ bức thư lên bếp than hoặc bàn là nóng, nước ở nét chữ sẽ bay hơi làm cho $\mathrm{H}_{2} \mathrm{SO}_{4}$ trở nên đậm đặc, nó sẽ chiếm nước của chất xenlulozơ là thành phần chính của giấy và giải phóng cacbon, làm cho nét chữ hóa đen.
\section{$\left(\mathrm{C}_{6} \mathrm{H}_{10} \mathrm{O}_{5}\right)_{\mathrm{n}}—>6 n \mathrm{C}+5 \mathrm{nH}_{2} \mathrm{O}$ (chất xúc tác: $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc) Xenlulozo}
GV: Trương Thế Thảo
\section{Những chiếc cốc “thần”}
Bạn bày một loạt những chiếc cốc không lên bàn và tuyên bố đó là những chiếc cốc có phép thần. Bạn lần lượt ném những mẩu bông vào các cốc trên, các mẩu bông sẽ tự bốc cháy.
Cách làm và giải thích: Ở đáy mỗi cốc, bạn cho một ít hỗn hợp sền sệt của $\mathrm{KMnO}_{4}$ và $\mathrm{H}_{2} \mathrm{SO}_{4}$ đậm đặc. Với lượng nhỏ hỗn hợp này ở đáy cốc người xem sẽ không nhìn thấy. Bạn viên những mẩu bông đem tẩm cồn rồi ném vào các cốc trên. Khi bông tiếp xúc với hỗn hợp nó sẽ tự bốc cháy.
\section{3. Đài phun nước}
Bạn có thể làm một cái đài phun nước nhỏ bé, xinh xắn để làm đẹp thêm cho mô hình một công viên chẳng hạn.
Muốn vậy, bạn lấy 2 – 3g axit oxalic $\mathrm{H}_{2} \mathrm{C}_{2} \mathrm{O}_{4}$ trộn với 2 – 3g $\mathrm{NaHCO}_{3}$ và đổ hỗn hợp này vào ống nghiệm thể tích khoảng $60 \mathrm{ml}$. Sâu đó, đổ nước vào và nút chặt ống nghiệm bằng nút cao su có ống dẫn khí xuyên qua. Ống này cần cắm tới đáy ống nghiệm. Nước trong ống sẽ phun ra rất mạnh như một đàiphun nước trong công viên vậy.
Giải thich: Giữa dung dịch $\mathrm{H}_{2} \mathrm{C}_{2} \mathrm{O}_{4}$ và muồi $\mathrm{NaHCO}_{3}$ có phản ứng:
$$
\mathrm{H}_{2} \mathrm{C}_{2} \mathrm{O}_{4}+2 \mathrm{NaHCO}_{3}–\mathrm{Na}_{2} \mathrm{C}_{2} \mathrm{O}_{4}+2 \mathrm{H}_{2} \mathrm{O}+2 \mathrm{CO}_{2}
$$
Khí $\mathrm{CO}_{2}$ sinh ra nén rất mạnh lên dung dịch trong ống nghiệm và đẩy nó phun mạnh ra ngoài. hỏa.
Thí nghiệm này cũng có thể minh họa cho nguyên tắc hoạt động của bình cứu
$$
\text { 4. Đốț̇łăy bằng khí cacbonic }
$$
Thật là chuyện lạ đờil Chúng ta ai cũng biết khí $\mathrm{CO}_{2}$ không duy trì sự cháy, nên được dùng làm chất chữa cháy”.
Bạn lấy cặp gắp một miếng bông giơ lên cho mọi người xem rồi cho luồng khí $\mathrm{CO}_{2}$ điều chế từ bìnhKíp thổi vào miếng bông, miếng bông sẽ bùng cháy trước con mắt ngạc nhiên của mọi người.
Cách làm và giải thích: Những miếng bông làm thí nghiệm cần được chuẩn bị trước bằng cách rắc bột natri peoxit $\mathrm{Na}_{2} \mathrm{O}_{2}$ khô lên. Khi thổi khí $\mathrm{CO}_{2}$ vào, $\mathrm{Na}_{2} \mathrm{O}_{2}$ sẽ tác dụng với $\mathrm{CO}_{2}$ theo phương trình hóa học sau:
$$
2 \mathrm{Na}_{2} \mathrm{O}_{2}+2 \mathrm{CO}_{2}–>2 \mathrm{Na}_{2} \mathrm{CO}_{3}+\mathrm{O}_{2}
$$
Phản ứng trên vừa tỏa nhiệt, vừa giả phóng ra $\mathrm{O}_{2}$ nên miếng bông cháy tức khắc.
Website: http://www.violet.vn/thethao0481 Chú ý: Những miếng bông đã tẩm bột $\mathrm{Na}_{2} \mathrm{O}_{2}$ dùng không hết không được để dành lại trong phòng thí nghiệm vì có thể tự bốc cháy do tác dụng của khí $\mathrm{CO}_{2}$ trong không khí. Tốt hơn hết là nên đốt ngay đi.
\section{5. Đốt cháy nước đá}
Bạn lấy một nắm nước đá bỏ vào một ống bơ thấp và rộng miệng rồi bật diêm đốt trên mặt ống bơ. Thật kì lạ! Nước đá bốc cháy.
Cách làm và giải thich: Trong ống bơ, bạn đã đặt sã̃n vài mẩu canxi cacbua $\mathrm{CaC}_{2}$. Khi bỏ nước đá vào, $\mathrm{CaC}_{2}$ sẽ tác dụng với nước, giải phóng khí $\mathrm{C}_{2} \mathrm{H}_{2}$.
$$
\mathrm{CaC}_{2}+2 \mathrm{H}_{2} \mathrm{O}–>\mathrm{C}_{2} \mathrm{H}_{2}+\mathrm{Ca}(\mathrm{OH})_{2}
$$
vậy.
Khí $\mathrm{C}_{2} \mathrm{H}_{2}$ thoát lên mặt nước đá, khi đốt nó sẽ cháyđtrông giống hệt nước đá cháy
Rót dung dịch sắt (II) sunfat vào dung dịch axit oxalic sẽ thu được kết tủa sắt oxalat. Đem lọc và sấy khô kết tủa rồi nung nóng trong ống nghiệm đậy kín không cho không khí lọt vào sẽ xuất hiện những hạt sắt nơng đỏ bay trong ống nghiệm trông như cảnh “sao băng”.
Giải thich: Các phản ứng xảy ra như sau:
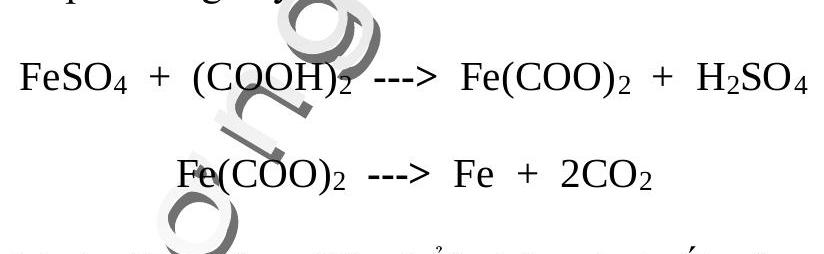
băng.
Phản ứng thứ hai giải phóng $\mathrm{CO}_{2}$ thổi những hạt sắt nóng đỏ bay lên như sao

Nghiền đường thành bột trộn với muối $\mathrm{KClO}_{3}$ theo tỉ lệ bằng nhau về khối lượng.
Đổ hỗn hợp thu được lên một miếng sắt tây rồi vun lại thành một đống nhỏ hình nón, ở đỉnh đánh lõm xuống. Dùng ống nhỏ giọt lấy $\mathrm{H}_{2} \mathrm{SO}_{4}$ đậm đặc và nhỏ vài giọt vào đỉnh lõm của hình nón. Hỗn hợp lập tức bùng lên và gần như cháy một cách chớp nhoáng tạo thành những luồng khói dày đặc, tỏa rộng lên trên hệt như đốt thuốc súng vậy.
Giải thích: $\mathrm{KClO}_{3}$ tác dụng với $\mathrm{H}_{2} \mathrm{SO}_{4}$ tạo ra axit $\mathrm{HClO}_{3}$ :
$$
2 \mathrm{KClO}_{3}+\mathrm{H}_{2} \mathrm{SO}_{4}—>\mathrm{K}_{2} \mathrm{SO}_{4}+2 \mathrm{HClO}_{3}
$$