Đề thi Olympiad hóa học quốc tế Mendeleev lần thứ 56 năm 2022
Đề thi Olympiad hóa học quốc tế Mendeleev lần thứ 56 năm 2022
Ngày thi thứ nhất (11/05/2022)
Câu 1: Trong cuốn tiểu thuyết The Mysterious Island của Jules Verne, có một đoạn viết về việc kĩ sư hóa học Smith đã chế tạo một loại pin để cung cấp năng lượng cho máy điện báo như sau: “Cyrus Smith quyết định chế tạo loại pin đơn giản nhất, tương tự như loại pin do Becquerel phát minh vào năm 1820. Người kỹ sư đã sử dụng một số bình thủy tinh và đổ đầy nitric acid vào chúng rồi đậy lại bằng nút chai và luồn một ống thủy tinh qua đó, đầu dưới cắm một ống tay áo bằng đất sét có quấn một mảnh vải. Ở đầu còn lại của ống này, ông ta đổ dung dịch potash. Sau đó, Smith lấy hai tấm kẽm và nhúng một tấm vào bình chứa nitric acid, tấm còn lại trong ống chứa dung dịch potash thì lập tức có dòng điện chạy từ tấm nhúng vào (1) sang tấm nhúng vào (2). Khi các tấm kẽm này được nối bằng một sợi dây kim loại, tấm trong ống trở thành (3) và tấm trong bình trở thành (4) của thiết bị. Kết quả của quá trình này là tạo ra một nguồn điện tương đối ổn định để giúp máy điện báo có thể hoạt động.”
1.1. a. Giải thích vì sao không thể dùng điện cực kẽm trong quá trình chế tạo của kĩ sư.
Ngoài kẽm hay các kim loại có sẵn trên đảo, Smith có thể dùng vật liệu nào khác để làm điện cực? Do sai sót của tác giả cuốn tiểu thuyết, chúng ta coi như các điện cực của pin được làm bằng vật liệu trơ. 1.2. Điền vào bốn chỗ trống (1) – (4) trong đoạn văn ở trên với các từ cực dương, cực âm, ống và bình. Hình vẽ bên mô tả giản đồ Latimer của nitric acid trong môi trường acid $\left( \text{pH}=0 \right)$.
1.3. a. Xác định các giá trị thế điện cực chuẩn $\text{E}_{\text{x}}^{\text{o}}$ và $\text{E}_{\text{y}}^{\text{o}}$.
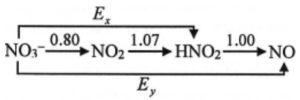
Cho biết sự phụ thuộc của thế điện cực vào $\text{pH}$ của dung dịch trong ba trường hợp ở ${{25}^{\circ }}\text{C}$.
Chỉ rõ quá trình thuận lợi nhất về mặt nhiệt động học trong giản đồ Latimer.
1.4. Xác định cực âm và cực dương, viết các bán phản ứng xảy ra và phản ứng tổng cộng trong pin.
1.5. Tính suất điện động của pin khi đầy năng lượng, biết rằng dung dịch trong bình có $\text{pH}=2$ và trong ống có $\text{pH}=11$.
1.6. Phải mắc nối tiếp bao nhiêu pin như vậy để cung cấp nguồn điện $4.5\text{ }\!\!~\!\!\text{ V}$ cho máy điện báo hoạt động?
1.7. Tính năng lượng Gibbs và hằng số cân bằng của phản ứng xảy ra trong pin.
Cho biết các giá trị thế điện cực chuẩn: $\text{E}_{{{\text{K}}^{+}}/\text{K}}^{\text{o}}=-2.93\text{ }\!\!~\!\!\text{ V},\text{E}_{{{\text{O}}_{2}}/{{\text{H}}_{2}}\text{O}}^{\text{O}}=1.23\text{ }\!\!~\!\!\text{ V}$ và $\text{E}_{\text{Z}{{\text{n}}^{2+}}/\text{Zn}}^{\text{o}}=-0.76\text{ }\!\!~\!\!\text{ V}$. Câu 2: Chất hoạt động bề mặt có khả năng hấp phụ tại bề mặt phân cách, từ đó làm giảm sức căng của bề mặt đó. Đối với $n$ – pentanol, sức căng bề mặt tại mặt phân cách của dung dịch với không khí được biểu diễn bằng phương trình Szyszkowski: $\sigma =\text{K}-\text{L}.\text{ln}\left( 1+\text{Mc} \right)$, với $\text{K}=72.8\text{mN}.{{\text{m}}^{-1}},\text{ }\!\!~\!\!\text{ L}=16.7\text{m}{{\text{N}}^{-1}}$, $\text{M}=66\text{l}$. $\text{mo}{{\text{l}}^{-1}}$ và c là nồng độ của alcohol trong dung dịch.
2.1. Xác định sức căng bề mặt của nước nguyên chất.
2.2. Tính nồng độ nhỏ nhất để tìm thấy $\text{n}$ – pentanol trong dung dịch bằng cách thay đổi sức căng bề mặt, biết sai số của cả quá trình là $2\text{ }\!\!%\!\!\text{ }$.
Độ hấp phụ $\left( \text{G} \right.$, mol. $\left. {{\text{m}}^{-2}} \right)$ của chất hoạt động trên bề mặt thông qua sự tạo thành các lớp riêng biệt có thể được mô tả qua phương trình Gibbs: $\text{G}=\frac{{{\text{G}}_{\text{max}}}\cdot \text{Mc}}{1+\text{Mc}}=\frac{\text{L}}{\text{RT}}\frac{\text{Mc}}{1+\text{Mc}}$, trong đó ${{\text{G}}_{\text{max}}}\left( \text{mol}.{{\text{m}}^{-2}} \right)$ là độ hấp phụ tối đa, $L$ và $M$ là các tham số của phương trình Szyszkowski.
2.3. Cho biết giá trị ${{\text{G}}_{\text{max}}}$ của sự hấp phụ của $\text{n}$ – pentanol tại mặt phân cách lỏng – khí và diện tích mỗi phân tử trong mỗi lớp bão hòa.
Nếu khó xác định diện tích bề mặt mà sự hấp phụ xảy ra, thì sự hấp phụ có thể được biểu diễn qua mol. ${{\text{g}}^{-1}}$ chất hấp phụ, trong khi phương trình Gibbs (với các tham số $\text{M},\text{L}$ ) vẫn có giá trị. Trong một thí nghiệm về sự hấp phụ của $\text{n}$ – pentanol trên than hoạt tính, một mẫu $1\text{ }\!\!~\!\!\text{ g}$ cacbon được cho vào 25 ml alcohol có nồng độ khác nhau $\left( {{\text{c}}_{0}} \right)$. Sau khi cân bằng được thiết lập, than được lọc ra và người ta tính được sức căng bề mặt của dịch lọc ( $\sigma $ ) qua bảng sau:
| ${{\text{c}}_{0}}\left( \text{ }\!\!~\!\!\text{ mo}{{\text{l}}^{-1}}{{\text{l}}^{-1}} \right)$ | $\sigma \left( \text{mN}.{{\text{m}}^{-1}} \right)$ |
| $0.05$ | $59.4$ |
| $0.10$ | $50.8$ |
| $0.15$ | $44.2$ |
| $0.20$ | $38.9$ |
2.4. Xác định nồng độ của alcohol trong dịch lọc ở các nồng độ khác nhau và tính độ hấp phụ của nó đối với carbon (mol. ${{\text{g}}^{-1}}$ ) trong từng thí nghiệm.
2.5. Lập đồ thị biểu diễn mối quan hệ của c/ $\text{G}$ so với c (nồng độ alcohol sau khi cân bằng được thiết lập). Từ số liệu thu được, xác định độ hấp phụ cực đại ${{\text{G}}_{\text{max}}}$ trên than hoạt tính $\left( \text{mol}.{{\text{g}}^{-1}} \right)$.
2.6. Giả sử rằng diện tích mỗi phân tử alcohol trong lớp hấp phụ là như nhau đối với hai mặt phân cách lỏng – khí và lỏng – rắn, hãy tính diện tích bề mặt của than $\left( {{\text{m}}^{2}}\cdot {{\text{g}}^{-1}} \right)$. Câu 3: Bọ rùa đóng một vai trò sinh thái quan trọng trong việc kiểm soát quần thể của một số côn trùng gây hại như rệp. Bọ rùa có ít kẻ thù tự nhiên do cơ chế bảo vệ của chúng dựa trên việc tiết ra chất lỏng có chứa coccinelline $\text{J}\left( {{\text{C}}_{13}}{{\text{H}}_{23}}\text{NO} \right)$. Dưới đây là sơ đồ tổng hợp chất này:
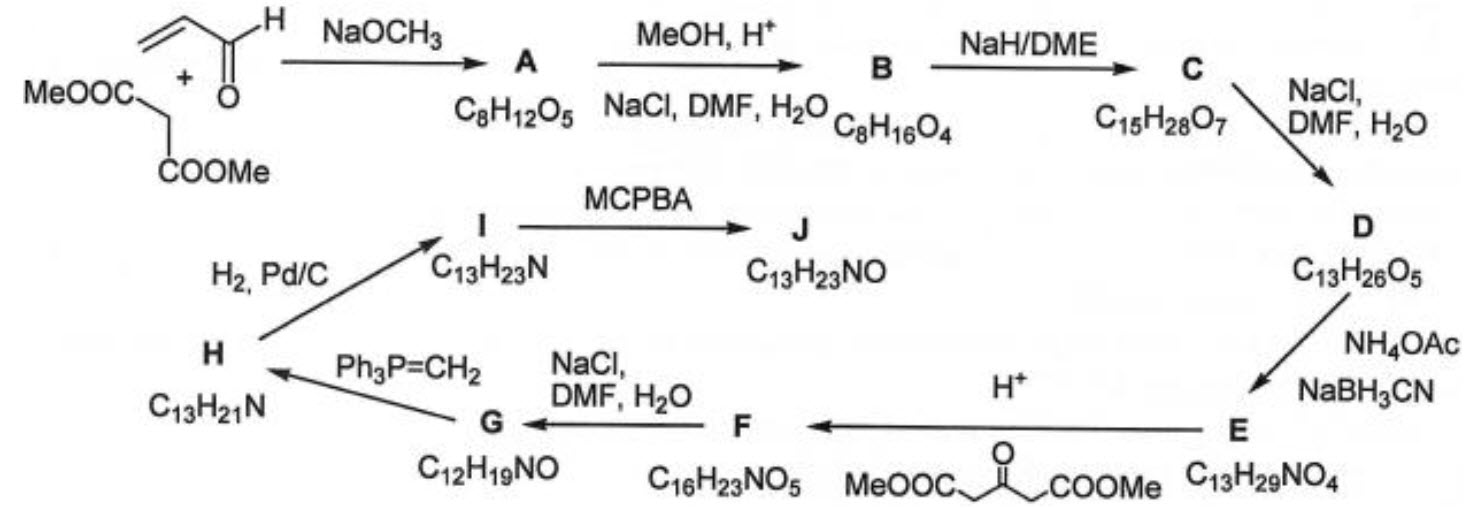
Bước quan trọng trong quá trình tổng hợp này là phản ứng Robinson – Schöpf, lần đầu tiên được sử dụng như một phương pháp để thu được hợp chất bicyclic $\text{X}$, từ đó điều chế nên tropinone $\text{Y}$ :
3.1. Xác định cấu tạo của $X$ và $Y$, nếu xem Robinson – Schöpf là phản ứng cộng Mannich hai lần.
3.2. Vẽ cấu tạo của các chất $\text{A}-\text{J}$ nếu phổ IR của $\text{A}$ có tín hiệu ở $1720\text{ }\!\!~\!\!\text{ c}{{\text{m}}^{-1}}$ và $\text{D}$ có 5 tín hiệu trong phổ ${{~}^{1}}\text{H}$ NMR với tỉ lệ cường độ là $6:2:2:2:1$. Câu 4: Ngưng tụ aldol là một phương pháp phổ biến để hình thành liên kết $\text{C}-\text{C}$. Các quy luật lập thể của phản ứng này rất thú vị.
4.1. Vẽ cấu trúc của các hợp chất carbonyl phi thủ tính và sản phẩm của quá trình ngưng tụ aldol của chúng nếu sản phẩm này chứa 0 tâm thủ tính, 1 tâm thủ tính và 2 tâm thủ tính.
Để giảm thiểu các quá trình không cần thiết, người ta thường sử dụng các enolate được hình thành từ trước, tính chất lập thể của chúng phụ thuộc đáng kể vào cấu trúc của hợp chất carbonyl ban đầu:
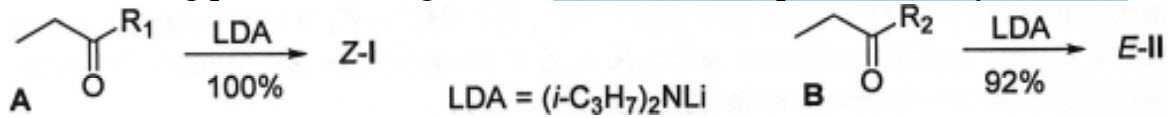
4.2. Xác định cấu trúc của $A,B$, các lithium enolate $\text{Z}$ – I và $\text{E}$ – II, nếu phổ ${{~}^{1}}\text{H}$ NMR $\text{A}$ chứa một quadruplet $\left( 2\text{H} \right)$, triplet $\left( 3\text{H} \right)$ và singlet $\left( 9\text{H} \right)$, còn $\text{B}$ chứa một singlet $\left( 2\text{H} \right)$, quadruplet $\left( 2\text{H} \right)$, singlet $\left( 3\text{H} \right)$, triplet $\left( 3\text{H} \right)$ và singlet $\left( 6\text{H} \right)$. Biết $\text{B}$ được điều chế một cách tự nhiên bằng phản ứng ${{\text{C}}_{\text{X}}}{{\text{H}}_{\text{y}}}+\text{RCOCl}/\text{AlCl}{{~}_{3}}\to \text{B}$.
Khi sử dụng enolate đã chuẩn bị trước, sự ngưng tụ aldol thể hiện tính lập thể cao, được xác định bởi hình học enolate $\left( \text{Z}/\text{E} \right)$. Để dự đoán sản phẩm xuyên lập thể phân chủ yếu (syn – / anti $-$ ) của sản phẩm ngưng tụ, người ta đã đề xuất sử dụng trạng thái chuyển tiếp (TS) là một vòng 6 cạnh:
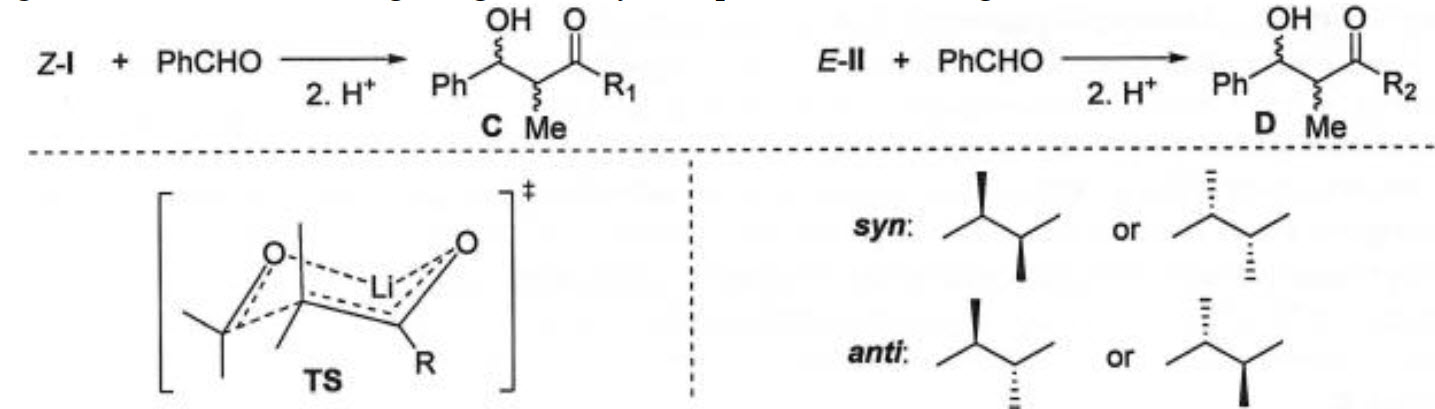
4.3. Thêm các nhóm thế trong TS cho phản ứng $\text{Z}$ – I và $\text{E}$ – II với $\text{PhCHO}$, từ đó cho biết cấu trúc chủ yếu của sản phẩm xuyên lập thể phân cho của $C$ và $D$.
4.4. Tìm mối quan hệ giữa dạng hình học của enolate ban đầu và tính chất lập thể của sản phẩm ngưng tụ.
4.5. Xác định cấu hình của tâm thủ tính trong C.
Dubois nhận thấy rằng hợp chất carbonyl $\text{E}$ khi xử lý với LiOH chuyển thành enolate III, sau đó phản ứng với i – PrCHO rồi thủy phân để tạo thành sản phẩm $\text{F}\left( {{\omega }_{\text{O}}}=20.51\text{ }\!\!%\!\!\text{ } \right)$.
4.6. Vẽ cấu trúc của $\text{E},\text{III}$ và $\text{F}$ kèm lập thể nếu phổ ${{~}^{1}}\text{H}NMR$ của $\text{F}$ chứa hai tín hiệu có cùng cường độ. Câu 5: Tại Thế vận hội mùa đông ở Bắc Kinh, các thí nghiệm liên quan đến kết quả xét nghiệm dương tính với trimetazidine $\left( \text{X} \right)$ của vận động viên trượt băng nghệ thuật $K$. Valieva đã được công bố rộng rãi. Một trong những tờ báo nói về việc loại thuốc bị cấm có thể xuất hiện trong cơ thể dựa trên giả thuyết rằng vận động viên đã sử dụng loại thuốc được Cơ quan phòng chống doping thế giới (WADA) phê duyệt là lomerizine $\text{Y}$ $\left( \text{M}=468\text{ }\!\!~\!\!\text{ g}\cdot \text{mo}{{\text{l}}^{-1}} \right)$ để giảm đau. Theo các tài liệu của WADA, một trong các sản phẩm trung gian của $\text{Y}$ là $\text{X}$, chất có thể gây khó khăn cho việc
xác định các trường hợp sử dụng trimetazidine.
5.1. Xác định tất cả các công thức cấu tạo có thể có của $\text{Y}$, biết rằng tổng tất cả các nhóm thế chưa biết (ngoài $\text{H}$ ) trong phân tử này chứa 4 nguyên tố e1, e2, e3, e4 theo tỉ lệ mol $2:3:3:9$.
Phương pháp sắc ký lỏng – khối phổ $\left( \text{LC}-\text{MS} \right)$ là phương pháp chính để xác định $\text{X}$ và $\text{Y}$. Để phân biệt loại thuốc nào được sử dụng bởi một vận động viên thì người ta xác định sự hiện diện trong nước tiểu của $\text{Z}$ – sinh ra từ những người uống thuốc chứa $\text{Y}$. $\text{Z}$ được hình thành trực tiếp từ $\text{Y}$ bằng xúc tác của cùng một enzyme với phản ứng hình thành $\text{X}$ từ $\text{Y}$. Trong phổ $\text{LC}-\text{MS}$, cả $\text{X}$ và $\text{Z}$ đều cho một peak của phân tử đã proton hóa (với trường hợp của $\text{X}$ là ${{[\text{X}+\text{H}]}^{+}}$trong trường hợp của $\text{X}$ và của $\text{Z}$ là ${{[\text{Z}+\text{H}]}^{+}}$) và biến thiên giá trị $\text{m}/\text{z}$ của các sản phẩm phân giải chính $\left( \text{X}_{1}^{+} \right.$là sản phẩm phân giải của ${{[\text{X}+\text{H}]}^{+}}$và $\text{Z}_{1}^{+}$là sản phẩm phân giải của ${{[\text{Z}+\text{H}]}^{+}}$) đều là 86 .
5.2. Tính tổng phân tử khối của $X$ và $\text{Z}$ và làm tròn đến hàng đơn vị.
Hợp chất trung gian trong chuyển hóa của $\text{Z}$ là hợp chất chứa oxygen ${{\text{Z}}_{2}}$, được tạo thành qua một giai đoạn nhờ xúc tác enzyme. Biết ${{Z}_{2}}$ có 4 loại nguyên tử $\text{H}$.
5.3. Vẽ cấu tạo của $\text{Z}$ và ${{Z}_{2}}$, biết ${{Z}_{2}}$ có 4 loại nguyên tử $H$.
Hướng bài tiết hợp chất $\text{Y}$ ra khỏi cơ thể là hình thành của các chất trung gian ưa nước. Ba trong số các chất này, ${{\text{Y}}_{1}}-{{\text{Y}}_{3}}$ là đồng phân cấu trúc; chất thứ tư $\left( {{\text{Y}}_{4}} \right)$ có khối lượng phân tử lớn hơn ${{\text{Y}}_{1}}30\text{ }\!\!~\!\!\text{ g}$. $\text{mo}{{\text{l}}^{-1}}$. 5.4. Cho biết cấu trúc có thể có của ${{Y}_{1}}$ và ${{Y}_{4}}$ nếu ${{Y}_{1}}-{{Y}_{4}}$ chứa một và chỉ một nhóm giống hệt nhau, mang khả năng ưa nước cho các phân tử này và được hình thành từ $\text{Y}$ trong một giai đoạn.
5.5. Từ các dữ kiện trên, hãy rút ra công thức cấu tạo của $X$.
Chiến lược chuyển hóa của $\text{X}$ cũng giống như của $\text{Y}$. Khi sử dụng $\text{LC}-\text{MS}$ cho phân tử $\text{X}$, người ta chú ý đến tín hiệu của các phân tử proton hóa của hai trung gian ${{\text{X}}_{1}}$ và ${{\text{X}}_{2}}$ với giá trị $\text{m}/\text{z}$ lần lượt là 253 và 333 , cũng như sản phẩm chính của quá trình phân giải ở dạng ion ${{\text{M}}^{+}}$với $\text{m}/\text{z}=167$.
5.6. Xác định cấu tạo của ${{X}_{1}}$ và ${{X}_{2}}$. Cho rằng tính ưa nước tăng dần trong chuỗi $X,{{X}_{1}}$ và ${{X}_{2}},{{X}_{2}}$ được hình thành trong cơ thể trực tiếp từ ${{\text{X}}_{1}}$. Câu 6: Iodine được sử dụng rộng rãi trong y học như một chất khử trùng. Vì chất này ít tan trong nước (cần $3450\text{ml}$ nước để hoà tan $1.00\text{ }\!\!~\!\!\text{ g}$ chất này) nên một dung dịch alcohol gồm iodine và dung dịch Lugol có nhiều ứng dụng thực tế.
6.1. Tính nồng độ mol $\left( \text{M} \right)$ của iodine trong dung dịch bão hòa (coi thể tích không thay đổi khi hòa tan). Khi chiết xuất tại một điểm nút từ pha nước bằng dung môi hữu cơ (ví dụ như carbon tetrachloride $\text{CC}{{\text{l}}_{4}}$ ) thì cân bằng được thiết lập: ${{\text{I}}_{2}}\left( \text{aq} \right)\rightleftharpoons {{\text{I}}_{2}}$ (org) được mô tả bằng hằng số phân bố ${{\text{K}}_{\text{D}}}:{{\text{K}}_{\text{D}}}=\frac{{{\left[ {{\text{I}}_{2}} \right]}_{\text{org }\!\!~\!\!\text{ }}}}{{{\left[ {{\text{I}}_{2}} \right]}_{\text{aq}}}}$.
Một lượng thể tích $\text{CC}{{\text{l}}_{4}}$ cố định được thêm vào dung dịch bão hòa của iodine rồi tiến hành chiết thì thấy phần khối lượng của iodine trong pha hữu cơ lớn hơn $57.2$ lần so với pha nước. Giả sử khối lượng riêng của dung dịch bằng khối lượng riêng của nước là $1\text{ }\!\!~\!\!\text{ g}.\text{m}{{\text{l}}^{-1}}$ và của dung dịch hữu cơ thì bằng khối lượng riêng của $\text{CC}{{\text{l}}_{4}}\left( 1.59 \right.$ g. $\left. \text{m}{{\text{l}}^{-1}} \right)$.
6.2. Tính ${{K}_{D}}$ cho sự phân bố của iodine giữa pha dung dịch và $\text{CC}{{\text{l}}_{4}}$.
Dung dịch Lugol là dung dịch của ${{\text{I}}_{2}}$ trong dung dịch KI $10\text{ }\!\!%\!\!\text{ }$ (về khối lượng). Trong dung dịch này, độ tan của iodine tăng lên nhờ sự tạo thành ion $\text{I}_{3}^{-}$theo phương trình sau:
${{\text{I}}_{2\text{ }\!\!~\!\!\text{ (aq }\!\!~\!\!\text{ })}}+\text{I}_{\left( \text{aq} \right)}^{-}\rightleftharpoons \text{I}_{3\text{ }\!\!~\!\!\text{ (aq) }\!\!~\!\!\text{ }}^{-}$
${{\text{K}}_{1}}=\frac{{{\left[ \text{I}_{3}^{-} \right]}_{\text{aq}}}}{{{\left[ {{\text{I}}_{2}} \right]}_{\text{aq}}}{{\left[ {{\text{I}}^{-}} \right]}_{\text{aq}}}}\text{. }\!\!~\!\!\text{ }$
6.3. Cho biết dạng hình học của ion $\text{I}_{3}^{-}$theo thuyết $\text{VSEPR}$, loại phân tử $\text{A}{{\text{X}}_{\text{n}}}{{\text{E}}_{\text{m}}}(\text{X}$ là phối tử và $\text{E}$ là cặp electron không liên kết của nguyên tử trung tâm $\text{A}$ ) và giá trị góc $\text{I}$ – $\text{I}$ – $\text{I}$.
Để tìm giá trị ${{K}_{1}}$, người ta lấy $100\text{ml}$ dung dịch Lugol (cũng lấy khối lượng riêng là $1\text{ }\!\!~\!\!\text{ g}.\text{m}{{\text{l}}^{-1}}$ ) và tiến hành chiết bằng carbon tetrachloride với thể tích $50\text{ml}$. Để chuẩn độ $10.00\text{ml}$ pha dung dịch và hữu cơ thì cần lần lượt $3.70\text{ml}$ và $13.90\text{ml}$ dung dịch sodium thiosulfate có nồng độ $0.2500\text{M}$.
6.4. Viết các phương trình phản ứng giữa ion thiosulfate, ${{\text{I}}_{2}}$ và ion $\text{I}_{3}^{-}$xảy ra trong quá trình chuẩn độ.
6.5. Xác định phần trăm về khối lượng của ${{\text{I}}_{2}}$ trong dung dịch Lugol đã dùng và hằng số ${{\text{K}}_{1}}$. Câu 7: Khi nung đầu kim bằng thép cho nóng đỏ trong ngọn lửa đèn cồn rồi đưa nhanh vào bình đựng khí oxygen thì kim cháy với ngọn lửa rực rỡ, phát ra tia lửa như ngọn lửa Bengal. Việc làm này đồng thời tạo ra một chất rắn màu đen.
7.1. Viết phương trình xảy ra khi kim thép cháy trong oxygen.
Như bạn đã biết, nếu không có sự nung nóng và oxygen thì sắt sẽ không cháy. Thế nhưng, trong các sách về thí nghiệm hóa học và trên Internet thì bạn có thể tìm thấy một số hướng dẫn để điều chế “pyrophoric iron”, chất này cháy mà không cần nung nóng khi tiếp xúc với không khí, gần giống như một cái kim thép. Ở giai đoạn đầu tiên của quá trình điều chế, khi ta thêm dung dịch potassium oxalate (hoặc oxalic acid) vào lượng dư dung dịch của sắt sulfate thì thu được kết tủa A màu vàng. Biết rằng phần trăm khối lượng của oxygen trong A là $53.36\text{ }\!\!%\!\!\text{ }$.
7.2. Tìm công thức phân tử của $\text{A}$.
Ở giai đoạn thứ hai, ta lọc kết tủa thu được, làm khô rồi đun nóng mạnh trong ống nghiệm đậy kín bằng tăm bông. Kết quả, theo các tác giả thì sẽ thu được “pyrophoric iron”. Nếu để nguội ống nghiệm có chất bột màu đen đến nhiệt độ phòng, sau đó lấy tăm bông ra và từ từ đổ chất trong đó ra thì sản phẩm khi tiếp xúc với không khí sẽ “phát sáng”, đồng thời xuất hiện các tia lửa.
7.3. Viết phương trình hóa học để điều chế “pyrophoric iron” do các tác giả đề xuất.
Một nghiên cứu thực nghiệm cho thấy nếu đun nóng A trong chân không thì sau khi phân hủy hoàn toàn thì thu được một hỗn hợp khí có khối lượng riêng ở ${{280}^{\circ }}\text{C}$ và $110.8\text{kPa}$ là $0.6507\text{ }\!\!~\!\!\text{ g}.\text{d}{{\text{m}}^{-3}}$.
7.4. Cho biết công thức của các chất có trong hỗn hợp khí và tính phần trăm về số mol của chúng.
7.5. Viết phương trình phản ứng xảy ra khi nhiệt phân A trong chân không.
7.6. Viết phương trình đốt cháy “pyrophoric iron”.
7.7. Chọn đáp án đúng trong các ý sau: Tại sao sản phẩm tạo thành có khả năng cháy trong không khí?
Sản phẩm tạo thành là một chất khử rất mạnh.
Sản phẩm được hình thành dưới dạng các hạt rất nhỏ (hạt nano).
Quá trình đốt cháy sản phẩm bắt đầu do sự hiện diện của các tạp chất trong không khí.
Enthalpy của phản ứng giữa sản phẩm và oxygen là dương.
Cùng với sản phẩm chính trong quá trình nhiệt phân, một chất xúc tác được hình thành, làm tăng tốc độ phản ứng của sản phẩm này với oxygen.
Sự cháy bắt đầu do các chất khí hình thành trong quá trình phân hủy. Câu 8: Nguyên tố $X$ tạo thành nhiều loại acid có oxygen, trong đó nó thể hiện các trạng thái oxid hóa khác nhau. Mặc dù vậy, nguyên tắc cấu tạo nên các hợp chất này không phức tạp: luôn chứa nguyên tố $\text{X}$ với cấu trúc tứ diện hoặc tứ diện lệch và chứa một liên kết đôi với oxygen $\text{X}=\text{O}$. Một hợp chất đơn giản có thể phản ứng và tan ra khi đun nóng trong dung dịch sodium hydroxide đậm đặc. Phản ứng này có nhiều sản phẩm nhưng chủ yếu là khí $G$ và muối ${{\text{B}}_{1}}$. Acid hóa dung dịch muối ${{\text{B}}_{1}}$ tạo ra acid ${{\text{A}}_{1}}$, acid này có thể được phân tách bằng cách chiết trong thời gian dài với diethyl ether từ dung dịch. ${{A}_{cid}}\text{ }\!\!~\!\!\text{ }{{\text{A}}_{1}}$ là những tinh thể màu trắng có nhiệt độ nóng chảy ${{26.5}^{\circ }}\text{C}$.
Nếu một dạng thù hình khác của $\text{X}$ được oxid hóa bằng sodium chlorite hoặc hydrogen peroxide trong môi trường kiềm thì tạo ra muối ${{\text{B}}_{2}}$. Bằng việc trao đổi ion tại cột trao đổi cation thì người ta phân lập được acid dihydrate ${{\text{A}}_{2}}\left( {{\omega }_{\left( {{\text{H}}_{2}}\text{O} \right)}}=18.18\text{ }\!\!%\!\!\text{ } \right)$, sau đó tách nước bằng ${{\text{P}}_{2}}{{\text{O}}_{5}}$ trong chân không để tạo thành acid khan. Phân tử axit ${{\text{A}}_{2}}$ có các yếu tố đối xứng như tâm nghịch đảo, có trục quay bậc hai và mặt phẳng phản xạ vuông góc với nó.
Axit ${{\text{A}}_{2}}$ bị phân hủy ở ${{73}^{\circ }}\text{C}$, tuy nhiên khi ta đun nóng nhẹ thì sẽ diễn ra song song hai quá trình: đồng phân hóa (chuyển vị) thành acid ${{A}_{3}}$ và sự phi tỉ lệ hóa, dẫn đến việc hình thành một hỗn hợp với lượng bằng nhau của hai acid ${{\text{A}}_{4}}$ và ${{\text{A}}_{5}}$. Phân tử ${{\text{A}}_{3}}$ không còn trục quay bậc hai và mặt phẳng phản xạ, theo phương pháp quang phổ NMR trên hạt nhân $\text{X}$ thì có hai nguyên tử $\text{X}$ khác nhau trong cấu trúc. Hai acid ${{\text{A}}_{4}}$ và ${{\text{A}}_{5}}$ rất giống nhau vì đều có mặt phẳng phản xạ. Tuy nhiên, mặt phẳng phản xạ của ${{\text{A}}_{5}}$ chứa nhiều nguyên tử oxygen hơn, khiến nó có nhiều hơn một mặt phẳng phản xạ (vuông góc với mặt phẳng thứ nhất) và một trục quay bậc hai, chạy dọc theo đường giao tuyến của các mặt phẳng. Biết rằng trạng thái oxid hóa của nguyên tố $\text{X}$ tăng dần trong dãy acid ${{\text{A}}_{1}}-{{\text{A}}_{4}}-{{\text{A}}_{2}}-{{\text{A}}_{5}}$.
8.1. Xác định các chất chưa biết và viết các phương trình phản ứng hóa học đã xảy ra.
8.2. Vẽ công thức cấu tạo của các acid ${{\text{A}}_{1}}-{{\text{A}}_{5}}$ kèm theo các yếu tố đối xứng.
$\text{X}$ còn có các acid có oxygen khác nhưng trong số đó có nhiều acid khó thu được ở dạng nguyên chất, chủ yếu biết đến các muối sodium của chúng. Cho biết dãy muối ${{\text{B}}_{6}}-{{\text{B}}_{7}}-{{\text{B}}_{8}}$ có cùng số nguyên tử sodium và X. Số nguyên tử oxygen trong dãy này tăng thêm một nguyên tử và thành phần khối lượng của oxygen trong ${{\text{B}}_{6}}$ và ${{\text{B}}_{7}}$ lần lượt là $38.10\text{ }\!\!%\!\!\text{ }$ và $40.91\text{ }\!\!%\!\!\text{ }$.
8.3. Tìm công thức phân tử của ${{\text{B}}_{6}}-{{\text{B}}_{8}}$.
8.4. Cho biết cấu tạo của anion (gốc acid) trong ${{\text{B}}_{6}}-{{\text{B}}_{8}}$.
10 Comment mình sẽ chia sẻ file Word





ad ơi ad có dịch đề thi men vòng 2 không ạ, nếu có thì có thể chia sẻ cho em được không ạ. em cảm ơn
Không bạn ơi