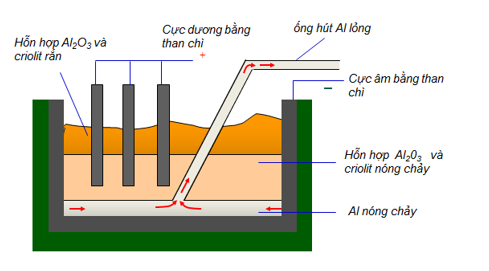
File word Đề thi vào 10 Chuyên Hóa Tỉnh Vĩnh Phúc – Năm học 2023
File word Đề thi vào 10 Chuyên Hóa Tỉnh Vĩnh Phúc – Năm học 2023
Câu 1: (1,0 điểm)
Nêu hiện tượng và viết $\mathrm{PTHH}$ trong các thí nghiệm sau:
– Cho một mẩu $\mathrm{Na}$ vào dung dịch $\mathrm{FeCl}_3$
– Cho $\mathrm{H}_2 \mathrm{SO}_4$ dư vào dung dịch $\mathrm{KOH}$ (thêm vài giọt phenolphtalein)
– Cho $2 \mathrm{ml}$ dầu ăn vào dung dịch $\mathrm{KOH}$ đặc dư, đun nóng đến phản ứng hoàn toàn
– Nhỏ từ từ 1 đến $2 \mathrm{ml}$ dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ đặc vào ống nghiệm chứa đường mía
Hướng dẫn
– Cho mẩu $\mathrm{Na}$ vào dung dịch $\mathrm{FeCl}_3$, phản ứng xảy ra mãnh liệt, tỏa nhiều khí không màu, không mùi, xuất hiện kết tủa nâu đỏ, dung dịch nhạt màu: $6 \mathrm{Na}+6 \mathrm{H}_2 \mathrm{O}+2 \mathrm{FeCl}_3 \rightarrow 6 \mathrm{NaCl}+2 \mathrm{Fe}(\mathrm{OH})_3+3 \mathrm{H}_2$
– Cho $\mathrm{H}_2 \mathrm{SO}_4$ dư vào dung dịch $\mathrm{KOH}$ nhỏ vài giọt phenolphtalein, quan sát thấy phenolphtalein màu hồng trong kiềm nhạt dần rồi mất màu: $\mathrm{H}_2 \mathrm{SO}_4+2 \mathrm{KOH} \rightarrow \mathrm{K}_2 \mathrm{SO}_4+2 \mathrm{H}_2 \mathrm{O}$
– Cho $2 \mathrm{ml}$ dầu ăn thủy phân trong $\mathrm{KOH}$ đặc dư đun nóng đến hoàn toàn, sau phản ứng thấy có lớp bọt trắng nổi lên trên mặt chất lỏng: $\left(\mathrm{C}_{17} \mathrm{H}_{33} \mathrm{COO}\right)_3 \mathrm{C}_3 \mathrm{H}_5+3 \mathrm{KOH} \rightarrow 3 \mathrm{C}_{17} \mathrm{H}_{33} \mathrm{COOK}$ (xà phòng) $+\mathrm{C}_3 \mathrm{H}_5(\mathrm{OH})_3$
– Nhỏ $1-2 \mathrm{ml} \mathrm{H}_2 \mathrm{SO}_4$ đặc vào đường mía, ta thấy đường nhanh chóng chuyển màu nâu, rồi màu đen, thể tích khối đường tăng nhanh chóng:
$$
\mathrm{C}_{12} \mathrm{H}_{22} \mathrm{O}_{11}+\mathrm{H}_2 \mathrm{SO}_{4(\mathrm{~d})} \rightarrow 12 \mathrm{C}_{\text {(than) }}+\mathrm{H}_2 \mathrm{SO}_{4.11} \mathrm{H}_2 \mathrm{O} \quad \mathrm{C}_{12} \mathrm{H}_{22} \mathrm{O}_{11}+24 \mathrm{H}_2 \mathrm{SO}_{4(\mathrm{dặ})} \rightarrow 12 \mathrm{CO}_2+24 \mathrm{SO}_2+35 \mathrm{H}_2 \mathrm{O}
$$
Câu 2: $(1,0$ điểm)
1. Trình bày phương pháp hóa học để tách riêng $\mathrm{C}_2 \mathrm{H}_2$ ra khỏi hỗn hợp gồm: $\mathrm{C}_2 \mathrm{H}_2, \mathrm{C}_2 \mathrm{H}_4, \mathrm{C}_2 \mathrm{H}_6$
2. Cho các hóa chất và dụng cụ sau: bơm chứa khí $\mathrm{CO}_2$, dung dịch $\mathrm{NaOH}$ loãng, hai cốc thủy tinh giống nhau có chia vạch thể tích, đũa thủy tinh. Trình bày cách điều chế dung dịch $\mathrm{Na}_2 \mathrm{CO}_3$ tinh khiết.
Hướng dẫn
2. Cách 1: dẫn khí $\mathrm{CO}_2$ đến dư vào dung dịch $\mathrm{NaOH}$, sau đó đun nóng dung dịch đến khí không còn bọt khí thoát ra ta thu được dung dịch $\mathrm{Na}_2 \mathrm{CO}_3: \mathrm{CO}_2+\mathrm{NaOH} \rightarrow \mathrm{NaHCO}_3 \quad 2 \mathrm{NaHCO}_3 \rightarrow \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O}$ Cách 2: đong 2 cốc đựng thể tích như nhau dung dịch $\mathrm{NaOH}$. Dẫn khí $\mathrm{CO}_2$ đến dư vào cốc 1 , sau đó đổ cốc 1 vào cốc 2 thu được dung dịch $\mathrm{Na}_2 \mathrm{CO}_3: \mathrm{CO}_2+\mathrm{NaOH} \rightarrow \mathrm{NaHCO}_3 \quad \mathrm{NaHCO}_3+\mathrm{NaOH} \rightarrow \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{H}_2 \mathrm{O}$ Câu 3: (1,0 điểm)
Cho $\mathrm{X}, \mathrm{Y}, \mathrm{Z}$ là ba hidrocacbon mạch hở, là chất khí ở điều kiện thường $\left(\mathrm{M}_{\mathrm{X}}<\mathrm{M}_{\mathrm{Y}}<\mathrm{M}_{\mathrm{Z}}\right)$. Đốt cháy hoàn toàn $\mathrm{X}$ hay $\mathrm{Y}$ hay $\mathrm{Z}$ đều thu được số mol nước gấp ba lần số mol hidrocacbon phản ứng. Biết $\mathrm{Y}$ là mất màu nước brom, trùng hợp $\mathrm{Z}$ thu được polime có tính đàn hồi. Xác định $\mathrm{CTCT}$ của $\mathrm{X}, \mathrm{Y}, \mathrm{Z}$ và viết $\mathrm{PTHH}$ xảy ra.
Hướng dẫn
$$
\mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}+2-2 \mathrm{k}}+0,5(3 \mathrm{n}+1-\mathrm{k}) \mathrm{O}_2 \rightarrow \mathrm{nCO}_2+(\mathrm{n}+1-\mathrm{k}) \mathrm{H}_2 \mathrm{O}
$$
$$
1 \rightarrow \quad(\mathrm{n}+1-\mathrm{k}) \quad \text { suy ra: } \mathrm{n}+1-\mathrm{k}=3 \rightarrow \mathrm{n}=\mathrm{k}+2 \rightarrow \mathrm{C}_2 \mathrm{H}_6, \mathrm{C}_3 \mathrm{H}_6, \mathrm{C}_4 \mathrm{H}_6
$$
$\mathrm{Z}: \mathrm{C}_4 \mathrm{H}_6 \mathrm{nCH}_2=\mathrm{CHCH}=\mathrm{CH}_2 \rightarrow-\left(\mathrm{CH}_2 \mathrm{CH}=\mathrm{CHCH}_2\right)_{\mathrm{n}}$ – $(\mathrm{Cao}$ su Buna $)$
$\mathrm{Y}: \mathrm{C}_3 \mathrm{H}_6 \mathrm{CH}_2=\mathrm{CHCH}_3+\mathrm{Br}_2 \rightarrow \mathrm{CH}_2 \mathrm{Br}-\mathrm{CHBr}-\mathrm{CH}_3$ và $\mathrm{X}$ là: $\mathrm{CH}_3 \mathrm{CH}_3$
Câu 4: $(2,0$ điểm)
Cho các dung dịch hoặc các chất lỏng riêng biệt: đường saccarozo, axit axetic, đường glucozo, dầu thực vật. Các chất này đựng trong các ống nghiệm kí hiệu là X, Y, Z, T không theo thứ tự. Thực hiện lần lượt các thí nghiệm với một số thuốc thử, kết quả thu được ở bảng dưới đây:

Xác định các chất $\mathrm{X}, \mathrm{Y}, \mathrm{Z}, \mathrm{T}$ và viết các $\mathrm{PTHH}$ xảy ra.
Hướng dẫn
$\mathrm{X}$ là axit axetic: $\mathrm{CH}_3 \mathrm{COOH}+\mathrm{NaHCO}_3 \rightarrow \mathrm{CH}_3 \mathrm{COONa}+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O}$
$\mathrm{Y}$ là glucozo: $\mathrm{C}_5 \mathrm{H}_6(\mathrm{OH})_5 \mathrm{CHO}+\mathrm{Ag}_2 \mathrm{O} \stackrel{\mathrm{ddNH}}{\longrightarrow} \mathrm{C}_5 \mathrm{H}_6(\mathrm{OH})_5 \mathrm{COOH}+2 \mathrm{Ag}$
$\mathrm{Z}$ là saccarozo: $\mathrm{C}_{12} \mathrm{H}_{22} \mathrm{O}_{11}+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{C}_6 \mathrm{H}_{12} \mathrm{O}_6$ (glucozo) $+\mathrm{C}_6 \mathrm{H}_{12} \mathrm{O}_6$ (fructozo) và $\mathrm{T}$ : dầu ăn không tan trong nước.
Câu 5: $(1,0$ điểm)
Hòa $\tan 16,8$ gam kim loại $\mathrm{R}$ vào dung dịch $\mathrm{HCl}$ dư thu được 6,72 lít khí $\mathrm{H}_2$ (đktc).
a. Tìm $\mathrm{R}$. b. Hòa tan 25,2 gam $\mathrm{R}$ vào dung dịch $\mathrm{H}_2 \mathrm{SO}_4 10 \%$ vừa đủ, thu được dung dịch $\mathrm{X}$. Làm lạnh $\mathrm{X}$ thu được dung dịch muối sunfat bão hòa có nồng độ $9,275 \%$ và 55,6 gam muối Y kết tinh. Tìm CT của Y.
Hướng dẫn
Vậy CT của Y là: $\mathrm{FeSO}_4 \cdot 7 \mathrm{H}_2 \mathrm{O}$.
Câu 6: (2,0 điểm)
Hỗn hợp $\mathrm{X}$ gồm $\mathrm{Al}_4 \mathrm{C}_3, \mathrm{CaC}_2$ và $\mathrm{Ca}$ với số mol bằng nhau. Cho 37,2 gam $\mathrm{X}$ tác dụng hoàn toàn với nước thu được hỗn hợp khí Y. Đun nóng $\mathrm{Y}$ với xúc tác $\mathrm{Ni}$, thu được hỗn hợp khí $\mathrm{Z}$ gồm $\mathrm{C}_2 \mathrm{H}_2, \mathrm{C}_2 \mathrm{H}_4, \mathrm{C}_2 \mathrm{H}_6, \mathrm{H}_2$ và $\mathrm{CH}_4$. Cho $\mathrm{Z}$ qua nước brom dư, thấy khối lượng bình đựng nước brom tăng 3,16 gam và có 12,32 lít hỗn hợp khí $\mathrm{T}$ (đktc) thoát ra ngoài.
a. Tính tỉ khối của $\mathrm{T}$ với $\mathrm{H}_2$.
b. Tính \% thể tích mỗi chất trong T.
c. Tính số mol brom phản ứng với $Z$. Hướng dẫn
Câu 7: (1,0 điểm)
Cho 20,8 gam hỗn hợp $\mathrm{E}$ gồm $\mathrm{Cu}$ và kim loại $\mathrm{R}$ tác dụng với dung dịch $\mathrm{HCl}$ dư, thu được 4,48 lít khí $\mathrm{H}_2$. Nếu cho 20,8 gam $\mathrm{E}$ tác dụng với lượng dư dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ đặc, nóng thì thu được 10,08 lít khí $\mathrm{SO}_2$ (sản phẩm khử duy nhất). Mặt khác, cho 10,4 gam $\mathrm{E}$ tác dụng với $150 \mathrm{ml}$ dung dịch $\mathrm{AgNO}_3 2 \mathrm{M}$, thu được a gam chất rắn. Biết các phản ứng xảy ra hoàn toàn, thể tích các khí đo ở đktc. Tính $\mathrm{a}$.
Hướng dẫn
$\mathrm{TH}_1$ : R không thay đổi hóa trị
$$
\begin{aligned}
& \mathrm{Mg}+2 \mathrm{AgNO}_3 \rightarrow \mathrm{Mg}\left(\mathrm{NO}_3\right)_2+2 \mathrm{Ag} \quad \mathrm{Cu}+2 \mathrm{AgNO}_3 \rightarrow \mathrm{Cu}\left(\mathrm{NO}_3\right)_2+2 \mathrm{Ag} \\
&
\end{aligned}
$$
$\mathrm{TH}_2$ : $\mathrm{R}$ hóa trị thay đổi, hóa trị thấp với $\mathrm{HCl}$ là 2 và hóa trị cao với $\mathrm{H}_2 \mathrm{SO}_4$ đặc là 3 .
$$
\begin{array}{r}
\mathrm{E}\left|\begin{array}{l}
\mathrm{R}^{0,2} \\
\mathrm{Cu}^{\mathrm{c}}
\end{array} \rightarrow\right| \begin{array}{l}
0,2 \mathrm{R}+64 \mathrm{c}=20,8 \\
\underset{\mathrm{BT} . \mathrm{e}}{\longrightarrow} 3.0,2+2 \mathrm{c}=2.0,45
\end{array} \rightarrow\left|\begin{array}{l}
\mathrm{c}=0,15 \\
\mathrm{R}=56 \rightarrow \mathrm{Fe}
\end{array} ; \mathrm{E}^{10,4 \mathrm{~g}}\right| \begin{array}{l}
\mathrm{Fe}^{0,1} \\
\mathrm{Cu}^{0,075}
\end{array} \rightarrow \mathrm{Rắ}^2 \mid \begin{array}{l}
\mathrm{Ag}^{0,3} \\
\mathrm{Cu}^{0,025}
\end{array} \rightarrow \mathrm{a}=34 \\
\mathrm{Fe}+2 \mathrm{AgNO}_3 \rightarrow \mathrm{Fe}\left(\mathrm{NO}_3\right)_2+2 \mathrm{Ag} \quad \mathrm{Cu}+2 \mathrm{AgNO}_3 \rightarrow \mathrm{Cu}\left(\mathrm{NO}_3\right)_2+2 \mathrm{Ag}
\end{array}
$$
Vậy a nhận hai giá trị [37,2 gam ; 34 gam]
Câu 8: (1,0 điểm)
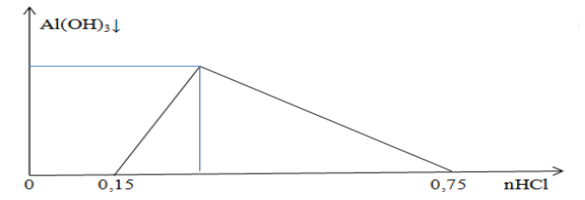
Cho $\mathrm{A}$ là dung dịch $\mathrm{NaHSO}_4 3 \mathrm{M}$, $\mathrm{B}$ là dung dịch hỗn hợp $\mathrm{Na}_2 \mathrm{CO}_3$ và $\mathrm{NaHCO}_3$ có tỉ lệ nồng độ $\%$ tương ứng là $53: 84$. Cho từ từ $100 \mathrm{ml}$ dung dịch $\mathrm{A}$ vào $\mathrm{m}$ gam $\mathrm{B}$, thu được $\mathrm{V}_1$ lít khí $\mathrm{CO}_2$ và dung dịch $\mathrm{E}$. Cho $\mathrm{E}$ tác dụng với dung dịch $\mathrm{Ba}(\mathrm{OH})_2$ dư, thu được 89,6 gam kết tủa. Mặt khác, cho từ từ $\mathrm{m}$ gam $\mathrm{B}$ vào $100 \mathrm{ml}$ dung dịch $\mathrm{A}$, thu được $\mathrm{V}_2$ lít khí $\mathrm{CO}_2$. Biết các phản ứng xảy ra hoàn toàn, các thể tích khi đo ở đktc. Tính $\mathrm{V}_1, \mathrm{~V}_2$.
Hướng dẫn
Giả sử 100 gam $\mathrm{B}$ thì $\mathrm{Na}_2 \mathrm{CO}_3: 5,3 \%$ và $\mathrm{NaHCO}_3: 8,4 \% \rightarrow$ tỉ lệ mol Na $\mathrm{CO}_3: \mathrm{NaHCO}_3=1: 2 \rightarrow \mathrm{a}$ và $2 \mathrm{a}(\mathrm{mol})$
Khi cho $\mathrm{B}$ vào $\mathrm{A}$ thì pứ đồng thời, khi đó số $\mathrm{mol}$ pứ $\mathrm{Na}_2 \mathrm{CO}_3$ : $\mathrm{b}(\mathrm{mol})$ và $\mathrm{NaHCO}_3: 2 \mathrm{~b}(\mathrm{~mol})$
$\mathrm{TN}_1$ : cho $\mathrm{A}$ vào $\mathrm{B}: \mathrm{NaHSO}_4+\mathrm{Na}_2 \mathrm{CO}_3 \rightarrow \mathrm{NaHCO}_3+\mathrm{Na}_2 \mathrm{SO}_4 \quad \mathrm{NaHSO}_4+\mathrm{NaHCO}_3 \rightarrow \mathrm{Na}_2 \mathrm{SO}_4+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O}$
$$
\begin{aligned}
& \mathrm{a} \quad \leftarrow \mathrm{a} \rightarrow \quad \mathrm{a} \quad \mathrm{a} \quad(0,3-\mathrm{a}) \rightarrow(0,3-\mathrm{a}) \quad(0,3-\mathrm{a})(0,3-\mathrm{a}) \\
& \mathrm{NaHCO}_3+\mathrm{Ba}(\mathrm{OH})_2 \rightarrow \mathrm{BaCO}_3+\mathrm{NaOH}+\mathrm{H}_2 \mathrm{O} \quad \mathrm{Na}_2 \mathrm{SO}_4+\mathrm{Ba}(\mathrm{OH})_2 \rightarrow \mathrm{BaSO}_4+2 \mathrm{NaOH} \\
& (4 \mathrm{a}-0,3) \rightarrow \quad(4 \mathrm{a}-0,3) \quad 0,3 \rightarrow \quad 0,2 \\
&
\end{aligned}
$$
Suy ra: $\mathrm{m} \downarrow=197 .(4 \mathrm{a}-0,3)+233 \cdot 0,3=89,6 \rightarrow \mathrm{a}=0,1 \rightarrow \mathrm{V}_1=4,48$ (lít)
$\mathrm{TN}_2$ : cho $\mathrm{B}$ vào $\mathrm{A}: 2 \mathrm{NaHSO}_4+\mathrm{Na}_2 \mathrm{CO}_3 \rightarrow 2 \mathrm{Na}_2 \mathrm{SO}_4+\mathrm{CO}_2 \quad \mathrm{NaHSO}_4+\mathrm{NaHCO}_3 \rightarrow \mathrm{Na}_2 \mathrm{SO}_4+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O}$
$2 \mathrm{~b} \quad \leftarrow \mathrm{b} \rightarrow \quad \mathrm{b}$
$2 \mathrm{~b}$
$\leftarrow 2 \mathrm{~b} \rightarrow$
$2 \mathrm{~b}$
Suy ra: $\mathrm{nNaHSO}_4=4 \mathrm{~b}=0,3 \rightarrow \mathrm{b}=0,075 \rightarrow \mathrm{V}_2=5,04$ (lít).
Câu 9: (1,0 điểm)
Hỗn hợp $\mathrm{E}$ gồm $\mathrm{Cu}, \mathrm{CuO}, \mathrm{Fe}$ và $\mathrm{Fe}_3 \mathrm{O}_4$. Hòa tan hết $\mathrm{m}$ gam $\mathrm{E}$ trong dung dịch chứa $1,5 \mathrm{~mol} \mathrm{HCl}$ (dư $20 \%$ so với lượng phản ứng), thu được $0,125 \mathrm{~mol}$ khí $\mathrm{H}_2$ và $250 \mathrm{gam}$ dung dịch $\mathrm{F}$. Mặt khác, hòa tan hết $\mathrm{m}$ gam $\mathrm{E}$ trong của $\mathrm{H}_2 \mathrm{SO}_4$ ). Cho $\mathrm{G}$ tác dụng với dung dịch $\mathrm{Ba}(\mathrm{OH})_2$ dư, thu được kết tủa T. Nung $\mathrm{T}$ trong không khí đến khối lượng không đổi thu được 199,45 gam chất rắn. Tính nồng độ \% của $\mathrm{FeCl}_3$ trong $\mathrm{F}$.
Hướng dẫn
Với HCl: $\mathrm{H}^{+}+\mathrm{O}^{2-}$ (Oxit) $\rightarrow \mathrm{H}_2 \mathrm{O} \quad 2 \mathrm{H}^{+}+2 \mathrm{e} \rightarrow \mathrm{H}_2 \quad$ Với $\mathrm{H}_2 \mathrm{SO}_4: 2 \mathrm{H}_2 \mathrm{SO}_4+2 \mathrm{e} \rightarrow \mathrm{SO}_4{ }^{2-}+\mathrm{SO}_2+2 \mathrm{H}_2 \mathrm{O}$
Câu 10: $(2,0$ điểm $)$
Cho $\mathrm{X}, \mathrm{Y}, \mathrm{Z}$ là ba este mạch hở (trong đó $\mathrm{X}, \mathrm{Y}$ đơn chức ; $\mathrm{Z}$ hai chức chứa hai gốc axit khác nhau). Đun nóng 28,92 gam hỗn hợp $\mathrm{E}$ chứa $\mathrm{X}, \mathrm{Y}, \mathrm{Z}$ với dung dịch $\mathrm{NaOH}$ vừa đủ, thu được hỗn hợp $\mathrm{F}$ gồm hai muối có tỉ lệ mol $1: 1$ và hỗn hợp $\mathrm{G}$ gồm hai ancol no, cùng số nguyên tử cacbon. Cho $\mathrm{G}$ vào bình đựng Na dư, thấy khối lượng bình tăng 12,15 gam. Đốt cháy hoàn toàn $\mathrm{F}$ thu được $\mathrm{CO}_2 ; 10,53$ gam $\mathrm{H}_2 \mathrm{O}$ và 20,67 gam $\mathrm{Na}_2 \mathrm{CO}_3$. Tính \% khối lượng của $\mathrm{Z}$ trong $\mathrm{E}$.
Hướng dẫn
Để đơn giản, đưa 2 ancol no, cùng số $\mathrm{C}$ về hỗn hợp: $\mathrm{C}_2 \mathrm{H}_5 \mathrm{OH}, \mathrm{C}_2 \mathrm{H}_4(\mathrm{OH})_2, \mathrm{CH}_2$; trong đó: $\mathrm{nCH}_2=$ k.n(2 ancol).
$\left|\begin{array}{l}\mathrm{Na}_2 \mathrm{CO}_3{ }^{0,195} \\ \mathrm{NaOH}^{0,39} \\ \mathrm{OH}_{\text {ancol }}{ }^{0,39}\end{array} \stackrel{\text { BTKL }}{\longrightarrow}\right| \begin{aligned} & \mathrm{m}_{\mathrm{E}}+\mathrm{m}_{\mathrm{NaOH}}=\mathrm{m}_{\mathrm{F}}+\mathrm{m}_{\mathrm{G}} \\ & \mathrm{F}^{31,98 \mathrm{~g}} \rightarrow \mathrm{M}_{\mathrm{F}}=82 \\ & \mathrm{HCOONa}^{0,195} ; \mathrm{C}_2 \mathrm{H}_5 \mathrm{COONa}^{0,195}\end{aligned} ;$ Ancol $\left|\begin{array}{l}\mathrm{C}_2 \mathrm{H}_5 \mathrm{OH}^{\mathrm{a}} \\ \mathrm{C}_2 \mathrm{H}_4(\mathrm{OH})_2{ }^{\mathrm{b}} \\ \mathrm{CH}_2{ }^{\mathrm{c}}\end{array} \rightarrow\right| \begin{aligned} & \mathrm{a}+2 \mathrm{~b}=0,39 \\ & 46 \mathrm{a}+62 \mathrm{~b}+14 \mathrm{c}=12,54 \\ & \mathrm{c}=0,(\mathrm{a}+\mathrm{b}), 2(\mathrm{a}+\mathrm{b}) \ldots\end{aligned} \mid \begin{aligned} & \mathrm{a}=0,03 \\ & \mathrm{~b}=0,18 \\ & \mathrm{c}=0\end{aligned}$
Vậy E gồm: $\mathrm{HCOOC}_2 \mathrm{H}_5 ; \mathrm{C}_2 \mathrm{H}_5 \mathrm{COOC}_2 \mathrm{H}_5 ; \mathrm{HCOOC}_2 \mathrm{H}_4 \mathrm{OOCC}_2 \mathrm{H}_5^{0,18}: 90,87 \%$