File word đề thi vào 10 Chuyên Hóa Bình Dương – Năm học 2023 – 2024
File word đề thi vào 10 Chuyên Hóa Bình Dương – Năm học 2023 – 2024
Câu 1: (3,25 điểm)
1. Hòa tan hoàn toàn hai chất rắn $\mathrm{X}, \mathrm{Y}$ (có số mol bằng nhau, $\mathrm{M}_{\mathrm{X}}<\mathrm{M}_{\mathrm{Y}}$ ) vào nước thu được dung dịch $\mathrm{Z}$, sau đó lần lượt tiến hành thí nghiệm:
Thí nghiệm 1: cho dung dịch $\mathrm{BaCl}_2$ dư vào $\mathrm{V} \mathrm{ml}$ dung dịch $\mathrm{Z}$, thu được $\mathrm{n}_1$ mol kết tủa
Thí nghiệm 2: cho dung dịch $\mathrm{NaOH}$ dư vào $\mathrm{V} \mathrm{ml}$ dung dịch $\mathrm{Z}$, thu được $\mathrm{n}_2$ mol kết tủa
Thí nghiệm 3: cho dung dịch $\mathrm{Ba}(\mathrm{OH})_2$ dư vào $\mathrm{V} \mathrm{ml}$ dung dịch $\mathrm{Z}$, thu được $\mathrm{n}_3 \mathrm{~mol}$ kết tủa
Biết rằng các phản ứng xảy ra hoàn toàn: $\mathrm{n}_2<\mathrm{n}_1<\mathrm{n}_3$. Chọn các chất $X$, $Y$ phù hợp với kết quả từ các chất sau: $\mathrm{Al}_2\left(\mathrm{SO}_4\right)_3, \mathrm{Al}\left(\mathrm{NO}_3\right)_3, \mathrm{CuSO}_4$. Viết PTHH minh họa với $\mathrm{X}, \mathrm{Y}$ đã chọn.
Hướng dẫn
Để đơn giản, ta sử số mol mỗi chất là 1 mol. Vì $\mathrm{n}_2<\mathrm{n}_1<\mathrm{n}_3$ nên $\mathrm{X}: \mathrm{CuSO}_4$ và $\mathrm{Y}: \mathrm{Al}_2\left(\mathrm{SO}_4\right)_3$
$\mathrm{TN}_1: 3 \mathrm{BaCl}_2+\mathrm{Al}_2\left(\mathrm{SO}_4\right)_3 \rightarrow 3 \mathrm{BaSO}_4+2 \mathrm{AlCl}_3 \quad \mathrm{BaCl}_2+\mathrm{CuSO}_4 \rightarrow \mathrm{BaSO}_4+\mathrm{CuCl}_2$ suy ra n $\mathrm{n}_1=4$
$\mathrm{TN}_2: 8 \mathrm{NaOH}+\mathrm{Al}_2\left(\mathrm{SO}_4\right)_3 \rightarrow 3 \mathrm{Na}_2 \mathrm{SO}_4+2 \mathrm{NaAlO}_2+4 \mathrm{H}_2 \mathrm{O} \quad 2 \mathrm{NaOH}+\mathrm{CuSO}_4 \rightarrow \mathrm{Na}_2 \mathrm{SO}_4+\mathrm{Cu}(\mathrm{OH})_2$ nên n $\mathrm{n}_2=1$
$\mathrm{TN}_3: 4 \mathrm{Ba}(\mathrm{OH})_2+\mathrm{Al}_2\left(\mathrm{SO}_4\right)_3 \rightarrow 3 \mathrm{BaSO}_4+\mathrm{Ba}\left(\mathrm{AlO}_2\right)_2+4 \mathrm{H}_2 \mathrm{O} \quad \mathrm{Ba}(\mathrm{OH})_2+\mathrm{CuSO}_4 \rightarrow \mathrm{BaSO}_4+\mathrm{Cu}(\mathrm{OH})_2$ nên n ${ }_3=5$
2. Hoàn thành sơ đồ phản ứng sau:
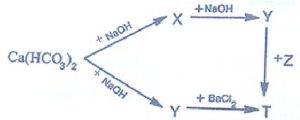
Hướng dẫn
$
\begin{aligned}
& \mathrm{X}: \mathrm{NaHCO}_3 ; \mathrm{Y}: \mathrm{Na}_2 \mathrm{CO}_3 ; \mathrm{Z}: \mathrm{Ba}\left(\mathrm{NO}_3\right)_2 \quad \mathrm{Ca}\left(\mathrm{HCO}_3\right)_2+\mathrm{NaOH} \rightarrow \mathrm{CaCO}_3+\mathrm{NaHCO}_3+\mathrm{H}_2 \mathrm{O} \\
& \mathrm{Ca}\left(\mathrm{HCO}_3\right)_2+2 \mathrm{NaOH}_{\rightarrow} \mathrm{CaCO} \mathrm{Na}_3+\mathrm{Na}_2 \mathrm{CO}_3+2 \mathrm{H}_2 \mathrm{O} \quad \mathrm{NaHCO}_3+\mathrm{NaOH} \rightarrow \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{H}_2 \mathrm{O} \\
& \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{BaCl}_2 \rightarrow 2 \mathrm{NaCl}+\mathrm{BaCO}_3 \quad \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{Ba}\left(\mathrm{NO}_3\right)_2 \rightarrow 2 \mathrm{NaNO}_3+\mathrm{BaCO}_3
\end{aligned}
$
Câu 2: (4,5 điểm)
1. Trong phương pháp phân tích nhiệt, một chất rắn khối lượng $\mathrm{m}_1$ được gia nhiệt, thu được chất rắn mới khối lượng $\mathrm{m}_2$ và chất khí hoặc hơi. Giản đồ phân tích nhiệt hình dưới đây cho biết sự biến đổi khối lượng của canxi oxalat ngậm nước $\mathrm{CaC}_2 \mathrm{O}_4 \cdot \mathrm{H}_2 \mathrm{O}$ trong môi trường khí trơ theo nhiệt độ:
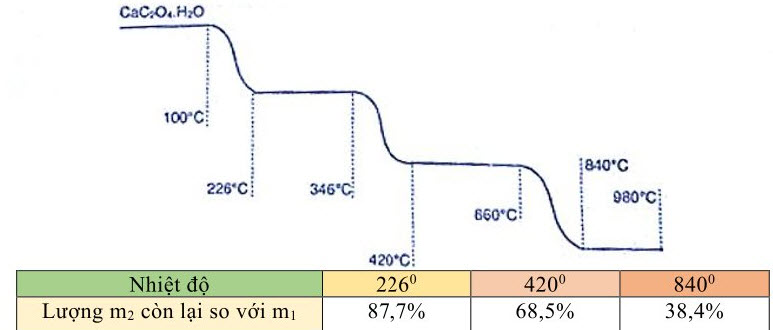
Cho các $\mathrm{PTHH}$ (theo đúng tỉ lệ mol) ứng với ba giai đoạn phản ứng có kèm theo thay đồi khối lượng của các chất rắn: (1) $\mathrm{CaC}_2 \mathrm{O}_4 \cdot \mathrm{H}_2 \mathrm{O}\left(\mathrm{t}^0\right) \rightarrow \mathrm{R}_1+\mathrm{K}_1 \quad$ (2) $\mathrm{R}_1\left(\mathrm{t}^0\right) \rightarrow \mathrm{R}_2+\mathrm{K}_2 \quad$ (3) $\mathrm{R}_2\left(\mathrm{t}^0\right) \rightarrow \mathrm{R}_3+\mathrm{K}_3$. Kí hiệu $\mathrm{R}$ cho các chất rắn, $\mathrm{K}$ cho các chất khí hoặc hơi. Lập luận xác định $\mathrm{R}_1, \mathrm{R}_2, \mathrm{R}_3, \mathrm{~K}_1, \mathrm{~K}_2, \mathrm{~K}_3$. Hoàn thành các $\mathrm{PTHH}$ trên.
Hướng dẫn
Tại $226^{\circ}: \mathrm{m}_2=146.87,7 \%=128 \rightarrow \mathrm{R}_1: \mathrm{CaC}_2 \mathrm{O}_4 ; \mathrm{K}_1: \mathrm{H}_2 \mathrm{O}$
Tại $420^{\circ}: \mathrm{m}_2=146.68,5 \%=100 \rightarrow \mathrm{R}_2: \mathrm{CaCO}_3 ; \mathrm{K}_2: \mathrm{CO}$
Tại $840^{\circ}: \mathrm{m}_2=146.38,4 \%=56 \rightarrow \mathrm{R}_3: \mathrm{CaO} ; \mathrm{K}_3: \mathrm{CO}_2$
2. Hòa tan hoàn toàn 3,2 gam oxit $\mathrm{M}_2 \mathrm{O}_{\mathrm{m}}$ trong dung dịch $\mathrm{H}_2 \mathrm{SO}_4 10 \%$ vừa đủ thu được dung dịch muối trung hòa có nồng độ $12,9 \%$. Sau phản ứng đem cô bới dung dịch và làm lạnh nó thu được 7,868 gam tinh thể muối và hiệu suất kết tinh đạt $70 \%$. Xác định công thức tinh thể muối.
3. Nhiệt tỏa ra khi đốt cháy 1 gam mẫu than là $23 \mathrm{~kJ}$. Giả thiết, toàn bộ lượng nhiệt của quá trình đốt than tỏa ra đều dùng làm nóng nước, không có sự thất thoát nhiệt, hãy tính lượng than cần phải đốt để làm nóng $500 \mathrm{gam}$ nước từ $20^{\circ}-90^{\circ} \mathrm{C}$. Biết để làm nóng 1 gam nước thêm $1^0$ cần nhiệt lượng $75,4 \mathrm{~J}$.
Hướng dẫn
2. $\left|\begin{array}{l}\mathrm{M}_2 \mathrm{O}_{\mathrm{m}}^{\text {a(mol) }} \rightarrow \mathrm{H}_2 \mathrm{SO}_4{ }^{\mathrm{am}} \\ \rightarrow \mathrm{m}_{\mathrm{ddH}_2 \mathrm{SO}_4}=980 \mathrm{am}\end{array} \stackrel{12,9 \%}{\longrightarrow}\right| \begin{aligned} & (2 \mathrm{M}+96 \mathrm{~m}) \mathrm{a}=0,129 \cdot(3,2+980 \mathrm{am}) \\ & (2 \mathrm{M}+16 \mathrm{~m}) \mathrm{a}=3,2\end{aligned} \rightarrow \mid \begin{aligned} & \mathrm{Ma}=1,12 \\ & \mathrm{ma}=0,06\end{aligned} \rightarrow \begin{aligned} & \mathrm{Fe}_2 \mathrm{O}_3^{0,02} \\ & \mathrm{Fe}_2\left(\mathrm{SO}_4\right)_3^{0,02}\end{aligned}$
$\mathrm{Fe}_2\left(\mathrm{SO}_4\right)_3 \cdot \mathrm{nH}_2 \mathrm{O}^{0,02(\mathrm{~mol})} \frac{7.868 \mathrm{~g}}{70 \%} \rightarrow \mathrm{n}=9 \rightarrow \mathrm{Fe}_2\left(\mathrm{SO}_4\right)_3 \cdot 9 \mathrm{H}_2 \mathrm{O}$
3. Nhiệt lượng đốt cháy 500 gam nước từ $20^{\circ}-90^{\circ} \mathrm{C}$ là: $\mathrm{Q}=500.75,4.70=2639 \mathrm{~kJ}$.
Khối lượng than cần đốt là: $2639: 23=114,739$ gam.
Câu 3: (3,25 điểm)
1. Chất rắn $\mathrm{A}$ có sẵn trong tự nhiên dưới dạng nhiều loại khoáng khác nhau. Nung nóng $\mathrm{A}$ ở $1100^{\circ} \mathrm{C}$ là phương pháp sản xuất lượng lớn chất $\mathrm{B}$. Cho $\mathrm{B}$ phản ứng với nước sẽ thu được chất $\mathrm{C}$ và tỏa nhiều nhiệt. Trong phòng thí nghiệm, dung dịch nước của $\mathrm{C}$ được dùng để phát hiện khí $\mathrm{D}$. Khí $\mathrm{D}$ được sử dụng trong rất nhiều loại nước giải khát.
a. Viết các PTHH xảy ra. b. Khí $\mathrm{D}$ duy trì sự cháy không? Cho ví dụ.
c. Thay vì sử dụng đá để bảo quản thực phẩm, người ta dùng chất $\mathrm{D}$ ở dạng rắn “nước đá khô” để bảo quản. Cho biết lợi ích của việc này.
2. Cho cacbon tác dụng với hơi nước ở nhiệt độ cao, sau đó làm ngưng tụ hết hơi nước, thu được hỗn hợp khí $\mathrm{X}$ gồm $\mathrm{CO}, \mathrm{CO}_2$ và $\mathrm{H}_2$. Cho hỗn hợp $\mathrm{X}$ từ từ qua $100 \mathrm{ml}$ dung dịch $\mathrm{NaOH} 0,15 \mathrm{M}$ và $\mathrm{Ba}(\mathrm{OH})_2$, thu được 7,88 gam kết tủa, dung dịch $\mathrm{Y}$ và còn lại 12,32 lít (đktc) hỗn hợp $\mathrm{Z}$ gồm hai khí. Để thu được lượng kết tủa lớn nhất từ dung dịch $\mathrm{Y}$ cần thêm vào $\mathrm{Y}$ ít nhất $100 \mathrm{ml}$ dung dịch $\mathrm{KOH} 0,1 \mathrm{M}$. Tính $\%$ theo thể tích của $\mathrm{CO}_2$ trong $\mathrm{X}$. Biết khi cho hỗn hợp hơi nước và $\mathrm{CO}_2$ qua cacbon nóng đỏ có pứ: $\mathrm{C}+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{CO}+\mathrm{H}_2$ và $\mathrm{CO}_2+\mathrm{C} \rightarrow 2 \mathrm{CO}$.
Hướng dẫn
1. A: $\mathrm{CaCO}_3 ; \mathrm{B}: \mathrm{CaO} ; \mathrm{C}: \mathrm{Ca}(\mathrm{OH})_2 ; \mathrm{D}: \mathrm{CO}_2$ $\mathrm{CaCO}_3 \rightarrow \mathrm{CaO}+\mathrm{CO}_2 \quad \mathrm{CaO}+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{Ca}(\mathrm{OH})_2 \quad \mathrm{Ca}(\mathrm{OH})_2+\mathrm{CO}_2 \rightarrow \mathrm{CaCO}_3+\mathrm{H}_2 \mathrm{O}$.
b. Khí $\mathrm{CO}_2$ không duy trì sự cháy. Để nghiêng ống nghiệm có khí $\mathrm{CO}_2$ thoát ra gần ngọn nến đang cháy, ta thấy ngọn nến tắt.
c. Lợi ích của nước đá khô trong bảo quản thực phẩm: không chảy nước nên giữ được sự tươi ngon và hương vị của thực phẩm, độ lạnh sâu giúp bảo quản thực phẩm lâu hơn và an toàn.
Vì: $\mathrm{Ba}\left(\mathrm{HCO}_3\right)_2+\mathrm{KOH} \rightarrow \mathrm{BaCO}_3+\mathrm{KHCO}_3+\mathrm{H}_2 \mathrm{O}$ nên $\mathrm{nBa}\left(\mathrm{HCO}_3\right)_2=0,01$ mà $\mathrm{n} \downarrow=0,04 \rightarrow \mathrm{nBa}(\mathrm{OH})_2=0,05$
$0,05 \leftarrow 0,05 \rightarrow \quad 0,05 \quad 0,015 \leftarrow 0,015$
$0,01 \quad 0,01 \quad \leftarrow 0,01$
Vậy $\mathrm{X}$ gồm: $\left(\mathrm{CO}, \mathrm{H}_2\right)^{0,55} ; \mathrm{CO}_2^{0,075} \rightarrow \% \mathrm{~V}_{\mathrm{CO} 2}=12 \%$.
Câu 4: (2,0 điểm)
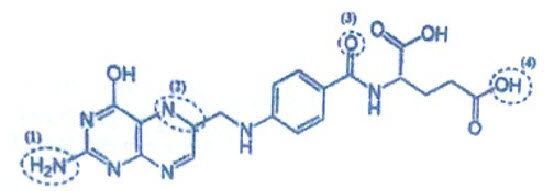
1. Axit folic (vitamin B9) cần thiết cho dinh dưỡng hàng ngày của cơ thể người. Axit folic có vai trò sinh học trong việc tạo ra tế bào mới và duy trì chúng. Chính vì có tác dụng giúp tái tạo tế bào như vậy mà axit folic có thể được sử dụng để phục hồi sinh lực cho các cơ quan nội tạng sau mỗi sự cố thiếu máu hay tổn thương nội tạng tế bào. Trong CTCT dưới đây của axit folic chỉ có một trong các vị trí được đánh dấu (khoanh bằng đường nét đứt) đã được làm sai:
Viết CTPT của axit folic và chỉ ra vị trí đã được làm sai.
2. Ma túy đá là tên gọi chỉ chung cho các loại ma túy tổng hợp, có chứa chất methamphetamine (meth). Những người thường xuyên sử dụng ma túy gây ra hậu quả là suy kiệt thể chất, hoang tưởng, thậm chí mất kiểm soát hành vi, chém giết người vô cớ, nặng hơn sẽ mắc bệnh tâm thần. Khi oxi hóa hoàn toàn 10,43 gam Meth bằng $\mathrm{CuO}$ dư, dẫn sản phẩm cháy lần lượt qua bình 1 đựng dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ đặc, bình 2 đựng dung dịch $\mathrm{Ba}(\mathrm{OH})_2$ dư. Sau khi kết thúc thí nghiệm thấy khối lượng bình một tăng 9,45 gam; ở bình hai tạo thành 137,9 gam kết tủa và còn 0,784 lít khí (đktc) thoát ra. Biết Meth có CTPT trùng với CTĐGN. Xác định CTPT của Meth.
Hướng dẫn
1. Vị trí (2) sai vì $\mathrm{N}$ sai liên kết, cần có $\mathrm{lk}(=)$. CTPT: $\mathrm{C}_{19} \mathrm{H}_{19} \mathrm{O}_6 \mathrm{~N}_7\left(\mathrm{k}=14=\frac{2 \cdot \mathrm{Số} \mathrm{C}+2+\text { số } \mathrm{N}-\text { số } \mathrm{H}}{2} ; \mathrm{N}^7 ; \mathrm{O}^6\right)$
2. Ta có $\left|\begin{array}{l}\mathrm{m}_{\mathrm{H}_2 \mathrm{O}}=9,45 \rightarrow \mathrm{H}_2 \mathrm{O}^{0,525} \\ \mathrm{n}_{\downarrow}=\mathrm{n}_{\mathrm{CO}_2}=0,7 ; \mathrm{n}_{\mathrm{N}_2}=0,035\end{array} \rightarrow\right| \begin{aligned} & \mathrm{C}: \mathrm{H}: \mathrm{N}=0,7: 1,05: 0,07 \\ & \left(\mathrm{C}_{10} \mathrm{H}_{15} \mathrm{~N}\right)_{\mathrm{n}} \rightarrow \text { Meth : } \mathrm{C}_{10} \mathrm{H}_{15} \mathrm{~N}\end{aligned}$
3. Viết các PTHH để hoàn thành sơ đồ phản ứng (ghi rõ điều kiện phản ứng, nếu có), các chất trong sơ đồ chuyển hóa là các hợp chất hữu cơ khác nhau.
Biết: đốt cháy hoàn toàn 2,2 gam hợp chất hữu cơ $\mathrm{A}$ bằng khí oxi thu được 3,36 lít (đktc) $\mathrm{CO}_2$ và $0,2 \mathrm{~mol}_2 \mathrm{O}$.
Hướng dẫn
BTKL: $\mathrm{mA}=12 \mathrm{nCO}_2+2 \mathrm{nH}_2 \mathrm{O}+16 \mathrm{nO} \rightarrow \mathrm{nO}=0 \rightarrow \mathrm{A}$ có $\mathrm{C}: \mathrm{H}=3: 8 \rightarrow \mathrm{A}: \mathrm{C}_3 \mathrm{H}_8$
Suy ra: G: $\mathrm{CH}_3 \mathrm{OH} ; \mathrm{F}: \mathrm{CH}_3 \mathrm{Cl} ; \mathrm{D}: \mathrm{CH}_4 ; \mathrm{B}: \mathrm{C}_2 \mathrm{H}_4 ; \mathrm{E}: \mathrm{CH}_3 \mathrm{CHO} ; \mathrm{K}: \mathrm{CH}_3 \mathrm{COOH}$
Câu 5: (2,0 điểm)
1. Chất hữu cơ $\mathrm{X}$ mạch hở, có công thức phân tử $\mathrm{C}_3 \mathrm{H}_6 \mathrm{O}_3$. $\mathrm{X}$ phản ứng với: $\mathrm{Na}, \mathrm{NaOH}, \mathrm{Na}_2 \mathrm{CO}_3$; $\mathrm{a}$ mol $\mathrm{X}$ phản ứng với $\mathrm{Na}$ dư thu được a mol khí $\mathrm{H}_2$.
a. Lập luận xác định CTCT của X. Viết các $\mathrm{PTHH}$ (với một trong các CTCT tìm được).
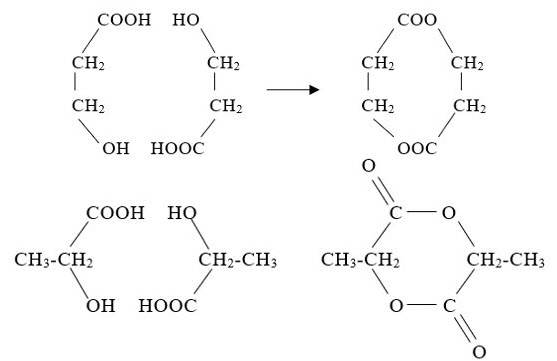
b. Đun $\mathrm{X}$ với $\mathrm{H}_2 \mathrm{SO}_4$ đặc, người ta thu được một hỗn hợp nhiều sản phẩm trong đó có chất $\mathrm{Y}$. $\mathrm{Y}$ có $\mathrm{CTPT}$ là $\mathrm{C}_6 \mathrm{H}_8 \mathrm{O}_4$ là hợp chất vòng 6 cạnh và có cấu trúc đối xứng. $\mathrm{Y}$ có phản ứng với $\mathrm{NaOH}$ nhưng không phản ứng với $\mathrm{Na}$. Viết CTCT đúng của X, Y. Viết PTHH tạo ra Y từ X.
Hướng dẫn
a. $X$ pứ với $\mathrm{Na}_2 \mathrm{CO}_3 \rightarrow \mathrm{X}$ có $-\mathrm{COOH} ; \mathrm{X}$ pứ với $\mathrm{Na}$ cho $\mathrm{nX}=\mathrm{nH}_2 \rightarrow \mathrm{n}(\mathrm{OH}, \mathrm{COOH})=2 \rightarrow$ có 1 nhóm $-\mathrm{OH}$ Suy ra $\mathrm{X}: \mathrm{HOCH}_2 \mathrm{CH}_2 \mathrm{COOH} ; \mathrm{CH}_3 \mathrm{CH}(\mathrm{OH}) \mathrm{COOH}$.
$\mathrm{HOC}_2 \mathrm{H}_4 \mathrm{COOH}+\mathrm{Na} \rightarrow \mathrm{NaOC}{ }_2 \mathrm{H}_4 \mathrm{COONa}+\mathrm{H}_2 \quad \mathrm{HOC}_2 \mathrm{H}_4 \mathrm{COOH}+\mathrm{NaOH} \rightarrow \mathrm{HOC}_2 \mathrm{H}_4 \mathrm{COONa}+\mathrm{H}_2 \mathrm{O}$ $2 \mathrm{HOC}_2 \mathrm{H}_4 \mathrm{COOH}+\mathrm{Na}_2 \mathrm{CO}_3 \rightarrow 2 \mathrm{HOC}_2 \mathrm{H}_4 \mathrm{COONa}+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O} \quad \mathrm{HOC}_2 \mathrm{H}_4 \mathrm{COOH}+\mathrm{Na} \rightarrow \mathrm{NaOC}_2 \mathrm{H}_4 \mathrm{COONa}+\mathrm{H}_2$
b.
2. Hỗn hợp $\mathrm{A}$ gồm một anken và hidro có tỉ khối so với $\mathrm{H}_2$ bằng 6 . Cho hỗn hợp $\mathrm{A}$ đi qua Ni nung nóng thu được hỗn hợp $\mathrm{B}$ có tỉ khối so với $\mathrm{H}_2$ bằng 8 (hiệu suất phản ứng $100 \%$ ). Xác định $\mathrm{CTPT}$ của anken.
3. Đốt cháy hoàn toàn $\mathrm{m}$ gam hỗn hợp $\mathrm{B}$ gồm rượu metylic, rượu etylic và glixerol thu được $0,7 \mathrm{~mol}_{\mathrm{CO}_2}$ và 1 $\mathrm{mol} \mathrm{H}_2 \mathrm{O}$. Biết trong 80 gam $\mathrm{B}$ có chứa 0,6 mol glixerol. Viết các $\mathrm{PTHH}$ xảy ra và tính \% khối lượng mỗi chất trong $\mathrm{m}$ gam hỗn hợp $\mathrm{B}$.
Hướng dẫn
2. Bài toán chỉ có số liệu dạng tỉ khối nên để đơn giản bài toán, giả sử mol $\mathrm{A}$ là: 1 (mol).
$
\left|\begin{array}{l}
\mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}}: \mathrm{a} \\
\mathrm{H}_2: 1-\mathrm{a}
\end{array} \stackrel{\text { BTKL }}{\longrightarrow} \frac{\mathrm{n}_{\mathrm{A}}}{\mathrm{n}_{\mathrm{B}}}=\frac{\mathrm{M}_{\mathrm{B}}}{\mathrm{M}_{\mathrm{A}}} \rightarrow\right| \begin{aligned}
& 12=16(1-\mathrm{a}) \\
& \rightarrow \mathrm{a}=0,25
\end{aligned} \rightarrow \mid \begin{aligned}
& \mathrm{m}_{\mathrm{A}}=14 \mathrm{n} \cdot 0,25+2 \cdot 0,75=12 \\
& \rightarrow \mathrm{n}=3 \rightarrow \mathrm{C}_3 \mathrm{H}_6
\end{aligned}
$
$\mathbf{H} \mathbf{E}$





