File word đề thi vào 10 Chuyên Hóa KHTN Hà Nội – Năm học 2023 – 2024
File word đề thi vào 10 Chuyên Hóa KHTN Hà Nội – Năm học 2023 – 2024
Câu 1: (2,0 điểm)
1. Hình sau là một phần của bảng hệ thống tuần hoàn các nguyên tố hóa học.
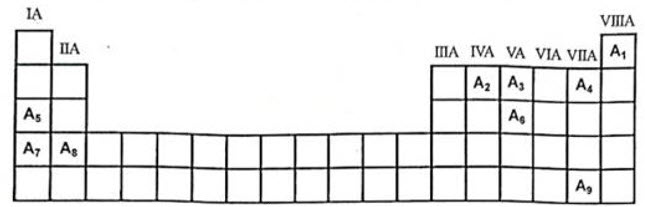
Trong các nguyên tố hóa học được kí hiệu từ $\mathrm{A}_1$ đến $\mathrm{A}_9$ ở hình trên:
– Hai kim loại nào thuộc cùng một chu kì.
– Đơn chất của nguyên tố nào có tính khử mạnh nhất? của nguyên tố nào có tính oxi hóa mạnh nhất?
2. Viết các PTHH xảy ra trong mỗi thí nghiẹ̉m sau:
– Nhỏ từ từ dung dịch $\mathrm{KHSO}_4$ vào dung dịch $\mathrm{K}_2 \mathrm{ZnO}_2$. Ban đầu thấy xuất hiện kết tủa trắng, sau đó kết tủa tan hoàn toàn.
– Nhỏ dung dịch $\mathrm{KI}$ và hồ tinh bột lên giấy lọc rồi đưa vào bình khí $\mathrm{Cl}_2$. Ban đầu, giấy lọc chuyển sang màu xanh tím, sau một thời gian màu xanh tím biến mất.
Hướng dẫn
1. Hai kim loại thuộc cùng chu kì: $\mathrm{A}_7, \mathrm{~A}_8$
2. $2 \mathrm{KHSO}_4+\mathrm{K}_2 \mathrm{ZnO}_2 \rightarrow 2 \mathrm{~K}_2 \mathrm{SO}_4+\mathrm{Zn}(\mathrm{OH})_2$
Đơn chất có tính khử mạnh nhất $\mathrm{A}_7$; oxi hóa mạnh nhất là $\mathrm{A}_4$ $2 \mathrm{KHSO}_4+\mathrm{Zn}(\mathrm{OH})_2 \rightarrow \mathrm{ZnSO}_4+\mathrm{K}_2 \mathrm{SO}_4+2 \mathrm{H}_2 \mathrm{O}$ $\mathrm{Cl}_2+2 \mathrm{KI} \rightarrow 2 \mathrm{KCl}+\mathrm{I}_2\left(\mathrm{I}_2\right.$ gặp tinh bột có màu xanh tím, khi nung $\mathrm{I}_2$ thăng hoa thì màu xanh tím biến mất)
3. Trong công nghiệp, người ta có thể điều chế $\mathrm{Na}_2 \mathrm{CO}_3$ và $\mathrm{CaCl}_2$ từ chất đầu là muối ăn, đá vôi và chỉ sử dụng thêm tác nhân $\mathrm{H}_2 \mathrm{O}, \mathrm{NH}_3$, nhiệt độ (phương pháp Solvay) thông qua bốn phản ứng (không theo thứ tự) dưới đây:
(1) $\mathrm{A}_{(\mathrm{k})}+\mathrm{B}+\mathrm{NaCl}_{\text {(bão hóa) }}+\mathrm{X} \rightarrow \mathrm{NaHCO}_3 \downarrow+\mathrm{D}$
(2) $\mathrm{E} \rightarrow \mathrm{F}+\mathrm{A}_{(\mathrm{k})}$
(3) $F+D \rightarrow G+B \uparrow+X$
(3) $\mathrm{NaHCO}_3 \rightarrow \mathrm{H}+\mathrm{A}_{(\mathrm{k})}+\mathrm{X}$
a. Hoàn thành các PTHH trên, ghi rõ các điều kiện cần thiết. Cho biết: $\mathrm{NaHCO}_3$ có độ tan khá nhỏ, có thể kết tủa, tách ra khỏi hỗn hợp phản ứng trong điều kiện ở (1).
b. Trình bày vắn tắt phương pháp điều chế $\mathrm{Na}_2 \mathrm{CO}_3$ và $\mathrm{CaCl}_2$ theo quy trình trên.
c. Giải thích tại sao quy trình Solvay mô tả ở trên không tiêu tốn $\mathrm{NH}_3$ và không thải khí $\mathrm{CO}_2$ ra môi trường?
Hướng dẫn
a. A: $\mathrm{CO}_2 ; \mathrm{B}: \mathrm{NH}_3 ; \mathrm{X}: \mathrm{H}_2 \mathrm{O} ; \mathrm{D}: \mathrm{NH}_4 \mathrm{Cl} ; \mathrm{F}: \mathrm{CaO} ; \mathrm{E}: \mathrm{CaCO}_3 ; \mathrm{H}: \mathrm{Na}_2 \mathrm{CO}_3$
(1) $\mathrm{CO}_2+\mathrm{NH}_3+\mathrm{NaCl}+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{NaHCO}_3+\mathrm{NH}_4 \mathrm{Cl}$
(2) $\mathrm{CaCO}_3 \rightarrow \mathrm{CaO}+\mathrm{CO}_2$
(3) $\mathrm{CaO}+2 \mathrm{NH}_4 \mathrm{Cl} \rightarrow \mathrm{CaCl}_2+2 \mathrm{NH}_3+\mathrm{H}_2 \mathrm{O}$
(4) $2 \mathrm{NaHCO}_3 \rightarrow \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{CO}_2+2 \mathrm{H}_2 \mathrm{O}$
b. Qui trình điều chế: $(2) \rightarrow(1) \rightarrow(4) \rightarrow(3)$
Bước 1: nung $\mathrm{CaCO}_3$ ở nhiệt độ cao,
Bước 2: dẫn khí thoát ra ở bước 1 vào dung dịch bão hòa $\mathrm{NaCl}$ trong $\mathrm{NH}_3$
Bước 3: lọc $\mathrm{NaHCO}_3$ khỏi dung dịch, nung ở nhiệt độ cao thu được soda $\left(\mathrm{Na}_2 \mathrm{CO}_3\right)$, khí $\mathrm{CO}_2$ (quay lại sản xuất)
Bước 4: cho vôi tôi vào dung dịch chứa $\mathrm{NH}_4 \mathrm{Cl}$ ta lại thu được $\mathrm{NH}_3$.
c. Vì khí $\mathrm{NH}_3$ làm nguyên liệu rồi lại được thu hồi để quay trở lại tuần hoàn làm nguyên liệu nên không thất thoát. Khí $\mathrm{CO}_2$ thoát ra cũng tuần hoàn quay trở lại làm nguyên liệu nên không thoát ra ngoài môi trường.
Câu 2: (2,0 điểm )
1. Hidrocacbon thơm $X$ có công thức phân tử $\mathrm{C}_8 \mathrm{H}_{10}$.
a. Viết CTCT của $X$.
b. $\mathrm{X}_1$ là một trong các đồng phân của $\mathrm{X}$ ở trên. Biết $\mathrm{X}_1$ phản ứng với $\mathrm{Br}_2$ (xúc tác $\mathrm{Fe}, \mathrm{t}^0$ ) thu được hai sản phẩm thế monobrom. Oxi hóa $\mathrm{X}_1$ trong điều kiện thích hợp thu được axit $\mathrm{X}_2$. Cho $\mathrm{X}_2$ phản ứng với etanol $\mathrm{H}_2 \mathrm{SO}_4$ đặc làm xúc tác được sản phẩm $\mathrm{X}_3$ (có công thức $\mathrm{C}_{12} \mathrm{H}_{14} \mathrm{O}_4$, được sử dụng làm thuốc điều trị bệnh ghẻ hay khắc phục vùng da bị côn trùng cắn). Xác định CTCT của $\mathrm{X}_1, \mathrm{X}_2, \mathrm{X}_3$.
Hướng dẫn
a.
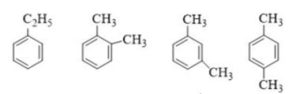
b. $\mathrm{X}_1$ pứ thế $\mathrm{Br}_2$ (xt Fe, thế vào nhân thơm) thu được hai sản phẩm monobrom nên $\mathrm{X}_1: 1,2$ – dimetyl benzen $\mathrm{C}_6 \mathrm{H}_4\left(\mathrm{CH}_3\right)_2+3 \mathrm{O}_2 \underset{\mathrm{xt}^{\circ}}{\longrightarrow} \mathrm{C}_6 \mathrm{H}_4(\mathrm{COOH})_2+2 \mathrm{H}_2 \mathrm{O} \quad \mathrm{C}_6 \mathrm{H}_4(\mathrm{COOH})_2+2 \mathrm{C}_2 \mathrm{H}_5 \mathrm{OH} \rightarrow \mathrm{C}_6 \mathrm{H}_4\left(\mathrm{COOC}_2 \mathrm{H}_5\right)_2+2 \mathrm{H}_2 \mathrm{O}$
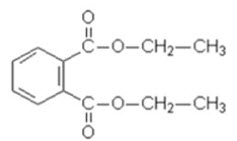
(Thuốc D.E.P trị ghẻ)
2. $\mathrm{Y}$ có công thức hóa học dạng $\mathrm{C}_{\mathrm{x}} \mathrm{H}_{\mathrm{y}} \mathrm{O}_{\mathrm{z}}$ trong đó phần trăm khối lượng oxi là $17,022 \%, \mathrm{M}_{\mathrm{Y}}=94$ đvC. Biết $\mathrm{Y}$ phản ứng được với dung dịch $\mathrm{NaOH}$; hidro hóa $\mathrm{Y}$ thu được chất hữu cơ $\mathrm{Y}_1$. Đun $\mathrm{Y}_1$ với dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ đặc ở $170^{\circ} \mathrm{C}$ thu được $\mathrm{Y}_2$. Thêm $\mathrm{Y}_2$ vào dung dịch $\mathrm{KMnO}_4$ đun nóng được chất hữu cơ $\mathrm{Y}_3$. Biêt: $\mathrm{M}_{\mathrm{Y} 1}=\mathrm{M}_{\mathrm{Y}}+6 ; \mathrm{M}_{\mathrm{Y}}=$ $\mathrm{M}_{\mathrm{Y} 2}+140$. Xác định $\mathrm{Y}, \mathrm{Y}_1, \mathrm{Y}_2, \mathrm{Y}_3$ và viết các $\mathrm{PTHH}$ xảy ra.
Hướng dẫn
Số $\mathrm{O}_{(\mathrm{Y})}=1$, Y pứ với $\mathrm{NaOH} \rightarrow \mathrm{Y}: \mathrm{C}_6 \mathrm{H}_5 \mathrm{OH}\left(\right.$ phenol) $\rightarrow \mathrm{Y}_1: \mathrm{C}_6 \mathrm{H}_{11} \mathrm{OH} \rightarrow \mathrm{M}_{\mathrm{Y} 3}=222 ; \mathrm{Y}_3: \mathrm{C}_4 \mathrm{H}_8(\mathrm{COOK})_2$
$\mathrm{C}_6 \mathrm{H}_5 \mathrm{OH}+\mathrm{NaOH} \rightarrow \mathrm{C}_6 \mathrm{H}_5 \mathrm{ONa}+1 / 2 \mathrm{H}_2 \quad \mathrm{C}_6 \mathrm{H}_5 \mathrm{OH}+3 \mathrm{H}_2 \rightarrow \mathrm{C}_6 \mathrm{H}_{11} \mathrm{OH}$
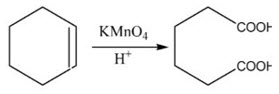
Câu 3: (2,0 điểm)
Đốt 53,44 gam hỗn hợp $\mathrm{X}$ gồm $\mathrm{FeS}_2, \mathrm{Cu}_2 \mathrm{~S}$, Cu trong bình kín chứa 15,232 lít khí oxi, sau khi phản ứng xong thu được khí $\mathrm{SO}_2$ và $\mathrm{m}_1$ gam chất rắn $\mathrm{Y}$ gồm $\mathrm{Fe}_2 \mathrm{O}_3, \mathrm{CuO}, \mathrm{Cu}$. Để oxi hóa hoàn toàn lượng $\mathrm{SO}_2$ ở trên, cần dùng vừa hết dung dịch chứa $\mathrm{m}_2$ gam $\mathrm{Cl}_2$, thu được dung dịch $\mathrm{Z}$. Biết dung dịch $\mathrm{Z}$ hòa tan vừa hết lượng chất rắn $\mathrm{Y}$ tạo thành dung dịch $\mathrm{T}$ chỉ chứa bốn muối.
a. Xác định khối lượng mỗi chất có trong $\mathrm{X}$, tính giá trị $\mathrm{m}_1, \mathrm{~m}_2$.
b. Chia dung dịch T thành hai phần. Đun nóng phần một với dung dịch $\mathrm{KMnO}_4 / \mathrm{H}_2 \mathrm{SO}_4$ loãng, thấy hết tối đa $0,04 \mathrm{~mol} \mathrm{KMnO}_4$. Cho phần hai phản ứng với lượng dư dung dịch $\mathrm{Ba}\left(\mathrm{NO}_3\right)_2$ thu được $\mathrm{m}_3$ gam kết tủa. Tính $\mathrm{m}_3$.
Hướng dẫn
Khối lượng mỗi chất trong $\mathrm{A}$ là: $\mathrm{FeS}_2{ }^{14,4 \mathrm{gg}} ; \mathrm{Cu}_2 \mathrm{~S}^{16 \mathrm{~g}} ; \mathrm{Cu}^{23,04 \mathrm{~g}}$
b. $\stackrel{\mathrm{BT.e}^{\mathrm{e}}}{\longrightarrow} \mid \begin{aligned} & \mathrm{n}_{\mathrm{Fe}^{2+}}+\mathrm{n}_{\mathrm{Cl}^{-}}=5 \mathrm{n}_{\mathrm{KMnO}_4} \\ & 0,12 \mathrm{k}+0,68 \mathrm{k}=0,2 \rightarrow \mathrm{k}=0,25\end{aligned} \rightarrow \mathrm{P}_2: \mathrm{SO}_4^{2-(0,255)} \rightarrow \mathrm{BaSO}_4^{0,255} \rightarrow \mathrm{m}_3=59,415$ (gam)
Câu 4: (2,0 điểm)
Hợp chất hữu cơ $\mathrm{A}$ chứa $\mathrm{C}, \mathrm{H}, \mathrm{O}\left(\mathrm{M}_{\mathrm{A}}<120\right.$ đvC). Để đốt cháy hoàn toàn 1 mol $\mathrm{A}$ cần dùng vừa đủ với 78,4 lít khí $\mathrm{O}_2$ thu được $\mathrm{CO}_2$ và $\mathrm{H}_2 \mathrm{O}$ có tỉ lệ khối lượng tương ứng là $44: 9$.
a. Xác định CTPT của $\mathrm{A}$.
b. $\mathrm{A}_1$ là đồng phân của $\mathrm{A}$, có cấu tạo mạch hở, làm đỏ quỳ tím, tác dụng với nước brom theo tỉ lệ mol $1: 1$. Viết CTCT của $\mathrm{A}_1$ và hoàn thành các $\mathrm{PTHH}$ theo sơ đồ sau (biết: $\mathrm{M}_{\mathrm{A} 2}+44=\mathrm{M}_{\mathrm{A} 1}$ ).
c. $B_1, B_2$ là hai đồng phân của $\mathrm{A}$; cứ $1 \mathrm{~mol}$ mỗi chất phản ứng vừa hết với dung dịch chứa $2 \mathrm{~mol} \mathrm{NaOH}$. $\mathrm{Biết} \mathrm{B}_1$ có cấu tạo mạch hở; $\mathrm{B}_2$ chứa vòng 5 cạnh. Dùng CTCT của $\mathrm{B}_1, \mathrm{~B}_2$ để viết $\mathrm{PTHH}$ xảy ra.
Hướng dẫn
b. $\mathrm{A}_1(\mathrm{k}=3)$ có chức $-\mathrm{COOH}$, pứ $\mathrm{Br}_2$ tỉ lệ $1: 1$ nên có 1 chức $-\mathrm{CO}-\rightarrow \mathrm{A}_1: \mathrm{CH}_2=\mathrm{CHCOCOOH}$
$\mathrm{A}_2: \mathrm{CH}_2=\mathrm{CHCHO} ; \mathrm{A}_3: \mathrm{CH}_2=\mathrm{CHCOONH}_4 ; \mathrm{A}_4: \mathrm{CH}_2=\mathrm{CHCOONa} ; \mathrm{A}_5: \mathrm{CH}_2=\mathrm{CH}_2 ; \mathrm{A}_6:-\left(\mathrm{CH}_2 \mathrm{CH}_2\right)_{\mathrm{n}}-(\mathrm{PE})$
Câu 5: (2,0 điểm)
1. Cho 10,74 gam tinh thể muối A phản ứng với lượng dư dung dịch $\mathrm{Ba}(\mathrm{OH})_2$ đặc thu được được $10,485 \mathrm{gam}$ kết tủa màu trắng $\mathrm{B}$ (không tan trong axit mạnh) và dung dịch $\mathrm{D}$. Thêm lượng dư $\mathrm{H}_2 \mathrm{O}_2$ loãng vào $\mathrm{D}$, đun sôi cẩn thận để các phản ứng xảy ra hoàn toàn và lượng $\mathrm{H}_2 \mathrm{O}_2$ dư phân hủy hết. Sau phản ứng thu được 7,59 gam kết tủa màu vàng của muối $\mathrm{E}$ và dịch lọc không màu, có môi trường kiềm. Biết $\mathrm{E}$ chứa ba nguyên tố, trong đó $\%$ khối lượng của $\mathrm{Ba}, \mathrm{O}$ lần lượt là $54,15 \%$ và $25,30 \%$. Xác định $\mathrm{A}$ và $\mathrm{E}$.
Hướng dẫn
$
\mathrm{A}^{10,74 \mathrm{~g}} \stackrel{+\mathrm{Ba}(\mathrm{OH})_2}{\mathrm{dur}} \mathrm{BaSO}_4^{0,045}+\mathrm{ddD} \stackrel{+\mathrm{H}_2 \mathrm{O}_2}{\longrightarrow} \downarrow_{\text {vàng }}{ }^{7,59 \mathrm{~g}}+\mathrm{dd}: \mathrm{OH}^{-}
$
$
\mathrm{E}: \mathrm{Ba}_{\mathrm{x}} \mathrm{O}_{\mathrm{y}} \rightarrow \mathrm{Ba}: \mathrm{O}=\frac{54,15 \%}{137}: \frac{25,3 \%}{16}=0,25 \rightarrow \mathrm{BaCrO}_4^{0,03} \rightarrow \mathrm{A}\left|\begin{array}{l}
\mathrm{Cr}^{0,03} \\
\mathrm{SO}_4^{0,045}
\end{array} \rightarrow\right| \begin{aligned}
& \mathrm{Cr}_2\left(\mathrm{SO}_4\right)_3 \cdot \mathrm{nH}_2 \mathrm{O} \\
& \stackrel{10,74 \mathrm{~g}}{\rightarrow} \mathrm{n}=18
\end{aligned} \rightarrow \mathrm{Cr}_2\left(\mathrm{SO}_4\right)_3 \cdot 18 \mathrm{H}_2 \mathrm{O}
$
2. Một mẫu khoáng vật $\mathrm{X}$ chứa muối của một kim loại kiềm và tạp chất trơ. Cho 10 gam $\mathrm{X}$ tác dụng với $\mathrm{HCl}$ dư thu được 1,792 lít khí $\mathrm{CO}_2$ và 0,96 gam chất rắn. Mặt khác, nung nóng $X$ đến khối lượng không đổi thu được chất rắn $\mathrm{Y}$, có khối lượng bằng $73,2 \%$ khối lượng của X. Lấy 10 gam $\mathrm{Y}$ phản ứng với dung dịch $\mathrm{HCl}$ dư thấy thoát ra 1,8368 lít khí $\mathrm{CO}_2$. Xác định công thức của muối có trong $\mathrm{X}$.
Hướng dẫn
Đồng nhất dữ kiện 73,2\% để thuận lợi tính toán. $2 \mathrm{NaHCO}_3 \rightarrow \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O}$
$\mathrm{X}$ pứ với $\mathrm{HCl}$ cho $\mathrm{CO}_2$ nên $\mathrm{X}$ có gốc $\mathrm{HCO}_3$ hoặc $\mathrm{CO}_3$ và $\mathrm{Y} \mid \begin{aligned} & \mathrm{M}_2 \mathrm{CO}_3 \rightarrow \mathrm{CO}_2^{0,06} \\ & \text { Tạp chất }\end{aligned}$
Nhận thấy: $\mathrm{nCO}_{2(1)}=0,08>\mathrm{nCO}_{2(2)}=0,06 \rightarrow \mathrm{X}: \mathrm{xNaHCO}_3 \cdot \mathrm{yNa}_2 \mathrm{CO}_3 \cdot \mathrm{nH}_2 \mathrm{O}: \mathrm{a}(\mathrm{mol})+$ Tạp chất.
$\left|\begin{array}{l}\mathrm{a}(\mathrm{x}+\mathrm{y})=0,08 \\ \mathrm{a}(0,5 \mathrm{x}+\mathrm{y})=0,06\end{array} \rightarrow\right| \begin{aligned} & \mathrm{ax}=\mathrm{xy}=0,04 \rightarrow \mathrm{x}=\mathrm{y}=1 ; \mathrm{a}=0,04 \\ & \mathrm{NaHCO}_3 \cdot \mathrm{Na}_2 \mathrm{CO}_3 \cdot \mathrm{nH}_2 \mathrm{O} \cdot \mathrm{TC}\end{aligned} \stackrel{10 \mathrm{~g}}{\longrightarrow} \mid \begin{aligned} & \mathrm{H}_2 \mathrm{O}^{0,08(\mathrm{~mol})} \\ & \mathrm{n}=2\end{aligned} \rightarrow \mathrm{NaHCO}_3 \cdot \mathrm{Na}_2 \mathrm{CO}_3 \cdot 2 \mathrm{H}_2 \mathrm{O}$





