File word Đề thi vào 10 Chuyên Hóa Tỉnh Bình Phước – Năm học 2023 – 2024
File word Đề thi vào 10 Chuyên Hóa Tỉnh Bình Phước – Năm học 2023 – 2024
Cho: H=1; C = 12; N = 14; 0 = 16; Al=27; P = 31; S = 32; CI= 35,5; K = 39; Ca=40; Mn=55; Fe=56; Cu = 64; Cd = 112.
Câu 1: (1,0 điểm)
Cho độ tan trong nước của KC1 ở 20°C là 34 gam.
1.1. Tính nồng độ phần trăm của dung dịch KCl bão hòa tại nhiệt độ 20°C.
1.2. Cần lấy bao nhiêu ml nước cất trộn với 50 gam dung dịch trên để được dung dịch mới có nồng độ 10%? Cho khối lượng riêng của nước bằng 1 g/ml.
Câu 2: (2,0 điểm)
2.1. Sắt (Fe) là kim loại có nhiều hóa trị. Ở điều kiện thích hợp, sắt tác dụng với nhiều phi kim tạo thành oxit hoặc muối.
Viết phương trình phản ứng hóa học của $\text{Fe}$ với Cl2 và $\text{S}$.
Từ các phản ứng trên có thể rút ra kết luận gì về tính phi kim của Cl2 và $\text{S}$. Dự đoán phương trình hóa học giữa Cl2 và H2S.
2.2. Có 6 lọ dung dịch được đánh số ngẫu nhiên từ 1 đến 6. Các dung dịch đều không màu và đều chứa một chất tan trong số các chất sau: $\text{BaC}{{\text{l}}_{2}},{{\text{H}}_{2}}\text{S}{{\text{O}}_{4}},\text{Ba}{{(\text{OH})}_{2}},\text{MgC}{{\text{l}}_{2}},\text{NaHC}{{\text{O}}_{3}},\text{HCl}$ . Người ta tiến hành các thí nghiệm và thu được kết quả như sau.
Thí nghiệm 1: dung dịch 6 cho bọt khí bay lên khi tác dụng với các dung dịch 1 và 5.
Thí nghiệm 2: dung dịch 4 cho kết tủa khi tác dụng với các dung dịch 1, 3 và 6.
Hãy lập luận để xác định các chất trong mỗi lọ dung dịch trên và viết các phương trình phản ứng hóa học.
Câu 3: (2,5 điểm)
3.1. Đốt cháy hoàn toàn hỗn hợp X gồm C và S rồi cho toàn bộ sản phẩm cháy hấp thụ hết vào bình chứa 20 gam dung dịch NaOH 20% dư thấy khối lượng bình tăng thêm 1,94 gam. Cô cạn dung dịch sau phản ứng thu được 5,31 gam chất rắn khan. Tính % theo khối lượng các chất trong hỗn hợp X.
3.2. Số mg nguyên tố Cd ở dạng muối Cd(II) tối đa cho phép trong một lít nước là 0,005 mg/l. Tiến đại hành phân tích nước thải từ một nhà máy bằng cách thêm lượng dư dung dịch Na2S vào 500 ml mẫu nước thu được $0,{{0144.10}^{-3}}$gam kết tủa màu vàng (1 mol nguyên tố Cd ở dạng muối Cd(II) tạo được 1 mol kết tủa CdS màu vàng). Mẫu nước thải trên có đạt tiêu chuẩn cho phép hay không?
3.3. Đa số oxit axit là oxit phi kim $\left( \text{C}{{\text{O}}_{2}},\text{S}{{\text{O}}_{2}},\ldots \right)$nhưng có oxit phi kim là oxit trung tính (CO, NO,…), ngược lại có oxit axit là oxit kim loại (ví dụ X là một oxit axit có axit và muối tương ứng là Y, Z). Cho dãy chuyển hóa chứa X, Y, Z, T (T là oxit).
$\mathbf{X}\xrightarrow{+{{\text{H}}_{2}}\text{O}}\mathbf{Y}\xrightarrow{+\text{KOH}}\mathbf{Z}\xrightarrow{{{\text{t}}^{\circ }}}\mathbf{T}$
Biết X, Y, Z, T đều chứa cùng một nguyên tố kim loại M có phần trăm khối lượng như bảng sau:
| Hợp chất | $\mathbf{X}$ | $\mathbf{Y}$ | $\mathbf{Z}$ | $\mathbf{T}$ |
| $\text{ }\!\!%\!\!\text{ }\!\!~\!\!\text{ }{{\text{m}}_{\mathbf{M}}}$ | $49,55\text{ }\!\!%\!\!\text{ }$ | $45,83\text{ }\!\!%\!\!\text{ }$ | $34,81\text{ }\!\!%\!\!\text{ }$ | $63,22\text{ }\!\!%\!\!\text{ }$ |
Xác định công thức phân tử của oxit X (biết X có dạng ${{\mathbf{M}}_{2}}{{\text{O}}_{\mathbf{n}}}$).
Viết phương trình hóa học trong dãy chuyển hóa trên.
Câu 4: (1,5 điểm)
4.1. Viết công thức cấu tạo dạng mạch vòng ứng với công thức phân tử C5H10.
4.2. Đốt cháy hoàn toàn 4,48 lít hỗn hợp khí Y gồm C3H8 và hidrocacbon A mạch hở (có chứa liên kết kém bền)
Tinh thể tích không khí cần dùng để đốt cháy hết hỗn hợp Y. (Biết các khí đo ở điều kiện tiêu) thu đang 22 gam CO2 và 10,8 gam H2O. chuẩn và trong không khí oxi chiếm 20% thể tích).
Xác định công thức phân tử của A.
Câu 5: (2,0 điểm)
5.1. Hoàn thành chuỗi phản ứng, các chất hữu cơ viết dưới dạng công thức cấu tạo, ghi rõ điều kiện nếu có.
${{\text{C}}_{2}}{{\text{H}}_{2}}\xrightarrow{\left( 1 \right)}{{\text{C}}_{2}}{{\text{H}}_{4}}\xrightarrow{\left( 2 \right)}{{\text{C}}_{2}}{{\text{H}}_{6}}\text{O}\xrightarrow{\text{(3) }\!\!~\!\!\text{ }}{{\text{C}}_{2}}{{\text{H}}_{4}}{{\text{O}}_{2}}\xrightarrow{\left( 4 \right)}{{\text{C}}_{4}}{{\text{H}}_{8}}{{\text{O}}_{2}}$
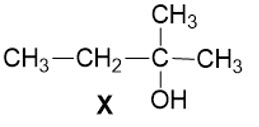
| 5.2. Cho chất X như hình bên, khi đun X trong xúc tác H2SO4 đặc ở nhiệt độ thích hợp thì 1 phân tử X sẽ tạo ra được 1 phân tử nước và 1 phân tử chất hữu cơ Y mạch hở. Phân tử nước được tạo ra từ quá trình tách $-\text{OH}$ và nguyên từ $-\text{H}$ (của nhóm $-\text{C}{{\text{H}}_{2}}-$ hoặc nhóm $-\text{C}{{\text{H}}_{3}}$ ) . Dựa vào gợi ý đã cho, hãy viết phương trình hóa học (chất hữu cơ viết dưới dạng công thức cấu tạo). |
5.3. Xenlulozơ được tạo thành trong cây xanh nhờ quá trình quang hợp. Giả sử có một rừng cây xà cừ 7 tuổi có diện tích 2 ha được trồng với mật độ trung bình 1 cây $/10\text{ }\!\!~\!\!\text{ }{{\text{m}}^{2}}$. Biết rằng 1 cây xà cừ 7 tuổi có khối lượng gỗ trung bình là 100kg, chứa 50% xenlulozơ. Tính thể tích khí $\text{C}{{\text{O}}_{2}}$ hấp thụ và thể tích khí ${{\text{O}}_{2}}$ giải phóng trong quá trình quang hợp tạo ra xenlulozơ từ rừng cây xà cừ trên (các thể tích khí đo ở điều kiện tiêu chuẩn; 1 ha $={{10}^{4}}\text{ }\!\!~\!\!\text{ }{{\text{m}}^{2}}$)
5.4. Hợp chất hữu cơ X chứa C, H, O có khối lượng mol bằng 150 (g/mol), trong đó tỉ lệ khối lượng ${{\text{m}}_{\text{C}}}:{{\text{m}}_{\text{H}}}=8:1$. Nếu cho X phản ứng với Na dư hoặc $\text{NaHC}{{\text{O}}_{3}}$ dư thì số mol khí thu được đều gấp đôi số mol X đã phản ứng. Biết trong cấu tạo của X: tất cả các nguyên tử oxi chứa trong nhóm -OH, -COOH ; một nguyên tử C chỉ liên kết tối đa với 1 nhóm –OH . Lập luận và viết công thức cấu tạo của X.
Câu 6: (1,0 điểm)
Hình vẽ dưới đây mô tả quá trình điều chế và thu khí clo trong phòng thí nghiệm:
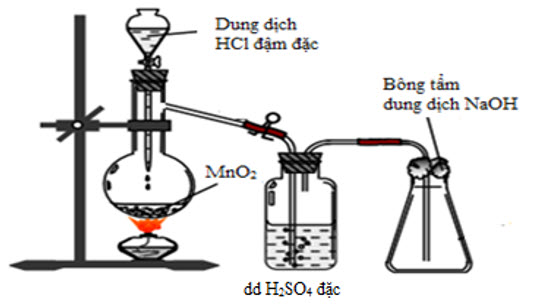
6.1. Viết phương trình hóa học xảy ra khi cho dung dịch $\text{HCl}$ đặc tác dụng với $\text{Mn}{{\text{O}}_{2}}$, đun nóng.
6.2. Nêu vai trò của bông tẩm dung dịch $\text{NaOH}$. Viết phương trình hóa học minh họa.
6.3. Bình đựng dung dịch H2SO4 đặc có vai trò gi?
—HẾT—
– Thí sinh không được sử dụng bảng tuần hoàn các nguyên tố hóa học.





