Bài toán xác định hỗn hợp 2 kim loại (hoặc 2 muối) hay Axit còn dư – Ôn thi HSG Hóa 9
Bài toán xác định hỗn hợp 2 kim loại (hoặc 2 muối) hay Axit còn dư – Ôn thi HSG Hóa 9
* Lưu ý: Khi gặp bài toán cho hỗn hợp 2 kim loại (hoặc 2 muối) tác dụng với axit, đề bài yêu cầu chứng minh axit còn dư hay hỗn hợp 2 kim loại còn dư. Ta giải như sau:
Giả sử hỗn hợp chỉ gồm một kim loại (hoặc muối) có M nhỏ, để khi chia khối lượng hỗn hợp 2 kim loại (hoặc hỗn hợp 2 muối) cho M có số mol lớn, rồi so sánh số mol axit để xem axit còn dư hay hỗn hợp còn dư:
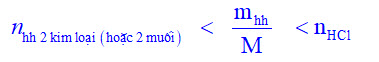
BÀI TẬP
Câu 1: Cho 31,8g hỗn hợp (X) gồm 2 muối MgCO3 và CaCO3 vào 0,8 lít dung dịch HCl 1M thu được dung dịch (Z).
- Hỏi dung dịch (Z) có dư axit không?
- Lượng CO2 có thể thu được bao nhiêu?
Câu 2: Cho 39,6g hỗn hợp gồm KHSO3 và K2CO3 vào 400g dung dịch HCl 7,3%,khi xong phản ứng thu được khí (X) có tỉ khối so với khí hiđro bằng 25,33% và một dung dịch (A).
- Hãy chứng minh rằng axit còn dư.
- Tính C% các chất trong dung dịch (A).
Câu 3: Hoà tan 13,2 gam hỗn hợp A gồm 2 kim loại có cùng hoá trị vào 400 ml dung dịch HCl 1,5M. Cô cạn dung dịch sau phản ứng thu được 32,7 gam hỗn hợp muối khan.
- Chứng minh hỗn hợp A không tan hết.
- Tính thể tích hiđro sinh ra.
Câu 4: Hỗn hợp A gồm 2 kim loại Mg và Zn. B là dung dịch H2SO4 có nồng độ mol là x mol/l.
- Trường hợp 1: Cho 24,3g (A) vào 2 lít (B) sinh ra 8,96 lít khí H2.
- Trường hợp 1: Cho 24,3g (A) vào 3 lít (B) sinh ra 11,2 lít khí H2.
(Các thể tích khí đều đo ở đktc).
- Hãy chứng minh trong trường hợp 1 thì hỗn hợp kim loại chưa tan hết, trong trường hợp 2 axit còn dư.
- Tính nồng độ x mol/l của dung dịch (B) và % khối lượng mỗi kim loại trong (A)