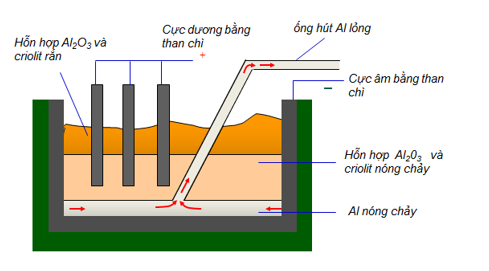
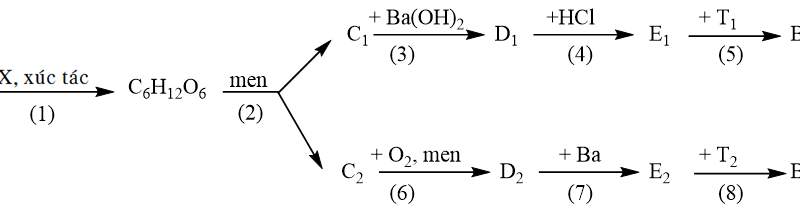
Đề HSG Hóa 9 Đề thi vào 10 Chuyên Hà Nội – Năm học 2020 – 2021
Đề HSG Hóa 9 Đề thi vào 10 Chuyên Hà Nội – Năm học 2020 – 2021
Câu I (2,0 điểm)
- Trên bề mặt các hố nước tôi vôi lâu ngày thường có lớp màng chất rắn. Hãy giải thích hiện tượng này và viết phương trình hóa học giải thích.
- Nêu hiện tượng, giải thích và viết phương trình hóa học xảy ra trong các thí nghiệm sau:
- Quấn thêm vào đầu dây sắt một mẩu than gỗ, đốt cho sắt và than nóng đỏ rồi đưa vào bình chứa khí oxy.
- Nhỏ vài giọt dung dịch AgNO3 vào ống nghiệm có sẵn 1 mL dung dịch NaCl, lọc lấy kết tủa để ngoài ánh sáng.
- Cho một mẩu natri vào ống nghiệm đựng nước. Đậy ống nghiệm bằng nút cao su có ống dẫn khí bằng thủy tinh xuyên qua. Sau một thời gian, đốt khí thoát ra từ đầu ống dẫn khí.
Câu II (2,0 điểm)
1. Viết phương trình hóa học của các phản ứng có thể xảy ra giữa các cặp chất sau:
- Rượu etylic (lỏng) và natri (rắn);
- Axit axetic (dung dịch) và natri cacbonat (dung dịch);
- Oxit sắt từ (rắn) và cacbon oxit (khí), nung nóng;
- Axit clohiđric (dung dịch đặc) và mangan đioxit (rắn), đun nhẹ.
2. Có bốn bình mất nhãn, mỗi bình chứa một trong bốn dung dịch không màu là: HCl, H2SO4, Na2SO4, NaNO3. Trình bày cách phân biệt dung dịch đựng trong mỗi bình, viết phương trình hóa học minh họa.
Câu III (2,0 điểm)
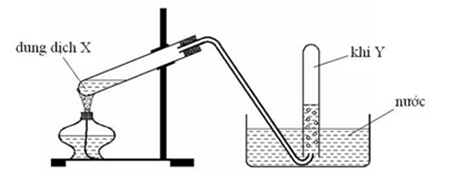
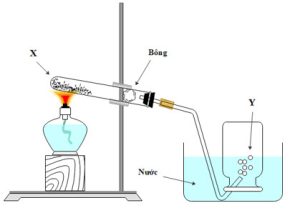
1. Cho hình vẽ bên mô tả thí nghiệm điều chế khí Y từ chất rắn X (giàu oxy).
- Hỏi Y là khí gì? Viết phương trình hóa học điều chế khí Y từ 2 chất X khác nhau (ghi rõ điều kiện nếu có).
- Khi ngừng thu khí, ta cần: tắt đèn cồn trước rồi tháo rời ống dẫn khí hay tháo rời ống dẫn khí trước khi tắt đèn cồn? Vì sao?
2. Hòa tan hết 2,080 gam hỗn hợp bột gồm Fe, FeS, FeS2, S bằng dung dịch H2SO4 đặc, nóng, dư thu được 2,688 lít (đktc) khí SO2 duy nhất và dung dịch X. Cho toàn bộ dung dịch X tác dụng với dung dịch NaOH dư, lọc lấy toàn bộ kết tủa đem nung đến khối lượng không đổi, thu được m gam chất rắn. Tìm giá trị của m.
Câu IV (2,0 điểm)
- Cho 1,896 gam KMnO4 vào dung dịch HCl đặc, dư, đun nhẹ. Sau khi kết thúc phản ứng, cho toàn bộ lượng Cl2 tạo ra tác dụng hết với kim loại M (hóa trị n không đổi trong các hợp chất), thu được 5,380 gam hỗn hợp chất rắn X. Cho toàn bộ lượng X vào dung dịch AgNO3 dư, thu được 12,930 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Xác định kim loại M.
- Hỗn hợp X gồm FeO, Cu, Fe2O3. Hòa tan hoàn toàn m gam hỗn hợp X trong dung dịch HCl vừa đủ, chỉ thu được dung dịch Y gồm 2 chất tan. Đem toàn bộ dung dịch Y tác dụng với dung dịch AgNO3 dư, thu được 36,8 gam kết tủa gồm AgCl và Ag. Nếu cho toàn bộ dung dịch Y tác dụng với dung dịch NaOH dư, lọc lấy kết tủa nung ngoài không khí đến khối lượng không đổi, thu được 8,0 gam chất rắn khan. Mặt khác, nếu hòa tan hoàn toàn m gam hỗn hợp X trong H2SO4 đặc, nóng, dư, thu được V lít (đktc) khí SO2 duy nhất. Tìm giá trị của m, V.
Câu V (2,0 điểm)
- Tiến hành thí nghiệm: cho chất X (C2H6O) và chất Y (C2H4O2) vào ống nghiệm, thêm một ít H2SO4 đặc làm xúc tác rồi đun nóng thu được sản phẩm chứa chất hữu cơ Z (C4H8O2). Biết chất Y làm quỳ tím ẩm chuyển sang màu đỏ, xác định công thức cấu tạo, gọi tên các chất X, Y, Z và viết phương trình hóa học xảy ra.
- Hỗn hợp X gồm C2H4, C3H6, CH4, C2H6 và H2. Khi cho 1,920 gam hỗn hợp X vào bình đựng dung dịch brom (dư) thì có tối đa 0,040 mol Br2 tham gia phản ứng. Mặc khác, đốt cháy hoàn toàn 0,135 mol hỗn hợp X cần dùng vừa đủ V lít (đktc) khí O2, sau phản ứng thu được m gam CO2 và 4,860 gam H2 Tìm giá trị của m, V.
Cho biết nguyên tử khối của một số nguyên tố: H = 1; C = 12; N = 14; O = 16; Mg = 24; S = 32; Cl = 35,5; K = 39; Ca = 40; Mn = 55; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137.