Đề HSG Hóa 9 Đề thi vào 10 Chuyên Yên Bái – Năm học 2020 – 2021
Đề HSG Hóa 9 Đề thi vào 10 Chuyên Yên Bái – Năm học 2020 – 2021
Câu 1. (1,5 điểm)
1. Hợp chất M được tạo bởi hai nguyên tố A và B có công thức là A2B. Tổng số hạt proton trong phân tử M là 54. Số hạt mang điện trong nguyên tử A gấp 1,1875 lần số hạt mang điện trong nguyên tử B. Xác định A, B và công thức phân tử M.
2. Sau khi làm bay hơi 100 gam H2O ra khỏi 500 gam dung dịch CuSO4 có nồng độ 16%, thu được dung dịch bão hòa Y. Cho m gam CuSO4 vào Y thấy tách ra 10 gam CuSO4.5H2O kết tinh. Xác định giá trị của m.
Câu 2. (2,5 điểm)
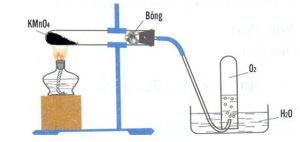
1. Tiến hành một thí nghiệm như hình vẽ:
a) Trong phòng thí nghiệm, bộ dụng cụ ở hình vẽ bên có thể dùng để điều chế những chất khí nào trong số các khí sau: CO2, NH3, HCl, CH4, O2. Giải thích.
b) Mỗi khí điều chế được, hãy viết phản ứng điều chế từ chất A thích hợp.
2. T là chất rắn không tan trong nước và có sẵn trong tự nhiên. Nung T đến khối lượng không đổi, thu được chất rắn Z màu trắng và khí D không màu. Chất Z phản ứng mãnh liệt với nước tạo thành dung dịch E làm xanh quỳ tím. T tan trong nước khi có mặt khí D tạo thành dung dịch F. E phản ứng với F tạo ra T. Xác định các chất T, Z, D, E, F và viết các phương trình phản ứng để giải thích.
3. Dẫn hơi nước qua than nung nóng đỏ, thu được 15,68 lít (đktc) hỗn hợp khí X gồm CO2, CO, H2. Dẫn toàn bộ X qua hỗn hợp CuO và Al2O3 nung nóng, sau khi phản ứng hoàn toàn thu được chất rắn Y, hỗn hợp gồm khí CO2 và hơi nước. Cho toàn bộ Y vào dung dịch H2SO4 đặc nóng (dư), sau phản ứng thu được 12,32 lít khí (đktc).
a) Viết các phương trình phản ứng xảy ra.
b) Tính thành phần phần trăm thể tích CO và CO2 trong X.
Câu 3. (2,0 điểm)
Hỗn hợp X gồm ba kim loại Al, Fe và Cu. Cho m gam X vào dung dịch CuSO4 (dư), sau khi phản ứng xảy ra hoàn toàn, thu được 35,2 gam kim loại. Nếu cũng hòa tan m gam X vào 500ml dung dịch HCl 2M đến khi phản ứng xảy ra hoàn toàn, thu được 8,96 lít khí H2 (đktc), dung dịch Y và a gam chất rắn.
1. Viết các phương trình phản ứng xảy ra và tìm giá trị của a.
2. Cho từ từ dung dịch NaOH 2M vào dung dịch Y và khuấy đầu đến khi thấy bắt đầu xuất hiện kết tủa thì dùng hết V1 lít dung dịch NaOH 2M, tiếp tục thêm dung dịch NaOH 2M vào đến khi lượng kết tủa không có sự thay đổi nữa thì dùng hết 600ml dung dịch NaOH 2M. Tìm các giá trị m và V1.
Câu 4. (1,25 điểm)
1. Hợp chất Parametađion (thuốc chống co giật) chứa 53,45%C; 7,01%H; 8,92%N, còn lại là O. Biết phân tử khối của hợp chất là 157. Xác định công thức phân tử của Parametađion.
2. Hiđrocacbon A tác dụng với Cl2 thu được một sản phẩm hữu cơ duy nhất có công thức phân tử C2H4Cl2. Hiđrocacbon B tác dụng với Cl2 có thể thu được hỗn hợp hai sản phẩm hữu cơ có cùng công thức phân tử C2H4Cl2. Cho biết công thức cấu tạo của A, B và viết phương trình phản ứng.
Câu 5. (1,5 điểm)
1. Để làm giảm hiệu ứng nhà kính của bầu khí quyển trên Trái Đất, chúng ta cần phải chấm dứt nạn đốt phá rừng và trồng thêm thật nhiều cây xanh. Hãy giải thích các biện pháp này trên cơ sở Hóa học và viết các phương trình phản ứng (nếu có).
2. Năm hợp chất hữu cơ đơn chức, mạch hở A, B, C, D, E (chứa C, H, O) đều
có phân tử khối bằng 60 đvC.
- A phản ứng với Na, tác dụng Na2CO3 tạo ra CO2.
- B phản ứng với NaOH, không tác dụng Na.
- C, D phản ứng Na (tỉ lệ 1:1), không phản ứng NaOH.
- E không phản ứng Na, không phản ứng với dung dịch NaOH.
Dựa vào tính chất của các hợp chất hữu cơ, lập luận viết công thức cấu tạo
và phương trình phản ứng của các chất A, B, C, D và E.
Câu 6. (1,25 điểm)
1. Cho hỗn hợp A gồm 3 hiđrocacbon mạch hở A1, A2, A3 có công thức phân tử lần lượt là CxHy; C3xHy+2; C2xHy+2. Khi đốt cháy hoàn toàn A1, thu được thể tích hơi H2O gấp đôi thể tích khí CO2 ở cùng điều kiện nhiệt độ, áp suất. Xác định công thức phân tử, công thức cấu tạo của A1, A2 và A3. Cho biết phản ứng hóa học đặc trưng của A2 và giải thích.
2. Cho hỗn hợp X gồm rượu CaH2a+1OH và axit hữu cơ CbH2b+1COOH ( với a, b: nguyên; a=b+1). Chia X làm ba phần bằng nhau:
Phần 1: Đem đốt cháy hoàn toàn rồi dẫn toàn bộ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2, thấy bình nặng thêm 34,6 gam, trong đó có 30 gam kết tủa. Dung dịch thu được sau khi lọc kết tủa, đem đun nóng lại thấy tạo ra 10 gam kết tủa.
Phần 2: Để trung hòa axit hữu cơ phải dùng 100 ml dung dịch NaOH 0,5M.
Phần 3: Đem đun nóng có mặt H2SO4 đặc, thu được m gam este (hiệu suất của phản ứng là 75%).
a) Viết các phương trình phản ứng.
b) Xác định công thức của rượu và axit hữu cơ trong
c) Tính giá trị của m.
( Biết: H = 1; C=12; N = 14; S = 32; Na = 23; Mg = 24; Cl = 35,5; Ca = 40; Al = 27; Cu = 64; Fe = 56).
HẾT