File word Đề thi TS vào 10 Chuyên Hóa – Hà Nội – Năm học 2022 – 2023
Đề thi TS vào 10 Chuyên Hóa – Hà Nội – Năm học 2022 – 2023


Câu 1: (2,0 điểm)
1. $X$ và $Y$ là hai nguyên tố kế tiếp nhau trong cùng một chu kì của bảng tuần hoàn. Tổng số proton trong hạt nhân nguyên tử $X$ và $Y$ là 23 . Biết $X$ đứng trước $Y$ trong bảng tuần hoàn. Xác định số lớp electron của mỗi nguyên tử $X$ và $Y$.
2. Viết $\mathrm{PTHH}$ điều chế $\mathrm{CaCO}_3$ và $\mathrm{MgCO}_3$ từ quặng Dolomit $\left(\mathrm{CaCO}_3 \cdot \mathrm{MgCO}_3\right)$.
3. Xác định các chất vô cơ ứng với các kí hiệu $\mathrm{A}, \mathrm{A}_1, \mathrm{~A}_2, \mathrm{~A}_3, \mathrm{~B}, \mathrm{~B}_1, \mathrm{~B}_2, \mathrm{~B}_3$ trong sơ đồ chuyển hóa dưới đây và viết các PTHH xảy ra.
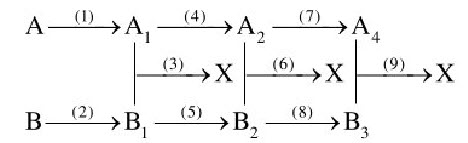
Biết $\mathrm{A}$ là kim loại hóa trị 2 ; $\mathrm{B}$ là khí rất độc, được sinh ra trong lò than : $\mathrm{M}_{\mathrm{A}}+\mathrm{M}_{\mathrm{B} 2}=237 ; \mathrm{M}_{\mathrm{B} 1}+\mathrm{M}_{\mathrm{A} 2}=215$. Hướng dẫn
1. $\left|\begin{array}{l}\mathrm{p}_{\mathrm{X}}+\mathrm{p}_{\mathrm{Y}}=23 \\ \mathrm{p}_{\mathrm{X}}+1=\mathrm{p}_{\mathrm{Y}}\end{array} \rightarrow\right| \begin{aligned} & \mathrm{p}_{\mathrm{X}}=11 \rightarrow \mathrm{Na}: 1 \mathrm{~s}^2 2 \mathrm{~s}^2 2 \mathrm{p}^6 3 \mathrm{~s}^1 \rightarrow 3 \text { lớp electron } \\ & \mathrm{p}_{\mathrm{Y}}=12 \rightarrow \mathrm{Mg}: 1 \mathrm{~s}^2 2 \mathrm{~s}^2 2 \mathrm{p}^6 3 \mathrm{~s}^2 \rightarrow 3 \text { lớp electron }\end{aligned}$
$\mathrm{CaCO}_3 \stackrel{t^{\circ}}{\longrightarrow} \mathrm{CaO}+\mathrm{H}_2 \mathrm{O} \quad \mathrm{CaO}+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{Ca}(\mathrm{OH})_2 \quad \mathrm{Ca}(\mathrm{OH})_2+2 \mathrm{CO}_2 \rightarrow \mathrm{Ca}\left(\mathrm{HCO}_3\right)_2$
$\mathrm{Ca}\left(\mathrm{HCO}_3\right)_2 \stackrel{t^{\circ}}{\longrightarrow} \mathrm{CaCO}_3+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O} \quad \mathrm{MgO}+2 \mathrm{HCl} \rightarrow \mathrm{MgCl}_2+\mathrm{H}_2 \mathrm{O}$
$\mathrm{MgCl}_2+\mathrm{Na}_2 \mathrm{CO}_3 \rightarrow 2 \mathrm{NaCl}+\mathrm{MgCO}_3 \quad 2 \mathrm{HCl}+\mathrm{Na}_2 \mathrm{CO}_3 \rightarrow 2 \mathrm{NaCl}+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O}$
3. $\left|\begin{array}{l}\mathrm{A}: \mathrm{Ca} \text { hoặc } \mathrm{Ba} \\ \mathrm{B}: \mathrm{CO} \rightarrow \mathrm{B}_1: \mathrm{CO}_2\end{array} \rightarrow\right| \begin{aligned} & \mathrm{M}_{\mathrm{A}_2}=171 \rightarrow \mathrm{A}_2: \mathrm{Ba}(\mathrm{OH})_2 \\ & \rightarrow \mathrm{A}: \mathrm{Ba} \rightarrow \mathrm{M}_{\mathrm{B}_2}=100 \rightarrow \mathrm{B}_2: \mathrm{KHCO}_3\end{aligned} \rightarrow\left|\begin{array}{l}\mathrm{A}_1: \mathrm{BaO} \\ \mathrm{X}: \mathrm{BaCO}_3\end{array} ;\right| \begin{aligned} & \mathrm{A}_3: \mathrm{BaCl}_2 \\ & \mathrm{~B}_3: \mathrm{K}_2 \mathrm{CO}_3\end{aligned}$
(1) $2 \mathrm{Ba}+\mathrm{O}_2 \stackrel{\mathrm{t}^{\circ}}{\longrightarrow} 2 \mathrm{BaO}$
(2) $2 \mathrm{CO}+\mathrm{O}_2 \stackrel{\mathrm{t}^{\circ}}{\longrightarrow} 2 \mathrm{CO}_2$
(3) $\mathrm{BaO}+\mathrm{CO}_2 \stackrel{t^{\circ}}{\longrightarrow} \mathrm{BaCO}_3$
(4) $\mathrm{BaO}+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{Ba}(\mathrm{OH})_2$
(5) $\mathrm{CO}_2+\mathrm{KOH} \rightarrow \mathrm{KHCO}_3$
(6) $\mathrm{Ba}(\mathrm{OH})_2+\mathrm{KHCO}_3 \rightarrow \mathrm{BaCO}_3+\mathrm{KOH}+\mathrm{H}_2 \mathrm{O}$
(7) $\mathrm{Ba}(\mathrm{OH})_2+2 \mathrm{HCl} \rightarrow \mathrm{BaCl}_2+2 \mathrm{H}_2 \mathrm{O}$
(8) $\mathrm{KHCO}_3+\mathrm{KOH} \rightarrow \mathrm{K}_2 \mathrm{CO}_3+\mathrm{H}_2 \mathrm{O}$
(9) $\mathrm{BaCl}_2+\mathrm{K}_2 \mathrm{CO}_3 \rightarrow 2 \mathrm{KCl}+\mathrm{BaCO}_3$
Câu 2: (2,0 điểm)
1. Giải thích các cách làm sau :
– Không để các bình chứa xăng dầu (chủ yếu là các hidrocabon có công thức chung $\mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}+2}$ ) gần lửa, trong khi đó có thể nấu chảy nhựa đường (cũng chủ yếu các hidrocacbon có công thức chung $\mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}+2}$ ) để làm giao thông. – Dùng nước sôi hoặc bột thông cống (thành phần chính $\mathrm{NaOH}$ ) dể thông ống nước thải nhà bếp bị tắc do dầu, mỡ bám vào thành ống.
Hướng dẫn
– Xăng dầu là các ankan mạch ngắn nên dễ bay hơi $\left(\mathrm{C}_7 \mathrm{H}_{16}-\mathrm{C}_{11} \mathrm{H}_{24}\right)$, dễ bắt cháy nên không được để gần lửa. Còn nhựa đường là các ankan số $\mathrm{C}$ lớn, mạch cacbon dài, thể rắn nên khó bay hơi, kém bắt lửa nên dùng để làm giao thông.
– Dầu, mỡ là chất béo dễ bị thủy phân trong kiềm $(\mathrm{NaOH})$ tạo thành muối và glixerol là các chất dễ tan.
Nước sôi làm dầu mỡ thể rắn nhiệt độ thường thành thể lỏng nên dễ rửa trôi.
2. Trong môi trường axit ở dạ dày và nhiệt độ cơ thể, saccarozo bị thủy phân thành đường glucozo và fructozo, sau đó các sản phẩm này tiếp tục bị oxi hóa bởi oxi tạo thành $\mathrm{CO}_2$ và $\mathrm{H}_2 \mathrm{O}$.
– Viết các PTHH xảy ra
– Sự thay đổi năng lượng của phản ứng oxi hóa glucozo được cho ở hình bên.
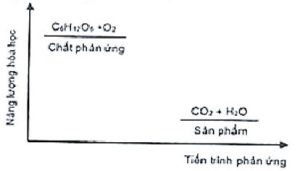
Hãy cho biết phản ứng này là tỏa nhiệt hay thu nhiệt? Vì sao. Biết phản ứng tỏa nhiệt là phản ứng diễn ra kèm theo sự giải phóng năng lượng dưới dạng nhiệt ; phản ứng thu nhiệt là phản ứng diễn ra kèm theo sự hấp thụ năng lượng dưới dạng nhiệt.
– Khi cho 1 mol glucozo bị oxi hóa hoàn toàn với một lượng vừa đủ oxi thì trao đổi một lượng nhiệt (ở điều kiện chuẩn $25^{\circ} \mathrm{C}$ và $0,987 \mathrm{~atm}$ ) là $5352 \mathrm{~kJ}$. Nếu 7,2 gam glucozo bị oxi hóa hoàn toàn thì trao đổi một lượng nhiệt (ở điều kiện như trên) là bao nhiêu $\mathrm{kJ}$ ?
Hướng dẫn
$-\mathrm{C}_{12} \mathrm{H}_{22} \mathrm{O}_{11} \underset{t^{\circ}}{\stackrel{\mathrm{H}^{+}}{\longrightarrow}} \mathrm{C}_6 \mathrm{H}_{12} \mathrm{O}_6$ (Glucozo) $+\mathrm{C}_6 \mathrm{H}_{12} \mathrm{O}_6$ (Fructozo)
$$
\mathrm{C}_6 \mathrm{H}_{12} \mathrm{O}_6+6 \mathrm{O}_2 \underset{\mathrm{xt}}{\stackrel{t^0}{\longrightarrow}} 6 \mathrm{CO}_2+6 \mathrm{H}_2 \mathrm{O}
$$
– Vì năng lượng hóa học của chất phản ứng lớn hơn chất tham gia nên đây là phản ứng tỏa nhiệt.
– 7,2 gam glucozo trao đổi lượng nhiệt $\mathrm{Q}=7,2: 180.5352=214,08 \mathrm{~kJ}$.
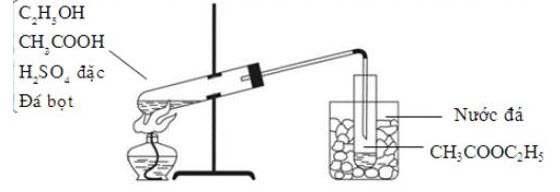
3. Hình 1 và hình 2 minh họa phương pháp điều chế và tách etyl axetat trong phòng thí nghiệm :
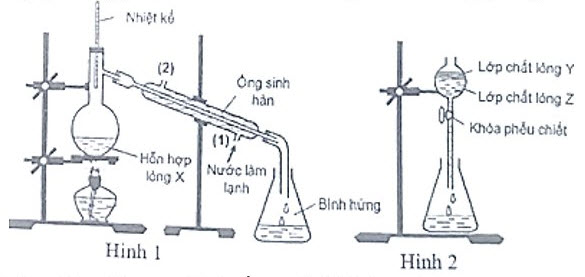
– Xác định thành phần hỗn hợp lỏng $\mathrm{X}$ trong bình cầu trước khi đun nóng.
– Sau thí nghiệm, thêm $2 \mathrm{ml}$ dung dịch $\mathrm{NaCl}$ bão hòa vào bình hứng etyl axetat, lắc đều rồi đổ vào phễu chiết, để yên một thời gian thu được kểt quả như hình 2. Nêu thành phần lớp chất lỏng $\mathrm{Y}$, lớp chất lỏng $\mathrm{Z}$ và giải thích vai trò của dung dịch $\mathrm{NaCl}$ bão hòa.
– Ông sinh hàn là một dụng cụ thủy tinh có thể cho nước đi vào từ (1) chảy qua ống rồi đi ra ở (2), trong quá trình thí nghiệm, nước luôn chảy qua ống sinh hàn. Nêu tác dụng của ống sinh hàn. Nếu không có ống sinh hàn, có thể thay thế ống sinh hàn bằng cách nào?
Hướng dẫn
– Hỗn hợp X: $\mathrm{CH}_3 \mathrm{COOH}$ và $\mathrm{C}_2 \mathrm{H}_5 \mathrm{OH} \quad \mathrm{CH}_3 \mathrm{COOH}+\mathrm{C}_2 \mathrm{H}_5 \mathrm{OH} \stackrel{\mathrm{H}_2 \mathrm{SO}_{4(\text { dăc })}}{{t^{\circ}}^{\longrightarrow}} \mathrm{CH}_3 \mathrm{COOC}_2 \mathrm{H}_5+\mathrm{H}_2 \mathrm{O}$
– Chất lỏng Y: $\mathrm{CH}_3 \mathrm{COOC}_2 \mathrm{H}_5 ; \mathrm{Z}: \mathrm{NaCl}, \mathrm{CH}_3 \mathrm{COOH}, \mathrm{C}_2 \mathrm{H}_5 \mathrm{OH}, \mathrm{H}_2 \mathrm{O}$. Dung dịch $\mathrm{NaCl}$ bão hòa làm tăng tỉ trọng dung dịch giúp este nổi lên trên mặt chất lỏng.
– Ống sinh hàn làm lạnh hơi nóng chuyển thành thể lỏng. Có thể thay ống sinh hàn bằng bình chứa nước đá.
Câu 3: (2,0 điểm)
1. Ba hợp chất hữu cơ mạch hở $\mathrm{X}, \mathrm{Y}, \mathrm{Z}$ có công thức chung là $\mathrm{C}_3 \mathrm{H}_6 \mathrm{O}_{\mathrm{n}}(0 \leq \mathrm{n} \leq 2)$. Đốt cháy hoàn toàn cùng số mol của $X$, hoặc $\mathrm{Y}$ hoặc $\mathrm{Z}$ thì lượng oxi dùng để đốt cháy $\mathrm{X}$ nhiều hơn lượng oxi dùng để đốt cháy $\mathrm{Y}$, lượng oxi dùng để đốt cháy $\mathrm{Y}$ nhiều hơn lượng oxi dùng để đốt cháy $\mathrm{Z}$. Tiến hành thí nghiệm với các chất $\mathrm{X}, \mathrm{Y}, \mathrm{Z}$ thu được kết quả như bảng dưới đây. Biết: ‘+’ có phản ứng ; ‘-‘ không phản ứng.
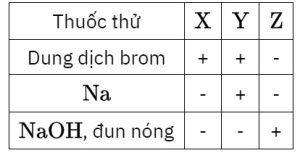
– Chất $\mathrm{Z}$ tác dụng với dung dịch $\mathrm{NaOH}$ đun nóng tạo ra ancol có trong thành phần của rượu giả, ancol này đi vào cơ thể gây ảnh hưởng nghiêm trọng đến thần kinh thị giác và hệ thần kinh trung ương, liều lượng lớn có thể dẫn đến tử vong.
– Trong cấu tạo, nhóm -OH không liên kết trực tiếp với nguyên tử cacbon của liên kết đôi $-\mathrm{C}=\mathrm{C}$ – hoặc $-\mathrm{C} \equiv \mathrm{C}$ Hướng dẫn
$\mathrm{O}_2$ đốt cháy $\mathrm{X}>\mathrm{Y}>\mathrm{Z} \rightarrow \mathrm{X}: \mathrm{C}_3 \mathrm{H}_6\left(\mathrm{CH}_2=\mathrm{CHCH}_3\right) ; \mathrm{Y}: \mathrm{C}_3 \mathrm{H}_6 \mathrm{O}\left(\mathrm{CH}_2=\mathrm{CH}-\mathrm{CH}_2 \mathrm{OH}\right) ; \mathrm{Z}: \mathrm{C}_3 \mathrm{H}_6 \mathrm{O}_2\left(\mathrm{CH}_3 \mathrm{COOCH}_3\right)$
$\mathrm{CH}_2=\mathrm{CHCH}_3+\mathrm{Br}_2 \rightarrow \mathrm{CH}_2(\mathrm{Br})-\mathrm{CH}(\mathrm{Br}) \mathrm{CH}_3 \quad \mathrm{CH}_2=\mathrm{CHCH}_2 \mathrm{OH}+\mathrm{Na} \rightarrow \mathrm{CH}_2=\mathrm{CHCH}_2 \mathrm{ONa}+0,5 \mathrm{H}_2$
$$
\mathrm{CH}_2=\mathrm{CHCH}_2 \mathrm{OH}+\mathrm{Br}_2 \rightarrow \mathrm{CH}_2(\mathrm{Br})-\mathrm{CH}(\mathrm{Br}) \mathrm{CH}_2 \mathrm{OH} \quad \mathrm{CH}_3 \mathrm{COOCH}_3+\mathrm{NaOH} \rightarrow \mathrm{CH}_3 \mathrm{COONa}^2 \mathrm{CH}_3 \mathrm{OH}
$$
2. Hòa tan hỗn hợp gồm $\mathrm{C}$ và $\mathrm{S}$ vào dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ đặc nóng thu được hỗn hợp khí $\mathrm{X}$ gồm $\mathrm{CO}_2, \mathrm{SO}_2$. Hấp thụ hoàn toàn 27,8 gam khí $\mathrm{X}$ vào $500 \mathrm{ml}$ dung dịch $\mathrm{Y}$ gồm $\mathrm{NaOH} 0,8 \mathrm{M}$ và $\mathrm{KOH} 0,6 \mathrm{M}$ thu được dung dịch $\mathrm{Z}$ chứa 56,1 gam chất tan (chỉ gồm hỗn hợp các muối). Cũng cho lượng hỗn hợp $\mathrm{X}$ như trên hấp thụ hết vào $900 \mathrm{ml}$ dung dịch $\mathrm{Y}$ thì thu được dung dịch chứa $\mathrm{m}$ gam chất tan. Tìm giá trị của $\mathrm{m}$.
Hướng dẫn
$900 \mathrm{ml}$ dung dich $\mathrm{Y}$ thì $\mathrm{n}\left(\mathrm{CO}_2, \mathrm{SO}_2\right)=0,45<0,5 \cdot \mathrm{n}(\mathrm{NaOH}, \mathrm{KOH})=0,63 \rightarrow$ chất tan: kiềm dư, muối trung hòa $\left(\mathrm{CO}_2, \mathrm{SO}_2\right)^{0,45} \rightarrow \mathrm{H}_2 \mathrm{O}^{0,45} \stackrel{\mathrm{BTKL}}{\longrightarrow} \mathrm{m}_{\mathrm{X}}+\mathrm{m}_{(\mathrm{NaOH}, \mathrm{KOH})}=\mathrm{m}+\mathrm{m}_{\mathrm{H}_2 \mathrm{O}} \rightarrow \mathrm{m}=78,74$ (gam)
Câu 4: (2,0 điểm)
1. Hòa tan hết 6,27 gam chất $\mathrm{A}$ vào 150 gam nước thu được dung dịch $\mathrm{B}$ chứa một chất tan duy nhất. Cho một lượng muối $\mathrm{BaCl}_2$ khan vào dung dịch $\mathrm{B}$ thấy tạo ra 6,99 gam kết tủa trắng không tan trong axit, không có khí thoát ra. Lọc bỏ phần kết tủa thu được dung dịch $\mathrm{C}$. Cho một lượng $\mathrm{Mg}$ dư vào dung dịch $\mathrm{C}$, thu được 1,68 lít $\mathrm{H}_2$ (đktc) và dung dịch $\mathrm{D}$. Biết các phản ứng xảy ra hoàn toàn.
a. Xác định $\mathrm{A}$.
b. Tính $\mathrm{C} \%$ các chất tan trong dung dịch $\mathrm{D}$.
c. Tính khối lượng $\mathrm{A}$ và khối lượng dung dịch $\mathrm{B} 10 \%$ cần dùng để pha chế 300 gam dung dịch có nồng độ chất tan là $40 \%$.
Hướng dẫn
$\mathrm{B}$ pứ $\mathrm{BaCl}_2$ cho kết tủa $\mathrm{BaSO}_4$ nên $\mathrm{B}$ có gốc $\mathrm{SO}_4$ và $\mathrm{C}$ pứ với $\mathrm{Mg}$ cho $\mathrm{H}_2$ nên $\mathrm{C}$ có tính axit $\rightarrow \mathrm{A}_2 \mathrm{H}_2 \mathrm{SO}_4 \cdot \mathrm{nSO}_3$
$$
\mathrm{H}_2 \mathrm{SO}_4 \cdot \mathrm{nSO}_3+\mathrm{nH}_2 \mathrm{O} \rightarrow(\mathrm{n}+1) \mathrm{H}_2 \mathrm{SO}_4 \quad \mathrm{BaCl}_2+\mathrm{H}_2 \mathrm{SO}_4 \rightarrow \mathrm{BaSO}_4+2 \mathrm{HCl} \quad \mathrm{Mg}+2 \mathrm{H}^{+} \rightarrow \mathrm{Mg}^{2+}+\mathrm{H}_2
$$
$$
\mathrm{a} \rightarrow \quad(\mathrm{n}+1) \mathrm{a} \quad 0,03 \quad 0,03 \quad \leftarrow 0,03 \rightarrow 0,06 \quad 0,15 \quad \leftarrow 0,075
$$
a,b. Nhận xét: $\mathrm{nHCl}<2 \mathrm{nH}_2$ nên $\mathrm{BaCl}_2$ hết, $\mathrm{H}_2 \mathrm{SO}_4$ còn dư
$$
\mathrm{H}_2 \mathrm{SO}_{4(\mathrm{dur})}\left|\begin{array}{l}
(98+80 \mathrm{n}) \mathrm{a}=6,27 \\
\mathrm{n}_{\mathrm{H}^{+}}=2(\mathrm{n}+1) \mathrm{a}=0,15
\end{array} \rightarrow\right| \begin{aligned}
& \mathrm{a}=0,015 \\
& \mathrm{an}=0,06
\end{aligned} \rightarrow \mid \begin{aligned}
& \mathrm{n}=4 \\
& \mathrm{~A}: \mathrm{H}_2 \mathrm{SO}_4 \cdot 4 \mathrm{SO}_3
\end{aligned} \rightarrow \begin{aligned}
& \mathrm{m}_{\mathrm{A}}+\mathrm{m}_{\mathrm{H}_2 \mathrm{O}}+\mathrm{m}_{\mathrm{BaCl}_2}+\mathrm{m}_{\mathrm{Mg}}=\mathrm{m}_{(\downarrow+\uparrow)}+\mathrm{m}_{\mathrm{D}} \\
& \mathrm{D}^{157,17 \mathrm{~g}} \rightarrow \mathrm{MgCl}_2^{1,81 \%} ; \mathrm{MgSO}_4^{3,44 \%}
\end{aligned}
$$
c. $\left|\begin{array}{l}\mathrm{A}: \mathrm{H}_2 \mathrm{SO}_4 \cdot 4 \mathrm{SO}_3^{\mathrm{x}(\mathrm{mol})} \\ \mathrm{B}: \mathrm{H}_2 \mathrm{SO}_4{ }^{\mathrm{m}(\mathrm{g})}: 10 \%\end{array} \rightarrow\right| \begin{aligned} & 418 \mathrm{x}+\mathrm{m}=300 \\ & 98.5 \mathrm{x}+0,1 \mathrm{~m}=300.0,4\end{aligned} \rightarrow \mid \begin{aligned} & \mathrm{x}=0,2 \rightarrow \mathrm{mA}=83,6(\mathrm{gam}) \\ & \mathrm{m}=216,4\end{aligned}$
2. Để xác định công thức khoáng vật $X$, tiến hành các thí nghiệm sau:
Thí nghiệm 1: cho 5,55 gam $\mathrm{X}$ tác dụng hết với lượng dư dung dịch $\mathrm{HCl}$ thu được 0,672 lít (đktc) khí $\mathrm{Y}$ không màu, không mùi, làm đục nước vôi trong nhưng không làm mất màu nước brom.
Thí nghiệm 2: nung nóng $\mathrm{m}$ gam $\mathrm{X}$ ở $250^{\circ} \mathrm{C}$ thu được chất rắn $\mathrm{Z}$ (chỉ chứa một chất) có khối lượng giảm 57,03\% so với $\mathrm{X}$, hỗn hợp khí và hơi không màu, không mùi. Nếu tiếp tục nung nóng $\mathrm{Z}$ ở nhiệt độ cao hơn thì khối lượng vẫn không đổi. Lấy 1,855 gam $\mathrm{Z}$ cho tác dụng với lượng dư dung dịch $\mathrm{HCl}$, sau phản ứng thu được 0,392 lít khí Y (đktc). Tìm CTHH của X.
Hướng dẫn
Khí $\mathrm{Y}$ không màu, không mùi, làm đục nước vôi trong nhưng không làm mất màu nước brom nên $\mathrm{Y}$ là: $\mathrm{CO}_2$ Suy ra $\mathrm{X}$ chứa gốc $\mathrm{HCO}_3$ hoặc $\mathrm{CO}_3$. Nung $\mathrm{X}$ thu được $\mathrm{Z}$ chỉ chứa một chất, nung $\mathrm{Z}$ thì khối lượng vẫn không đổi nên $\mathrm{Z}$ có thể là hỗn hợp muối cacbonat của kim loại kiềm: $\mathrm{xMHCO}_3 \cdot \mathrm{yM}_2 \mathrm{CO}_3 \cdot \mathrm{nH}_2 \mathrm{O}$
$$
\left|\begin{array}{l|l}
\mathrm{Z}: \mathrm{M}_2 \mathrm{CO}_3{ }^{\mathrm{a}(\mathrm{mol})} \\
(2 \mathrm{M}+60) \mathrm{a}=1,855 \\
\mathrm{nCO}_2=\mathrm{a}=0,0175
\end{array} \rightarrow \begin{array}{l}
\mathrm{M}=23 \rightarrow \mathrm{Z}: \mathrm{Na}_2 \mathrm{CO}_3 \\
\mathrm{X}: \mathrm{xNaHCO} \cdot \mathrm{xNa}_2 \mathrm{CO}_3 \cdot \mathrm{nH}_2 \mathrm{O}^{\mathrm{b}(\mathrm{mol})} \\
\stackrel{57,03 \%}{\longrightarrow} \mathrm{Z}^{2,385 \mathrm{~g}} \rightarrow \mathrm{Na}_2 \mathrm{CO}_3^{0,0225}
\end{array} \rightarrow\right| \begin{aligned}
& (84 \mathrm{x}+106 \mathrm{y}+18 \mathrm{n}) \mathrm{b}=5,55 \\
& \mathrm{nCO}_2=(\mathrm{x}+\mathrm{y}) \mathrm{b}=0,03 \\
& (\mathrm{x}+2 \mathrm{y}) \mathrm{b}=2.0,0225
\end{aligned} \rightarrow \begin{aligned}
& \mathrm{xb}=\mathrm{yb}=0,015 \\
& \mathrm{x}=\mathrm{y}=1 ; \mathrm{b}=0,015 \\
& \mathrm{n}=10
\end{aligned}
$$
Suy ra $\mathrm{CTHH}$ của $\mathrm{X}$ là: $\mathrm{NaHCO}_3 \cdot \mathrm{Na}_2 \mathrm{CO}_3 \cdot 10 \mathrm{H}_2 \mathrm{O}$.
Câu 5: (2,0 điểm)
1. Hỗn hợp $\mathrm{X}$ gồm ba axit cacboxylic mạch hở $\mathrm{A}, \mathrm{B}, \mathrm{D}\left(\mathrm{A}, \mathrm{B}\right.$ đều có công thức tổng quát là $\mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}+1} \mathrm{COOH}$ và $\mathrm{B}$ nhiều hơn $\mathrm{A}$ một nguyên tử cacbon, $\mathrm{D}$ có công thức tổng quát là $\mathrm{C}_{\mathrm{x}} \mathrm{H}_{2 \mathrm{x}-1} \mathrm{COOH}(\mathrm{x} \geq 2)$. Cho 5,92 gam $\mathrm{X}$ tác dụng hết với dung dịch $\mathrm{KOH}$ vừa đủ, cô cạn dung dịch sau phản ứng thu được 9,72 gam muối khan. Mặt khác, đốt cháy hoàn toàn 7,104 gam $\mathrm{X}$ thì thu được 5,376 lít khí $\mathrm{CO}_2$ (đktc). Tính $\%$ khối lượng các chất trong $\mathrm{X}$.
2. Cho 9,072 lít (đktc) hỗn hợp khí $\mathrm{X}$ gồm hai hidrocacbon mạch hở có công thức $\mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}}, \mathrm{C}_{\mathrm{m}} \mathrm{H}_{2 \mathrm{~m}-2}(\mathrm{~m}<\mathrm{n})$ và $\mathrm{H}_2$ vào bình kín chứa một ít bột $\mathrm{Ni}$. Nung nóng bình đến khi các phản ứng xảy ra hoàn toàn, thu được 5,04 lít (đktc) hỗn hợp khí $\mathrm{Y}$. Cho toàn bộ $\mathrm{Y}$ vào bình đựng dung dịch $\mathrm{Br}_2$ dư, kết thúc phản ứng thấy có 31,2 gam $\mathrm{Br}_2$ phản ứng và khối lượng bình $\mathrm{Br}_2$ tăng 3,84 gam, đồng thời thoát ra 2,352 lít (đktc) hỗn hợp khí $\mathrm{Z}$ gồm hai hidrocacbon. Tìm CTPT của hai hidrocacbon trong X. Biết $\mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}}$ có tính chất hóa học giống etilen; $\mathrm{C}_{\mathrm{m}} \mathrm{H}_{2 \mathrm{~m}-2}$ có tính chất hóa học giống axetilen.
Hướng dẫn
1. $\mathrm{X}^{5,92 \mathrm{~g}}\left|\begin{array}{l}\mathrm{A}, \mathrm{B} \\ \mathrm{D}\end{array} \rightarrow\right| \begin{aligned} & \stackrel{+\mathrm{KOH}}{\longrightarrow} \text { Muối }{ }^{9,72 \mathrm{~g}} \\ & \stackrel{+\mathrm{O}_2}{\longrightarrow} \mathrm{CO}_2^{0,2}\end{aligned}$ Để đơn giản ta qui $\mathrm{X}$ về các axit về đồng đẳng đơn giản nhất trong dãy
$$
\mathrm{X}\left|\begin{array}{l}
\mathrm{HCOOH}^{\mathrm{a}} \\
\mathrm{C}_2 \mathrm{H}_3 \mathrm{COOH}^{\mathrm{b}} \\
\mathrm{CH}_2{ }^{\mathrm{c}}
\end{array} \rightarrow\right| \begin{aligned}
& 46 \mathrm{a}+72 \mathrm{~b}+14 \mathrm{c}=5,92 \\
& 84 \mathrm{a}+110 \mathrm{~b}+14 \mathrm{c}=9,72 \\
& \underset{\mathrm{BT} . \mathrm{C}}{\longrightarrow} \mathrm{a}+3 \mathrm{~b}+\mathrm{c}=0,2
\end{aligned} \rightarrow\left|\begin{array}{l}
\mathrm{a}=0,06 \\
\mathrm{~b}=0,04 \\
\mathrm{c}=0,02
\end{array} \rightarrow\right| \begin{aligned}
& \text { Vì c }<\mathrm{b} \text { nên D là: } \mathrm{C}_2 \mathrm{H}_3 \mathrm{COOH} \\
& \text { Số } \mathrm{C}_{\mathrm{A}, \mathrm{B}}=\mathrm{nC}_{\mathrm{A}, \mathrm{B}}: \mathrm{n}_{\mathrm{A}, \mathrm{B}}=(0,06+0,02): 0,06=1,3 \\
& \rightarrow \mathrm{A}: \mathrm{HCOOH}^{0,04} ; \mathrm{B}: \mathrm{CH}_3 \mathrm{COOH}^{0,02}
\end{aligned}
$$
Phần trăm khối lượng các chất trong $\mathrm{X}$ là: $\mathrm{HCOOH}^{31,08 \%} ; \mathrm{CH}_3 \mathrm{COOH}^{20,27 \%} ; \mathrm{CH}_2=\mathrm{CHCOOH}^{48,65 \%}$
2. $\mathrm{X}^{0,405}\left|\begin{array}{l}\mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}}, \mathrm{C}_{\mathrm{m}} \mathrm{H}_{2 \mathrm{~m}-2} \underset{\mathrm{H}_2}{\stackrel{+\mathrm{Ni}}{\longrightarrow}} \mathrm{H}_2\end{array} \stackrel{+, 225}{\stackrel{+\mathrm{Br}_2}{\longrightarrow}} \underset{0,195}{\longrightarrow}\right| \begin{aligned} & \mathrm{m}_{\text {binh tãng }}^{3,84 \mathrm{~g}} \\ & \mathrm{Z}^{0,105}: 2 \text { hidrocacbon }\end{aligned}$
$\mathrm{Br}_2\left|\begin{array}{l}\mathrm{C}_{\mathrm{n}^{\prime}} \mathrm{H}_{2 \mathrm{n}^{\prime}}{ }^{\mathrm{a}} \\ \mathrm{C}_{\mathrm{m}} \mathrm{H}_{2 \mathrm{~m}-2}^{\mathrm{b}}\end{array} \rightarrow\right| \begin{aligned} & \mathrm{a}+\mathrm{b}=0,225-0,105 \\ & \mathrm{nBr}_2=\mathrm{a}+2 \mathrm{~b}=0,195\end{aligned} \rightarrow\left|\begin{array}{l}\mathrm{a}=0,045 \\ \mathrm{~b}=0,075\end{array} \stackrel{3,84 \mathrm{~g}}{\longrightarrow}\right| \begin{aligned} & 0,63 \mathrm{n}^{\prime}+(14 \mathrm{~m}-2) \cdot 0,075=3,84 \\ & 3 \mathrm{n}^{\prime}+5 \mathrm{~m}=19 \rightarrow \mathrm{n}^{\prime}=3 ; \mathrm{m}=2 \rightarrow \mathrm{C}_4 \mathrm{H}_8 ; \mathrm{C}_2 \mathrm{H}_2\end{aligned}$





