File word Đề thi vào 10 Chuyên Hóa Tiền Giang – Năm học 2023 – 2024
File word Đề thi vào 10 Chuyên Hóa Tiền Giang – Năm học 2023 – 2024



* Cho biết nguyên tử khối của các nguyên tố: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; S = 32; P = 31; Cl = 35,5; K= 39; Ca = 40; Mn = 55; Fe = 56; Cu = 64; Ba=137
Bài 1: (2,0 điểm)
1.1. Cho các đơn chất có công thức hóa học như sau: H, T và X2. Biết rằng:
– T là kim loại có màu trắng bạc, nóng chảy ở 660°C, được sản xuất bằng cách điện phân nóng chảy oxit của T với criolit.
– H là kim loại có tính nhiễm từ, dẫn điện tốt nhưng kém hơn T.
– X2 là chất khí màu vàng lục, được dùng để khử trùng nước sinh hoạt, tẩy trắng vải sợi, bột giấy,…
a) Xác định tên của H, T và X2.
b) Viết phương trình hóa học các phản ứng xảy ra trong các trường hợp:
– Cho H tác dụng với khí X2 ở nhiệt độ thích hợp.
– Cho T tác dụng với oxit của H ở nhiệt độ thích hợp (biết trong quặng hemantit, oxit của H chiếm thành phần chủ yếu).
– Cho T, X2 lần lượt tác dụng với dung dịch NaOH loãng ở điều kiện thường.
1.2. Hãy xác định các chất (A), (B), (C), (D) trong sơ đồ dưới đây và viết phương trình hóa học các phản ứng xảy ra (ghi rõ điều kiện phản ứng nếu có, mỗi mũi tên là một phương trình phản ứng).
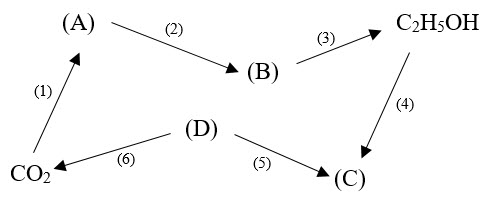
Biết: ở điều kiện thường, (D) là hiđrocacbon ở trạng thái khí có khối lượng mol lớn nhất.
Bài 2: (2,0 điểm)
2.1. Etyl axetat là chất lỏng không màu (D=0,89 g/ml), mùi thơm, ít tan trong nước, được dùng làm dung môi trong công nghiệp. Trong phòng thí nghiệm etyl axetat có thể được điều chế từ rượu etylic và axit axetic, có axit sunfuric đặc làm chất xúc tác. Tiến hành thí nghiệm theo các bước sau: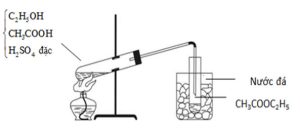
– Bước 1: Cho vào ống nghiệm khô khoảng 3 ml rượu etylic, 3 ml axit axetic nguyên chất, 1 ml axit sunfuric đặc và một ít đá bọt, lắc đều.
– Bước 2: Lắp ráp thí nghiệm như mô hình bên. Dùng đèn cồn đun nóng nhẹ ống nghiệm đựng hóa chất khoảng 7-10 phút (không được đun sôi).
– Bước 3: Lấy ống nghiệm ngâm trong cốc nước đá ra, cho thêm vào ống nghiệm một ít nước cất.
a) Viết phương trình hóa học phản ứng điều chế etyl axetat và nêu vai trò của đá bọt, cốc nước đá trong thí nghiệm trên.
b) Nêu hiện tượng quan sát được sau khi thực hiện bước 3.
c) Hãy giải thích tại sao khi kết thúc thí nghiệm, cần tháo ống dẫn hơi etyl axetat trước khi tắt đèn cồn.
2.2. Để đảm bảo năng suất lúa vụ hè thu tại huyện X, với mỗi hecta (1 hecta = 10.000 m2) đất trồng lúa, người nông dân cần cung cấp 70 kg N; 35,5 kg P2O5 và 30 kg K2O. Loại phân mà người nông dân sử dụng là phân hỗn hợp NPK (20-20-15) trộn với phân kali (độ dinh dưỡng 60%) và phân urê (độ dinh dưỡng 46%).
a) Hãy cho biết ý nghĩa của dãy số 20-20-15.
b) Biết tại huyện X, giá thành mỗi kg phân hỗn hợp NPK (20-20-15), phân kali, phân ure trên lần lượt là 18000 VNĐ, 28000 VNĐ và 8000 VNĐ. Tính tổng số tiền (VNĐ) mà người nông dân cần mua phân để bón cho 10 hecta đất trồng lúa nói trên.
Bài 3: (2,0 điểm)
3.1. Từ a gam kali permanganat (KMnO4), người ta có thể điều chế khi oxi và khí clo trong phòng thí nghiệm như sau:
– Nhiệt phân 0,5a gam KMnO4 thu được b gam chất rắn (P) và n1 mol khí oxi;
– Hòa tan hoàn toàn 0,5a gam KMnO4 trong dung dịch HCl đặc, dư thu được n2 mol khí clo.
a) Viết phương trình hóa học các phản ứng xảy ra.
b) Tính $\frac{{{n}_{1}}}{{{n}_{2}}}$ theo a và b.
c) Cho a = 15,8 gam và n1 =0,02 mol. Xác định các chất có mặt trong (P) và tính hiệu suất phản ứng nhiệt phân.
3.2. Hòa tan hoàn toàn 38,4 gam hỗn hợp A gồm FeO, Fe2O3, Fe3O4 trong dung dịch H2SO4 85% đun nóng, thu được dung dịch B chỉ chứa một chất tan và 0,1 mol khí SO2 (sản phẩm khử duy nhất của H2SO4). Làm lạnh dung dịch B về 20°C, thu được dung dịch bão hòa và có m gam muối Fe2(SO4)3.9H2O kết tinh. Biết độ tan của Fe2(SO4)3 ở 20°C là 440 gam.
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính khối lượng dung dịch sau phản ứng và giá trị của m.
Bài 4: (2,0 điểm)
4.1. Đem khử hoàn toàn 3,12 gam hỗn hợp CuO và FexOy bằng khí CO ở nhiệt độ cao, thu được 2,32 gam chất rắn. Hòa tan hết chất rắn này trong dung dịch H2SO4 loãng dư thoát ra 0,03 mol khí.
a) Viết phương trình hóa học các phản ứng xảy ra.
b) Tính phần trăm về khối lượng mỗi oxit trong hỗn hợp đầu.
c) Xác định công thức của oxit sắt.
——————— hết ———————





