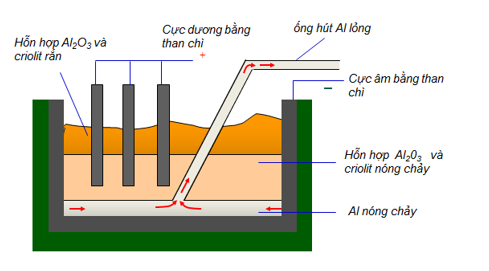
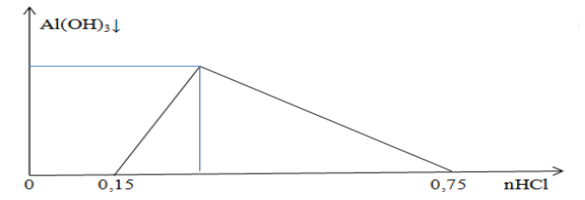
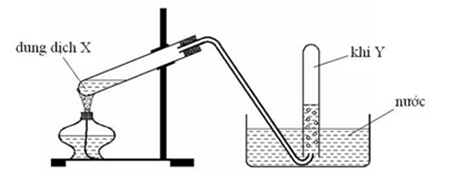
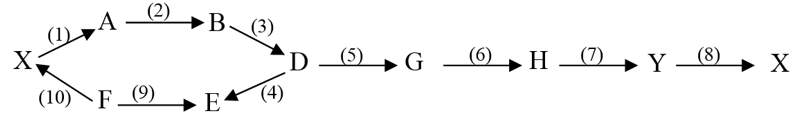File word Đề thi vào 10 Chuyên Hóa Tỉnh Lạng Sơn – Năm học 2023 – 2024
File word Đề thi vào 10 Chuyên Hóa Tỉnh Lạng Sơn – Năm học 2023 – 2024
Học sinh làm cả phần trắc nghiệm và tự luận vào tờ giấy thi, ghi rõ mã đề thi vào bên cạnh từ Bài làm trên tờ giấy thi.
Cho biết nguyên tử khối của các nguyên tố: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24: P-31; Cl 35,5; K = 39; Fe=56; Cu 64; Ag= 108; 1= 127.
Câu 1: Trắc nghiệm (2,5 điểm, mỗi ý 0,5 điểm)
1. Polime nào sau đây không phải polime thiên nhiên?
Tinh bột. B. Poli(vinyl clorua). C. Xenlulozơ. D. Protein.
2. Kim loại nào sau đây không tác dụng được với dung dịch HCl?
Zn. B. Fe. C.Ag. D. Mg.
3. Chọn đúng (Đ) hoặc sai (S) cho các kết luận sau:
a) Protein có phân tử khối rất lớn được tạo ra từ các amino axit.
b) NH4NO3 là một loại phân đạm.
4. Có 4 ống nghiệm được kí hiệu là X, Y, Z, T chứa các dung dịch riêng biệt: BaCl2, Na2CO3, MgCl2, H2SO4, không theo thứ tự. Cho các dung dịch trên phản ứng với nhau từng đôi một, thu được kết quả như sau:
+ Dung dịch X tác dụng với dung dịch Y thấy xuất hiện kết tủa.
+ Dung dịch Y tác dụng với dung dịch Z thấy xuất hiện kết tủa, dung dịch Y tác dụng với dung dịch T thấy có khí thoát ra.
+ Dung dịch T tác dụng với dung dịch Z thấy xuất hiện kết tủa.
Dung dịch T là
A. H2SO4. B. MgCl2. C. Na2CO3. D. BaCl2.
Thí sinh điền đáp án đúng vào chỗ trống trong ý 5 dưới đây (chỉ cần ghi đáp án, không cần trình bày các bước giải trong bài làm):
5. E211 là hợp chất hữu cơ (chỉ chứa các nguyên tố C, H, O, Na trong phân tử) có khả năng ngăn ngừa sự phát triển của nấm mốc nên được sử dụng làm chất bảo quản thực phẩm. Kết quả phân tích nguyên tố của E211 như sau:
| Nguyên tố | C | H | Na |
| % theo khối lượng | 58,333 | 3,472 | 15,972 |
Biết phân tử khối của E211 là 144, công thức phân tử của E211 là
Câu 2 (1,5 điểm)
Giải thích các cách làm sau (viết phương trình hóa học của phản ứng xảy ra, nếu có):
a) Ở nhiều làng nghề Việt Nam, người dân thường đốt lưu huỳnh để xông hơi các sản phẩm làm từ mây tre.
b) Khi lên men rượu từ glucozơ thì cần ủ kín còn lên men giấm từ rượu etylic lại cần để thoảng khi.
Cho sơ đồ các phản ứng sau (theo đúng tỉ lệ mol):
(1) E+ NaOH → X + Y + H2O
(2) M + 5/2O2→ 2Z + H2O
(3) X+HCI → Z + NaCl
(4) T+ NaOH→ X+Q
Biết Y là chất vô cơ; E, M, X, Z, T, Q đều là các hợp chất hữu cơ no, mạch hở. E có công thức phân tử là C3H7O2N. Q và Z có cùng số nguyên tử cacbon trong phân tử. Xác định các chất E, M, X, Y. Z. T. Q. Viết các phương trình hoá học hoàn thành sơ đồ trên và gọi tên các chất E, T.
Câu 3 (1,0 điểm)
1. Viết phương trình hoá học xảy ra trong trường hợp sau:
a) Trong công nghiệp, khí clo được điều chế bằng phương pháp điện phân dung dịch NaCl bão hòa có màng ngăn xốp, sau đó khí clo được dẫn qua dung dịch H2SO4 98% rồi hóa lỏng để làm nguyên liệu quan trọng cho nhiều ngành công nghiệp chế biến và sản xuất hóa chất.
b) Cho biết vai trò của H2SO4 98% trong quá trình trên. Có thể dùng NaOH rắn khan để thay thế H2SO4
98% được không? Giải thích.
lot là nguyên tố vi lượng thiết yếu đối với sự phát triển của con người. Thiếu iot làm não bị hư hại thiểu năng trí tuệ, gây bướu có, giảm khả năng lao động và hàng loạt rối loạn khác, đặc biệt nguy hiểm đối với bà mẹ và trẻ em. Những rồi loạn do thiếu iot hoàn toàn có thể phòng tránh nếu được bổ sung muối iot hàng ngày. Muối iot là muối ăn có trộn thêm một lượng nhỏ hợp chất của iot (thường là KI hoặc KIO3). Lượng iot cần thiết cho một người trưởng thành từ 0,066 mg – 0,11 mg/ngày. Nếu một người sử dụng loại muối có hàm lượng iot là 12 mg/500 gam muối thì khối lượng muối người đó cần dùng để đáp ứng đủ lượng iot cần thiết trong một ngày là bao nhiêu gam?
Câu 4 (1,5 điểm)
1. a) Silic là một nguyên tố phổ biến và có nhiều ứng dụng trong cuộc sống. Silic siêu tinh khiết là chất bán dẫn, được dùng trong kĩ thuật vô tuyến và điện từ. Nguyên tố này còn được sử dụng để chế tạo pin mặt trời nhằm mục đích chuyển đổi năng lượng ánh sáng thành năng lượng điện cung cấp cho các thiệt bị trên tàu vũ trụ. Silic có cấu tạo nguyên tử như sau: điện tích hạt nhân là 14+, có 3 lớp electron, lớp ngoài có 4 electron. Xác định vị trí của silic trong bảng tuần hoàn
b) Trong tự nhiên, silic chi tồn tại ở dạng hợp chất, chủ yếu là SiO2 (cát). Viết các phương trình hoá học hoàn thành sơ đồ phản ứng sau:
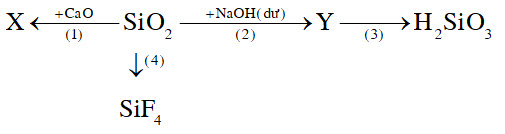
Axit photphoric (H3PO4) tác dụng với dung dịch KOH có thể tạo ra các muối KH2PO4, K2HPO4, K3PO4. được dung dịch X chứa 6,92 gam chất tan. Xác định giá trị của a và viết phương trình hoá học xảy ra.
Câu 5 (1,0 điểm)
Cho m gam hỗn hợp bột X gồm Mg và Fe (tỉ lệ mol 1:1) vào dung dịch Y chứa AgNO3 1,0M và Cu(NO3)2 0,5M. Sau khi các phản ứng kết thúc thu được dung dịch Z và 106,4 gam chất rắn T gồm ba kim loại. Cho T vào dung dịch HCl loãng dư, sau phản ứng thu được 8,96 lít khí H2 (dktc) và chất rắn Q.
a) Xác định khối lượng mỗi kim loại trong m gam hỗn hợp X.
b) Hoà tan hết Q vào dung dịch HNO3 loãng, dư thu được V lít khí NO (sản phẩm khử duy nhất ở đktc)
Viết các phương trình hoa học xảy ra và xác định giá trị của V.
Câu 6 (1,0 điểm)
1. Chỉ dùng dung dịch NaOH hãy trình bày cách nhận biết hai chất lỏng riêng biệt: dầu ăn (thành phần chính là chất béo) với dầu mỡ dùng bôi trơn máy (thành phần chính là các hidrocacbon). Viết phương trình hóa học xảy ra (nếu có).
a) Để nâng nhiệt độ của 1 gam nước lên 1°C cần cung cấp nhiệt lượng là 4,18 J. Tính nhiệt lượng cần cung cấp đủ để làm nóng 1 lít nước (khối lượng riêng D-1 g/cm3) từ 30 °C lên 100°C.
b) Bếp biogas được sử dụng rộng rãi trong các hộ chăn nuôi. Loại bếp này tận dụng quá trình phân hủy của các chất thải chăn nuôi sinh ra khí (chủ yếu là metan) dùng làm nhiên liệu đốt, qua đó giúp giảm chi phí năng lượng và bảo vệ môi trường. Khi 1 mol metan cháy hoàn toàn sẽ tỏa ra lượng nhiệt là 890 KJ. Viết phương trình hoá học xảy ra và tính thể tích khí metan (đktc) cần đốt cháy để cung cấp đủ nhiệt lượng đun sôi 1 lít nước ở trên, giả thiết hiệu suất sử dụng nhiệt đạt 60%.
Câu 7 (1,5 điểm)
Một học sinh tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho 2 ml dung dịch saccarozơ 1% vào ống nghiệm sạch, thêm tiếp 1 giọt dung dịch H2SO4 loãng, đun nóng ống nghiệm 2-3 phút.
Bước 2: Thêm dung dịch NaOH để trung hoà axit.
Bước 3: Cho dung dịch thu được sau bước 2 vào ống nghiệm chứa dung dịch AgNO3 trong NH3
Viết các phương trình hoá học và nêu hiện tượng xảy ra trong quá trình thí nghiệm.
2. X là một ancol được dùng làm chất giữ ẩm, dưỡng da trong một số loại mĩ phẩm. X có công thức tổng quát là CxHy(OH)n. Trong phân tử X, mỗi nguyên tử cacbon chỉ liên kết tối đa với một nhóm OH. Hoá hơi hoàn toàn 4,6 gam chất X thì thu được thể tích hơi đúng bằng thể tích của 1,6 gam oxi trong cùng điều kiện. Mặt khác, cho m gam X vào bình chứa Na (dư), sau phản ứng thấy có 10,08 lít (đktc) khí H2 thoát ra và khối lượng bình chứa Na tăng 26,7 gam so với ban đầu.
a) Viết phương trình hoá học xảy ra, xác định công thức cấu tạo của ancol X.
b) Cho ancol X tham gia phản ứng este hoá với CH3COOH (H2SO4 đặc, t0), sau phản ứng thu được tối da bao nhiêu sản phẩm chứa nhóm -COO- trong phân tử. Viết công thức cấu tạo của các sản phẩm đó.
———————–HẾT——————————
| SỞ GIÁO DỤC VÀ ĐÀO TẠO
LẠNG SƠN
(Đề thi có 02 trang) |
KỲ THI TUYỂN SINH VÀO LỚP 10 NĂM HỌC 2023
Môn: Hóa học (Chuyên) Thời gian làm bài: 150 phút (không kể thời gian giao đề) |
Học sinh làm cả phần trắc nghiệm và tự luận vào tờ giấy thi, ghi rõ mã đề thi vào bên cạnh từ Bài làm trên tờ giấy thi.
Cho biết nguyên tử khối của các nguyên tố: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24: P-31; Cl 35,5; K = 39; Fe=56; Cu 64; Ag= 108; 1= 127.
Câu 1: Trắc nghiệm (2,5 điểm, mỗi ý 0,5 điểm)
1. Polime nào sau đây không phải polime thiên nhiên?
Tinh bột. B. Poli(vinyl clorua). C. Xenlulozơ. D. Protein.
2. Kim loại nào sau đây không tác dụng được với dung dịch HCl?
Zn. B. Fe. C.Ag. D. Mg.
3. Chọn đúng (Đ) hoặc sai (S) cho các kết luận sau:
a) Protein có phân tử khối rất lớn được tạo ra từ các amino axit S
b) NH4NO3 là một loại phân đạm. Đ
4. Có 4 ống nghiệm được kí hiệu là X, Y, Z, T chứa các dung dịch riêng biệt: BaCl2, Na2CO3, MgCl2, H2SO4, không theo thứ tự. Cho các dung dịch trên phản ứng với nhau từng đôi một, thu được kết quả như sau:
+ Dung dịch X tác dụng với dung dịch Y thấy xuất hiện kết tủa.
+ Dung dịch Y tác dụng với dung dịch Z thấy xuất hiện kết tủa, dung dịch Y tác dụng với dung dịch T thấy có khí thoát ra.
+ Dung dịch T tác dụng với dung dịch Z thấy xuất hiện kết tủa.
Dung dịch T là
A. H2SO4. B. MgCl2. C. Na2CO3. D. BaCl2.
Thí sinh điền đáp án đúng vào chỗ trống trong ý 5 dưới đây (chỉ cần ghi đáp án, không cần trình bày các bước giải trong bài làm):
5. E211 là hợp chất hữu cơ (chỉ chứa các nguyên tố C, H, O, Na trong phân tử) có khả năng ngăn ngừa sự phát triển của nấm mốc nên được sử dụng làm chất bảo quản thực phẩm. Kết quả phân tích nguyên tố của E211 như sau:
| Nguyên tố | C | H | Na |
| % theo khối lượng | 58,333 | 3,472 | 15,972 |
Biết phân tử khối của E211 là 144, công thức phân tử của E211 là C7H5O2Na
Câu 2 (1,5 điểm)
Giải thích các cách làm sau (viết phương trình hóa học của phản ứng xảy ra, nếu có):
a) Ở nhiều làng nghề Việt Nam, người dân thường đốt lưu huỳnh để xông hơi các sản phẩm làm từ mây tre.
b) Khi lên men rượu từ glucozơ thì cần ủ kín còn lên men giấm từ rượu etylic lại cần để thoảng khi.
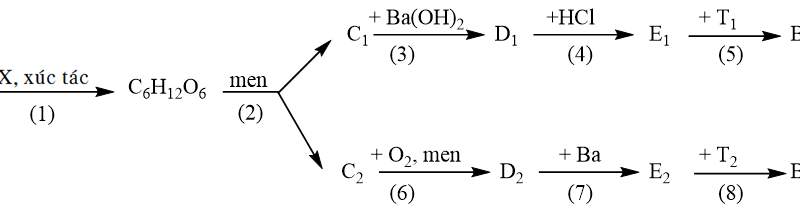
Cho sơ đồ các phản ứng sau (theo đúng tỉ lệ mol):
(1) E+ NaOH → X + Y + H2O
(2) M + 5/2O2→ 2Z + H2O
(3) X + HCI → Z + NaCl
(4) T+ NaOH→ X+Q
Biết Y là chất vô cơ; E, M, X, Z, T, Q đều là các hợp chất hữu cơ no, mạch hở. E có công thức phân tử là C2H7O2N. Q và Z có cùng số nguyên tử cacbon trong phân tử. Xác định các chất E, M, X, Y. Z. T. Q. Viết các phương trình hoá học hoàn thành sơ đồ trên và gọi tên các chất E, T.
Hướng dẫn giải
1.
a) Khi đốt S thì sinh ra khí sunfurơ (lưu huỳnh đioxit), khí này có tác dụng diệt nấm mốc, do vậy ở nhiều làng nghề Việt Nam, người dân thường đốt lưu huỳnh để xông hơi các sản phẩm làm từ mây tre để diệt nấm mốc chống mối mọt cho sản phẩm
$S\,+{{O}_{2}}\xrightarrow{{{t}^{0}}}S{{O}_{2}}$
b) – Quá trình lên men rượu không cần oxi và nếu không ủ kín hì rượu sinh ra có thể bị chuyển tiếp thành axit axetic, do vậy quá trình lên men rượu cần ủ kín
${{C}_{6}}{{H}_{12}}{{O}_{6}}\xrightarrow{men\,\,r\ddot{o}\hat{o}\ddot{i}u}2{{C}_{2}}{{H}_{5}}OH\,+2C{{O}_{2}}$
– Quá trình lên men giấm từ rượu etylic cần oxi, cần thoáng khí để tăng nồng độ oxi, làm tăng tốc độ phản ứng
${{C}_{2}}{{H}_{5}}OH+{{O}_{2}}\xrightarrow{men\,\,gia\acute{a}m}C{{H}_{3}}COOH\,+\,{{H}_{2}}O$
$(1)\,C{{H}_{3}}COON{{H}_{4}}+NaOH\xrightarrow{{}}C{{H}_{3}}COONa\,+N{{H}_{3}}\uparrow +{{H}_{2}}O$
E X Y
$(2)\,C{{H}_{3}}C{{H}_{2}}C{{H}_{2}}C{{H}_{3}}\,\,+\,\frac{5}{2}{{O}_{2}}\xrightarrow{{}}2C{{H}_{3}}COOH+{{H}_{2}}O$
M Z
$(3)\,C{{H}_{3}}COONa+HCl\xrightarrow{{}}C{{H}_{3}}COOH\,+NaCl$
Z
$(4)\,C{{H}_{3}}COO{{C}_{2}}{{H}_{5}}+\,NaOH\xrightarrow{{{t}^{0}}}C{{H}_{3}}COONa\,+{{C}_{2}}{{H}_{5}}OH$
T X Q
E: amoni axetat T: etyl axetat
Câu 3 (1,0 điểm)
1. Viết phương trình hoá học xảy ra trong trường hợp sau:
a) Trong công nghiệp, khí clo được điều chế bằng phương pháp điện phân dung dịch NaCl bão hòa có màng ngăn xốp, sau đó khí clo được dẫn qua dung dịch H2SO4 98% rồi hóa lỏng để làm nguyên liệu quan trọng cho nhiều ngành công nghiệp chế biến và sản xuất hóa chất.
b) Cho biết vai trò của H2SO4 98% trong quá trình trên. Có thể dùng NaOH rắn khan để thay thế H2SO4
98% được không? Giải thích.
lot là nguyên tố vi lượng thiết yếu đối với sự phát triển của con người. Thiếu iot làm não bị hư hại thiểu năng trí tuệ, gây bướu có, giảm khả năng lao động và hàng loạt rối loạn khác, đặc biệt nguy hiểm đối với bà mẹ và trẻ em. Những rồi loạn do thiếu iot hoàn toàn có thể phòng tránh nếu được bổ sung muối iot hàng ngày . Muối iot là muối ăn có trộn thêm một lượng nhỏ hợp chất của iot (thường là KI hoặc KIO3). Lượng iot cần thiết cho một người trưởng thành từ 0,066 mg – 0,11 mg/ngày. Nếu một người sử dụng loại muối có hàm lượng iot là 12 mg/500 gam muối thì khối lượng muối người đó cần dùng để đáp ứng đủ lượng iot cần thiết trong một ngày là bao nhiêu gam?
Hướng dẫn giải
a) $2NaCl\,+2{{H}_{2}}O\xrightarrow[co\grave{u}\,\,mang\,\,nga\hat{e}n]{\tilde{n}ie\ddot{a}n\,\,pha\hat{a}n\,\,dung\,\,d\grave{o}ch}2NaOH\,\,+C{{l}_{2}}+2{{H}_{2}}$
b) – Vai trò của H2SO4 98% là làm khô khí clo.
– Không dùng NaOH khan để thay thế H2SO4 98% vì NaOH khan khi gặp Cl2 ẩm thì NaOH tan tạo thành dung dịch NaOH và Cl2 sẽ phản ứng với dung dịch NaOH
$C{{l}_{2}}+2NaOH\xrightarrow{{}}NaCl\,+NaClO+{{H}_{2}}O$
| Cứ 500 gam muối có chứa 12 mg iot
Vậy x gam muối có chứa 0,066 mg iot $\Rightarrow $x = 2,750 gam |
Cứ 500 gam muối có chứa 12 mg iot
Vậy y gam muối có chứa 0,11 mg iot $\Rightarrow $y = 4,583 gam |
| Người đó cấn dùng 2,75 gam – 4,583 gam muối chứa hàm lượng iot 12mg/500 gam muối để đáp ứng đủ lượng iot cần thiết trong một ngày | |
Câu 4 (1,5 điểm)
1. a) Silic là một nguyên tố phổ biến và có nhiều ứng dụng trong cuộc sống. Silic siêu tinh khiết là chất bán dẫn, được dùng trong kĩ thuật vô tuyến và điện từ. Nguyên tố này còn được sử dụng để chế tạo pin mặt trời nhằm mục đích chuyển đổi năng lượng ánh sáng thành năng lượng điện cung cấp cho các thiệt bị trên tàu vũ trụ. Silic có cấu tạo nguyên tử như sau: điện tích hạt nhân là 14+, có 3 lớp electron, lớp ngoài có 4 electron. Xác định vị trí của silic trong bảng tuần hoàn
b) Trong tự nhiên, silic chi tồn tại ở dạng hợp chất, chủ yếu là SiO2 (cát). Viết các phương trình hoá học hoàn thành sơ đồ phản ứng sau:
$\begin{align}
& X\xleftarrow[(1)]{+CaO}Si{{O}_{2}}\xrightarrow[(2)]{+NaOH(d\ddot{o})}Y\xrightarrow[(3)]{}{{H}_{2}}Si{{O}_{3}} \\
& \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{{\downarrow }^{(4)}} \\
& \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,Si{{F}_{4}} \\
\end{align}$
Axit photphoric (H3PO4) tác dụng với dung dịch KOH có thể tạo ra các muối KH2PO4, K2HPO4, K3PO4. Cho 300 ml dung dịch H3PO4 0,1M vào 500ml dung dịch KOH aM, sau khi các phản ứng kết thúc thu được dung dịch X chứa 6,92 gam chất tan. Xác định giá trị của a và viết phương trình hoá học xảy ra.
Hướng dẫn giải
1.
a) Silic có điện tích là 14+ $\Rightarrow $silic có 14 proton $\Rightarrow $silic ở ô số 14 trong bảng tuần hoàn
Silic có 3 lớp e $\Rightarrow $silic ở chu kì 3
Silic có 4 e lớp ngoài cùng $\Rightarrow $silic ở nhóm IVA
b)
$(1)\,\,CaO\,+Si{{O}_{2}}\xrightarrow{{}}CaSi{{O}_{3}}$
$(2)\,\,Si{{O}_{2}}+2NaOH\xrightarrow{{}}N{{a}_{2}}Si{{O}_{3}}$
$(3)\,\,N{{a}_{2}}Si{{O}_{3}}+C{{O}_{2}}+{{H}_{2}}O\xrightarrow{{}}NaHC{{O}_{3}}+{{H}_{2}}Si{{O}_{3}}$
$(4)\,\,Si{{O}_{2}}+4HF\xrightarrow{{}}Si{{F}_{4}}+2{{H}_{2}}O$
${{n}_{{{H}_{3}}P{{O}_{4}}}}=0,3.0,1=\,\,0,03\,mol$; ${{n}_{KOH}}=\,\,0,5a\,mol$
– Trường hợp 1: Dung dịch X chứa KOH dư và K3PO4
3KOH + H3PO4“K3PO4 + H2O
0,09 0,03 0,03 mol
Theo bài ta có : 56(0,5a -0,09) + 0,03. 212 = 6,92 $\Rightarrow $ a = 0,2M
– Trường hợp 2: Dung dịch chứa H3PO4 dư và KH2PO4
KOH + H3PO4“KH2PO4 + H2O
0,5a 0,5a 0,5a mol
Theo bài ta có: 0,5a.136 + (0,03 -0,5a).98 = 6,92 $\Rightarrow $ a = 0,2095M$\Rightarrow $0,5a> 0,03 (loại)
– Trường hợp 3: Tạo hai loại muối (K2HPO4 và KH2PO4 hoặc K3PO4 và K2HPO4)
xKOH + H3PO4” KxH3-xPO4 + xH2O (1<x<3)
0,5a 0,03 0,5a mol
Bảo toàn khối lượng ta có: 0,5a.56 + 0,03.98 = 6,92 + 0,5a.18 $\Rightarrow $ a = 0,2095M $\Rightarrow $x = 3,492 (loại)
Câu 5 (1,0 điểm)
Cho m gam hỗn hợp bột X gồm Mg và Fe (tỉ lệ mol 1:1) vào dung dịch Y chứa AgNO3 1,0M và Cu(NO3)2 0,5M. Sau khi các phản ứng kết thúc thu được dung dịch Z và 106,4 gam chất rắn T gồm ba kim loại. Cho T vào dung dịch HCl loãng dư, sau phản ứng thu được 8,96 lít khí H2 (dktc) và chất rắn Q.
a) Xác định khối lượng mỗi kim loại trong m gam hỗn hợp X.
b) Hoà tan hết Q vào dung dịch HNO3 loãng, dư thu được V lít khí NO (sản phẩm khử duy nhất ở đktc)
Viết các phương trình hoa học xảy ra và xác định giá trị của V.
Hướng dẫn giải
a) ${{n}_{{{H}_{2}}}}=\,\frac{8,96}{22,4}=\,0,4\,mol$
T gồm 3 kim loại: Fe dư, Ag, Cu
Fe + 2HCl”FeCl2 +H2
0,4 0,4 mol
$\Rightarrow $ ${{m}_{Ag}}+{{m}_{Cu}}=106,4-0,4.56=84\,gam$
Gọi V là thể tích dung dịch Y$\Rightarrow $${{n}_{AgN{{O}_{3}}}}=V.1\,mol;\,\,{{n}_{Cu{{(N{{O}_{3}})}_{2}}}}=0,5V\,mol$
Bảo toàn mol Ag và Cu ta có ${{n}_{Ag}}=V.1\,mol;\,\,{{n}_{Cu}}=0,5V\,mol$$\Rightarrow $108.V + 0,5V.64 =84 $\Rightarrow $ V = 0,6 lít
Bảo toàn mol (-NO3) ta có ${{n}_{(-N{{O}_{3}})}}=\,{{n}_{AgN{{O}_{3}}}}+2{{n}_{Cu{{(N{{O}_{3}})}_{2}}}}=1,2\,mol$
Dung dịch Z chứa Mg(NO3)2, Fe(NO3)2Gọi số mol Mg là x mol, bảo toàn Mg $\Rightarrow $${{n}_{Mg{{(N{{O}_{3}})}_{2}}}}=\,x\,\,mol\,$
$\,\Rightarrow {{n}_{(-N{{O}_{3}})/Fe{{(N{{O}_{3}})}_{2}}}}=\,(1,2\,-2x)\Rightarrow {{n}_{Fe{{(N{{O}_{3}})}_{2}}}}=\,(0,6\,-x)\,mol={{n}_{Fe/Fe{{(N{{O}_{3}})}_{2}}}}$
Bảo toàn khối lượng: ${{m}_{X}}+{{m}_{Ag/AgN{{O}_{3}}}}+\,{{m}_{Cu/Cu{{(N{{O}_{3}})}_{2}}}}={{m}_{Mg/Mg{{(N{{O}_{3}})}_{2}}}}+{{m}_{Fe/Fe{{(N{{O}_{3}})}_{2}}}}+{{m}_{T}}$
$\Rightarrow $ x.24 + x.56 + 0,6.108+ 0,5.0,6.64 = x.24 + (0,6-x).56 + 106,4 $\Rightarrow $ x = 0,5 mol
$\Rightarrow $ ${{m}_{Mg}}=0,5.24=12\,gam;\,\,{{m}_{Fe}}=0,5.56=28\,gam$
b) Chất rắn Q gồm Ag: 0,6 mol; Cu: 0,3 mol
3Cu +8HNO3 loãng ” 3Cu(NO3)2 +2NO +4H2O
0,3 0,2 mol
3Ag +4 HNO3 loãng ” 3AgNO3 + NO + 2H2O
0,6 0,2 mol
${{V}_{NO}}=(0,2+0,2).22,4\,=8,96\,l\acute{i}t$
Câu 6 (1,0 điểm)
1. Chỉ dùng dung dịch NaOH hãy trình bày cách nhận biết hai chất lỏng riêng biệt: dầu ăn (thành phần chính là chất béo) với dầu mỡ dùng bôi trơn máy (thành phần chính là các hiđrocacbon). Viết phương trình hóa học xảy ra (nếu có).
a) Để nâng nhiệt độ của 1 gam nước lên 1°C cần cung cấp nhiệt lượng là 4,18 J. Tính nhiệt lượng cần cung cấp đủ để làm nóng 1 lít nước (khối lượng riêng D-1 g/cm3) từ 30 °C lên 100°C.
b) Bếp biogas được sử dụng rộng rãi trong các hộ chăn nuôi. Loại bếp này tận dụng quá trình phân hủy của các chất thải chăn nuôi sinh ra khí (chủ yếu là metan) dùng làm nhiên liệu đốt, qua đó giúp giảm chi phí năng lượng và bảo vệ môi trường. Khi 1 mol metan cháy hoàn toàn sẽ tỏa ra lượng nhiệt là 890 KJ. Viết phương trình hoá học xảy ra và tính thể tích khí metan (đktc) cần đốt cháy để cung cấp đủ nhiệt lượng đun sôi 1 lít nước ở trên, giả thiết hiệu suất sử dụng nhiệt đạt 60%.
Hướng dẫn giải
– Lấy 1-2 ml chất lỏng cho vào chén sứ. Tiếp đó cho khoảng 60 ml NaOH (40%) vào mỗi chén sứ.
– Đun nhẹ đến sôi chất lỏng trong mỗi chén sứ. Thấy chén sứ nào có chất màu trắng (xà phòng) tạo ra thì chất ban đầu là dầu ăn. Chén còn lại tách lớp và không có hiện tượng như trên thì chứa dầu bôi trơn máy
(RCOO)3C3H5 + 3NaOH”3RCOONa + C3H5(OH)3
Xà phòng
2.
a) $Q=mc(t_{2}^{0}-t_{1}^{0})$=1.1000.4,18.(100-30) = 292600 J = 292,6 KJ
b) CH4 +2O2 ” CO2 + 2H2O
Lượng nhiệt cần có để đun sôi 1 lít nước là 292,6: 0,6 = 487,667 KJ
Cứ 1 mol CH4 cháy hoàn toàn toả ra lượng nhiệt là 890 KJ
Vậy x mol CH4 cháy hoàn toàn toả ra lượng nhiệt là 487,667 KJ
$\Rightarrow $ x = 0,5479 mol $\Rightarrow $ $V{{ & }_{C{{H}_{4}}}}=0,5479.22,4=12,274\,\,l\acute{i}t$
Câu 7 (1,5 điểm)
Một học sinh tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho 2 ml dung dịch saccarozơ 1% vào ống nghiệm sạch, thêm tiếp 1 giọt dung dịch H2SO4 loãng, đun nóng ống nghiệm 2-3 phút.
Bước 2: Thêm dung dịch NaOH để trung hoà axit.
Bước 3: Cho dung dịch thu được sau bước 2 vào ống nghiệm chứa dung dịch AgNO3 trong NH3
Viết các phương trình hoá học và nêu hiện tượng xảy ra trong quá trình thí nghiệm.
2. X là một ancol được dùng làm chất giữ ẩm, dưỡng da trong một số loại mĩ phẩm. X có công thức tổng quát là CxHy(OH)n. Trong phân tử X, mỗi nguyên tử cacbon chỉ liên kết tối đa với một nhóm OH. Hoá hơi hoàn toàn 4,6 gam chất X thì thu được thể tích hơi đúng bằng thể tích của 1,6 gam oxi trong cùng điều kiện. Mặt khác, cho m gam X vào bình chứa Na (dư), sau phản ứng thấy có 10,08 lít (đktc) khí H2 thoát ra và khối lượng bình chứa Na tăng 26,7 gam so với ban đầu.
a) Viết phương trình hoá học xảy ra, xác định công thức cấu tạo của ancol X.
b) Cho ancol X tham gia phản ứng este hoá với CH3COOH (H2SO4 đặc, t0), sau phản ứng thu được tối da bao nhiêu sản phẩm chứa nhóm -COO- trong phân tử. Viết công thức cấu tạo của các sản phẩm đó.
Hướng dẫn giải
– Hiện tượng: Có lớp bạc bám trên thành ống nghiệm
– PTHH: C12H22O11 + H2O $\xrightarrow[{{t}^{0}}]{{{H}_{2}}S{{O}_{4}}\,\,loa\tilde{o}ng}$C6H12O6 +C6H12O6
H2SO4 + 2NaOH “Na2SO4 +2H2O
C6H12O6 + Ag2O $\xrightarrow{N{{H}_{3}}}$ C6H12O7 + 2Ag$
(Hoặc: C6H12O6 + 2AgNO3 + 3NH3“C5H11O5COONH4 +2Ag$+2NH4NO3)
${{M}_{X}}=\frac{4,6}{1,6}.32=\,92\,g/mol$; ${{n}_{H{{ & }_{2}}}}=\frac{10,08}{22,4}=\,0,45\,mol$
${{m}_{b\grave{i}nh\,\,Na\,\operatorname{t}a\hat{e}ng}}\,=\,{{m}_{X}}-{{m}_{{{H}_{2}}}}\Rightarrow {{m}_{X}}=26,7\,+\,0,45.2=\,27,6\,gam$$\Rightarrow $${{n}_{X}}=\frac{27,6}{92}=0,3\,mol$
${{C}_{X}}{{H}_{y}}{{(OH)}_{n}}+nNa\xrightarrow{{}}{{C}_{X}}{{H}_{y}}{{(ONa)}_{n}}+\frac{n}{2}{{H}_{2}}$
0,3 0,15n mol
$\Rightarrow $0,15n = 0,45 $\Rightarrow $n = 3$\Rightarrow $ 12x + y +17.3 = 92 $\Rightarrow $ 12x +y = 41
Với $x\ge n$$\Rightarrow $ x =3; y=5 $\Rightarrow $Công thức của X là C3H5(OH)3
Công thức cấu tạo của X là: $\begin{align}
& C{{H}_{2}}-CH-C{{H}_{2}} \\
& |\,\,\,\,\,\,\,\,\,\,\,\,\,\,|\,\,\,\,\,\,\,\,\,\,\,\,| \\
& OH\,\,\,\,\,\,OH\,\,\,\,\,\,OH \\
\end{align}$
b) X phản ứng với CH3COOH (H2SO4 đặc, t0) có thể thu được 5 sản phẩm có nhóm -COO-
$\begin{align}
& C{{H}_{3}}COO-C{{H}_{2}} \\
& \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,| \\
& \,\,\,\,\,\,\,\,\,\,\,\,\,HO-CH \\
& \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,| \\
& \,\,\,\,\,\,\,\,\,\,\,\,\,HO-C{{H}_{2}} \\
\end{align}$ $\begin{align}
& \,\,\,\,\,\,\,\,\,\,\,\,\,HO-C{{H}_{2}} \\
& \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,| \\
& C{{H}_{3}}COO-CH \\
& \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,| \\
& \,\,\,\,\,\,\,\,\,\,\,\,\,HO-C{{H}_{2}} \\
\end{align}$ $\begin{align}
& C{{H}_{3}}COO-C{{H}_{2}} \\
& \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,| \\
& C{{H}_{3}}COO-CH \\
& \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,| \\
& \,\,\,\,\,\,\,\,\,\,\,\,\,HO-C{{H}_{2}} \\
\end{align}$
$\begin{align}
& C{{H}_{3}}COO-C{{H}_{2}} \\
& \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,| \\
& \,\,\,\,\,\,\,\,\,\,\,\,HO-CH \\
& \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,| \\
& C{{H}_{3}}COO-C{{H}_{2}} \\
\end{align}$ $\begin{align}
& C{{H}_{3}}COO-C{{H}_{2}} \\
& \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,| \\
& C{{H}_{3}}COO-CH \\
& \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,| \\
& C{{H}_{3}}COO-C{{H}_{2}} \\
\end{align}$
———————–HẾT——————————