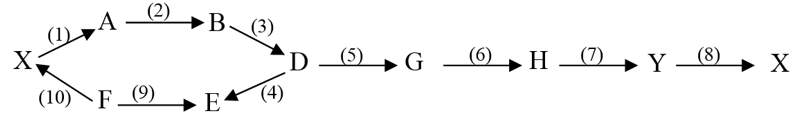File word Đề thi vào 10 Chuyên Hóa Tuyên Quang – Năm học 2023 – 2024
File word Đề thi vào 10 Chuyên Hóa Tuyên Quang – Năm học 2023 – 2024


∙ Cho biết nguyên tử khối của các nguyên tố: H = 1; C = 12; O = 16; Na = 23; Mg = 24; Al=27; P=31;S= 32; CI=35,5; K = 39; Ca= 40; Fe=56; Cu= 64; Ba = 137.
∙ Các thể tích khí đều đo ở điều kiện tiêu chuẩn, giả thiết các khi sinh ra không tan trong nước.
Câu 1 (2,0 điểm).
a) Nêu nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn các nguyên tố hoá học.
b) Nguyên tố X có số hiệu nguyên tử là 11, thuộc chu kỳ 3, nhóm I. Vẽ sơ đồ cấu tạo nguyên tử X, cho biết tính chất cơ bản của X và so sánh với các nguyên tố lân cận.
c) Y và Z là 2 nguyên tố thuộc cùng một nhóm A và ở 2 chu kì liên tiếp trong bảng tuần hoàn. Nguyên tử Y có 6e lớp ngoài cùng. Trong hợp chất khí của Y với hiđro, hiđro chiếm 11,1% khối lượng. Xác định 2 nguyên tố Y, Z.
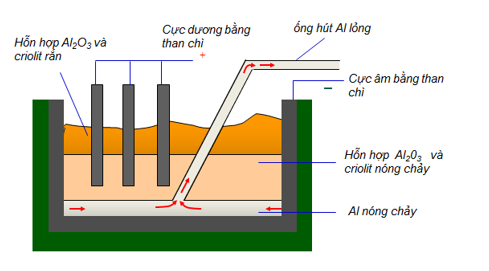
Câu 2 (2,0 điểm). Trong tự nhiên, sắt tồn tại ở dạng hợp chất, chủ yếu là các loại quặng sắt. Nước ta có nhiều quặng hematit (chứa Fe2O3) ở Thái Nguyên, Yên Bái, Hà Tĩnh,… Từ quặng hematit kết hợp với than cốc và chất phụ gia như đá vôi sẽ sản xuất được hợp kim quan trọng của sắt là gang. Quá trình luyện gang trong lò cao với 3 phản ứng chính:
– Phản ứng tạo chất khử CO;
– Phản ứng CO khử oxit sắt thành sắt;
– Phản ứng tạo thành xi.
a) Viết phương trình hoá học của các phản ứng trên.
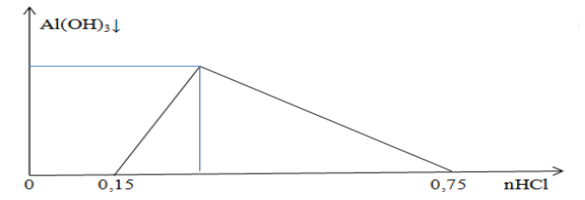
b) Sắt là nguyên tố hoá học cần thiết cho cơ thể con người, nhưng sử dụng nguồn nước bị nhiễm sắt lại gây hại cho cơ thể. Khi nguồn nước tự nhiên có hàm lượng sắt vượt quá tiêu chuẩn cho phép (nước sẽ có màu vàng và mùi tanh) sẽ cần phải xử lí để loại bỏ sắt. Một trong những cách loại sắt khỏi nước là dùng với tôi với lượng vừa đủ, sau đó cho tiếp xúc với không khí, kết tủa Fe(OH)3 tạo thành và được tách ra ở bể lắng. Giả sử trong nước, sắt chỉ có hai muối là FeSO4 và Fe2(SO4)3.
(i) Viết phương trình hoá học giải thích cách làm ở trên.
(ii) Một mẫu nước nhiễm phèn sắt với lượng sắt gấp 44,8 lần mức cho phép là 0,30 mg/L (QCVN 01 – 1:2018/BYT). Giả thiết hai muối sunfat có tỉ lệ số mol FeSO4 : số mol Fe2(SO4)3 = 8 : 1. Tính khối lượng vôi tôi ít nhất cần dùng xử lí 1 lít nước trên
c) Hợp chất X (chứa Fe và 2 nguyên tố hoá học khác) được sử dụng để phát triển công nghiệp chụp ảnh, trang trí thuỷ tinh, sơn, bột màu, sản xuất pin,… Tiến hành thí nghiệm với chất X theo sơ đồ sau:
Biết dung dịch G chỉ chứa một chất tan duy nhất, T là thành phần chính của đá vôi, phân tử khối của X<200 đvC, các phản ứng xảy ra hoàn toàn. Lập công thức hoá học của X.
Câu 3 (2,0 điểm). Phân bón hoá học là những hoá chất có chứa nguyên tố dinh dưỡng, được bón cho cây trồng nhằm nâng cao năng suất mùa màng. Các hoá chất là thành phần chính của phân có thể là KCl, NH4NO3, Ca(H2PO4)2, KNO3, (NH4)2HPO4.
3.1. Hãy sắp xếp các loại phân bón trên thành phân bón đơn và phân bón kép.
3.2. Ở nước ta hiện nay, trữ lượng quặng apatit, quặng photphorit rất lớn, tập trung nhiều ở các tỉnh như Lào Cai, Lạng Sơn, Nghệ An, Hà Tĩnh,… Với thành phần chính là Ca3(PO4)2, hai loại quặng trên là nguồn nguyên liệu quan trọng để sản xuất phân lân nung chảy và supephotphat.
- a) Để điều chế supephotphat đơn người ta tán nhỏ quặng apatit rồi cho tác dụng với H2SO4 đặc thu được hỗn hợp 2 muối là Ca(H2PO4)2 và CaSO4. Viết phương trình hoá học xảy ra.
- b) Trong sản xuất supephotphat đơn CaSO4 là sản phẩm cây trồng không hấp thụ được. Việc chuyển đổi CaSO4 thành các sản phẩm hữu ích hơn (CaCl2 và K2SO4) được thực hiện theo sơ đồ sau:
Điền thông tin thích hợp vào chỗ trống dưới đây:
(1) Ngoài CaSO4 và KCl, hoá chất được sử dụng trong quá trình này còn cần (điền công thức hoá học) và các nguyên liệu thô khác.
(2) Phản ứng xảy ra khi thêm dung dịch (NH4)2CO3 vào dung dịch huyền phù CaSO4 là .
3.3. Để tạo ra loại phân bón phù hợp với từng giai đoạn phát triển của cây trồng và từng loại cây trồng,… có thể trộn các loại phân bón hiện có trên thị trường. Nếu trong gia đình bạn có 5 kg phân DAP, 10 kg ure và 5 kg kali clorua thì có thể trộn được tối đa bao nhiêu kg phân NPK 15-15-15. Biết:
| Loại phân | Phân DAP | Ure | Kali clorua |
| Thành phần dinh dưỡng | Đạm (N) 18%; lân (P2O5) 46% | Đạm (N) 46,3% | Kali (K2O) 61% |
Câu 4 (2 điểm).
4.1. Đốt cháy hoàn toàn hiđrocacbon X. Hấp thụ toàn bộ sản phẩm cháy vào 300 mL dung dịch Ba(OH)2 1M thu được 39,4 gam kết tủa, khối lượng dung dịch sau phản ứng giảm 26,55 gam so với dung dịch Ba(OH)2 ban đầu. Lập công thức hoá học của X và tính khối lượng X đã đốt cháy.
4.2. Nhằm giảm tác động của biến đổi khí hậu, tăng cường sử dụng nguồn nhiên liệu tái tạo, hiện nay xăng sinh học E5 đã được sử dụng rộng rãi trên toàn quốc. Trong xăng sinh học E5, ancol etylic (hay etanol) chiếm 5% thể tích hỗn hợp, còn lại là xăng truyền thống.
a) Tính thể tích (mL) C2H5OH và xăng truyền thống có trong 1 lít xăng E5.
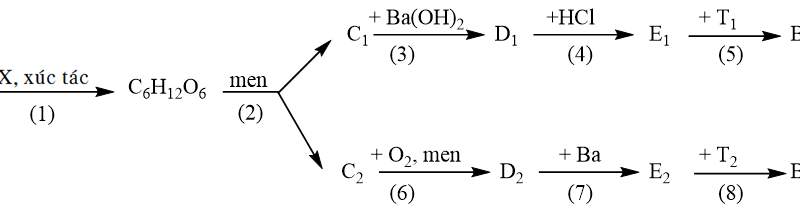
b) Thực vật hấp thụ CO2 từ khí quyển và chuyển hóa thành glucozơ (phản ứng 1), etanol sinh ra trong quá trình lên men glucozơ (phản ứng 2). Viết phương trình hoá học các phản ứng (1) và (2). Giải thích vì sao việc sử dụng xăng sinh học E5 làm giảm lượng cacbon dioxit.
c) Đốt cháy một mol etanol giải phóng 1367 kJ nhiệt lượng; đốt cháy một mol xăng truyền thống (quy đổi về C8H18) giải phóng 5450 kJ nhiệt lượng. Khối lượng riêng của etanol nguyên chất là 0,8 g/mL, của xăng truyền thống (hay C8H18) là 0,7 g/mL. Tính nhiệt lượng giải phóng khi đốt cháy 1 lít xăng E5.
Câu 5 (2,0 điểm).
5.1. Cho các phương trình phản ứng sau (theo đúng tỷ lệ mol):
(1) (C17H35COO)3C3H5 + 3NaOH→ 3X1 + Y; (2) C6H10O5+2NaOH → X2+ X3+ Y
(3) X2+ NaOH $\xrightarrow{CaO,{{t}^{o}}}$ X4 + Na2CO3; (4) 2X4 $\xrightarrow[\text{lam la }\!\!\ddot{\mathrm{i}}\!\!\text{ nh nhanh}]{{{1500}^{o}}C}$ X5 + 3X6
(5) X5 + X6 $\xrightarrow{{{t}^{o}},xt}$ X7; (6) X7 + H2O $\xrightarrow{xt}$ X8
(7) X8 + O2 → X9 + H2O; (8) X9 + NaHCO3 → X2 + CO2 + H2O
Xác định các chất từ X1 đến X9 và công thức cấu tạo của C6H10O5. Viết phương trình hóa học các phản ứng xảy ra, ghi rõ điều kiện phản ứng (nếu có).
5.2. Hỗn hợp chất béo X (gồm các trieste của glixerol và axit béo) có phần trăm khối lượng của cacbon và hiđro lần lượt là 76,641% và 12,005%. Xà phòng hóa hoàn toàn m gam X bằng dung dịch KOH dư, đun nóng thu được a gam muối. Mặt khác, 0,1m gam X phản ứng tối đa với 1,12 lít H2 khi có xúc tác Ni nung nóng. Tính giá trị của a.
—HẾT —
Học sinh được sử dụng bảng tuần hoàn các nguyên tố hoá học
Cán bộ coi thi không giải thích gì thêm.