File word Đề thi vào 10 Môn Hóa Lam Sơn – Thanh Hóa – Năm 2023
File word Đề thi vào 10 Môn Hóa Lam Sơn – Thanh Hóa – Năm 2023
Câu 1: (1,0 điểm)
1. Tổng số các loại hạt cơ bản trong một phân tử $\mathrm{M}_{2} \mathrm{X}$ là 140 , trong đó số hạt mang điện nhiểu hơn số hạt không mang điện là 44. Số hạt mang điện của nguyênn từ $\mathrm{M}$ nhiểu hơn nguyền tử $\mathrm{X}$ là 22 . Tìm công thức $\mathrm{M}_{2} \mathrm{X}$.
2. Cho $\mathrm{BaO}$ vào dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ loãng, thu được kết tủa $\mathrm{A}$ và dung dịch $\mathrm{B}$. Cho $\mathrm{Al}$ dư vào dung dịch $\mathrm{B}$ thu được khi $\mathrm{C}$ và dung dịch $\mathrm{D}$. Cho $\mathrm{D}$ tác dụng với dung dịch $\mathrm{Na}_{2} \mathrm{CO}_{3}$, thu được kết tủa $\mathrm{E}$. Biết các phản ứng xảy ra hoàn toàn. Xác định thành phằn các chắt trong $\mathrm{A}, \mathrm{B}, \mathrm{C}, \mathrm{D}, \mathrm{E}$ và viết các $\mathrm{PTHH}$ xảy ra.
Hướng dẵn
1. $\left\{\begin{array}{l}2\left(2 \mathrm{p}_{\mathrm{M}}+\mathrm{n}_{\mathrm{M}}\right)+2 \mathrm{p}_{\mathrm{X}}+\mathrm{n}_{\mathrm{X}}=140 \\ \left(2.2 \mathrm{p}_{\mathrm{M}}+2 \mathrm{p}_{\mathrm{X}}\right)-\left(2 \mathrm{n}_{\mathrm{M}}+\mathrm{n}_{\mathrm{X}}\right)=44 \\ 2 \mathrm{p}_{\mathrm{M}}-2 \mathrm{p}_{\mathrm{X}}=22\end{array} \rightarrow \begin{array}{l}4 \mathrm{p}_{\mathrm{M}}+2 \mathrm{p}_{\mathrm{X}}=92 \\ 2 \mathrm{n}_{\mathrm{M}}+\mathrm{n}_{\mathrm{X}}=48 \\ \mathrm{p}_{\mathrm{M}}=19 \rightarrow \mathrm{K} \mathrm{p}_{\mathrm{X}}=8 \rightarrow \mathrm{O}\end{array} \rightarrow \mathrm{K}_{2} \mathrm{O}\right.$
2. $\mathrm{BaO} \stackrel{+\mathrm{H}_{2} \mathrm{SO}_{4}}{\text { loâng }} \mathrm{A}: \mathrm{BaSO}_{4}+\mathrm{ddB} \mid \begin{aligned} & \mathrm{TH}_{1}: \mathrm{Ba}(\mathrm{OH})_{2} \underset{\mathrm{dAl}}{\stackrel{+\mathrm{Al}}{\longrightarrow}} \mathrm{C}: \mathrm{H}_{2}+\mathrm{ddD}: \mathrm{Ba}\left(\mathrm{AlO}_{2}\right)_{2} \stackrel{+\mathrm{Na}_{2} \mathrm{CO}_{3}}{\longrightarrow} \mathrm{E}: \mathrm{BaCO}_{3}: \mathrm{H}_{2} \mathrm{SO}_{4} \frac{+\mathrm{Al}}{\mathrm{du}} \mathrm{C}: \mathrm{H}_{2}+\mathrm{ddD}: \mathrm{Al}_{2}\left(\mathrm{SO}_{4}\right)_{3} \stackrel{+\mathrm{Na}_{2} \mathrm{CO}_{3}}{\longrightarrow} \mathrm{E}: \mathrm{Al}(\mathrm{OH})_{3}\end{aligned}$
$\mathrm{BaO}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{BaSO}_{4}+\mathrm{H}_{2} \mathrm{O} \quad \mathrm{Ba}(\mathrm{OH})_{2}+2 \mathrm{Al}+\mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{Ba}\left(\mathrm{AlO}_{2}\right)_{2}+3 \mathrm{H}_{2}$
$\mathrm{Ba}\left(\mathrm{AlO}_{2}\right)_{2}+\mathrm{Na}_{2} \mathrm{CO}_{3} \rightarrow 2 \mathrm{NaAlO}_{2}+\mathrm{BaCO}_{3} \quad 2 \mathrm{Al}+3 \mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{Al}_{2}\left(\mathrm{SO}_{4}\right)_{3}+3 \mathrm{H}_{2}$
$\mathrm{Al}_{2}\left(\mathrm{SO}_{4}\right)_{3}+3 \mathrm{Na}_{2} \mathrm{CO}_{3}+3 \mathrm{H}_{2} \mathrm{O} \rightarrow 2 \mathrm{Al}(\mathrm{OH})_{3}+3 \mathrm{Na}_{2} \mathrm{SO}_{4}+3 \mathrm{CO}_{2}$
Câu 2: (1,0 điểm)
Nung $\mathrm{KMnO}_{4}$ ờ nhiệt độ cao, thu được khí A. Cho $\mathrm{FeCl}_{2}$ tác dụng với dung dịch hổn hơp $\mathrm{KMnO}_{4}$ trong $\mathrm{H}_{2} \mathrm{SO}_{4}$ loãng dư, thu được khi $\mathrm{B}$. Cho sắt (II) sunfua tác dụng với dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc nóng, thu được khi $\mathrm{C}$. $\mathrm{Cho}^{\mathrm{F} e \mathrm{~S}_{2}}$ vào dung dịch $\mathrm{HCl}$, thu được khi $\mathrm{D}$. Cho các khi $\mathrm{A}, \mathrm{B}, \mathrm{C}, \mathrm{D}$ lần lượt tác dụng với nhau từng đồi một (có thể đun nóng hoặc dùng xúc tác thích hợp). Viết các PTHH xày ra và ghi rõ điều kiện phản ứng (nếu có).
Hướng då̀n
$2 \mathrm{KMnO}_{4} \stackrel{t^{0}}{\longrightarrow} \mathrm{K}_{2} \mathrm{MnO}_{4}+\mathrm{MnO}_{2}+\mathrm{O}_{2}(\mathrm{~A}) \quad 2 \mathrm{FeS}+10 \mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{Fe}_{2}\left(\mathrm{SO}_{4}\right)_{3}+9 \mathrm{SO}_{2}(\mathrm{C})+10 \mathrm{H}_{2} \mathrm{O}$
$10 \mathrm{FeCl}_{2}+6 \mathrm{KMnO}_{4}+24 \mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow 5 \mathrm{Fe}_{2}\left(\mathrm{SO}_{4}\right)_{3}+3 \mathrm{~K}_{2} \mathrm{SO}_{4}+6 \mathrm{MnSO}_{4}+10 \mathrm{Cl}_{2}(\mathrm{~B})+24 \mathrm{H}_{2} \mathrm{O}$
$\mathrm{FeS}_{2}+2 \mathrm{HCl} \rightarrow \mathrm{FeCl}_{2}+\mathrm{S}+\mathrm{H}_{2} \mathrm{~S}$ (D) $\quad \mathrm{SO}_{2}+1 / 2 \mathrm{O}_{2} \stackrel{\mathrm{v}_{2} \mathrm{O}_{5}}{\mathrm{t}^{\circ}} \mathrm{SO}_{3} \quad 2 \mathrm{H}_{2} \mathrm{~S}+3 \mathrm{O}_{2} \stackrel{\mathrm{t}^{\circ}}{\longrightarrow} 2 \mathrm{SO}_{2}+2 \mathrm{H}_{2} \mathrm{O}$
$\mathrm{SO}_{2}+\mathrm{Cl}_{2}+2 \mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{H}_{2} \mathrm{SO}_{4}+2 \mathrm{HCl} \quad \mathrm{SO}_{2}+2 \mathrm{H}_{2} \mathrm{~S} \stackrel{1^{\circ}}{\longrightarrow} \mathrm{S}+2 \mathrm{H}_{2} \mathrm{O} \quad 4 \mathrm{Cl}_{2}+\mathrm{H}_{2} \mathrm{~S}+4 \mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{H}_{2} \mathrm{SO}_{4}+8 \mathrm{HCl}$
Câu 3: (1,0 điểm)
1. Tiến hành hai thi nghiệm sau:
Thỉ nghiệm 1: hò̀a tan hoàn toàn $0,2 \mathrm{~mol} \mathrm{CuO}$ bằng dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4} 20 \%$ (vừa đủ), thu được dung dịch $\mathrm{A}$
Thi nghiệm 2: hòa tan hoàn toàn $0,2 \mathrm{~mol} \mathrm{CuO}$ bằng dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4} 8 \%$ (vừa đủ), thu được dung dịch $\mathrm{B}$. Làm nguội dung dịch $\mathrm{A}, \mathrm{B}$ đến nhiệt độ $10^{\circ} \mathrm{C}$, tinh khối lượng tinh thể $\mathrm{CuSO}_{4} .5 \mathrm{H}_{2} \mathrm{O}$ tách ra (nếu có) ở mổi thí nghiệm, biết độ tan của $\mathrm{CuSO}_{4}$ ở $10^{\circ} \mathrm{C}$ là 17,37 gam.
2. Sục khi $\mathrm{CO}_{2}$ từ từ đến dư vào dung dịch chứa hỗn họp gồm $\mathrm{KOH}, \mathrm{Ba}(\mathrm{OH})_{2}, \mathrm{BaCl}_{2}$ (tí lệ mol tương ứng là 3 :
1:1), thu được dung dịch $\mathrm{X}$. Cho dung dịch $\mathrm{KHSO}_{4}$ dư vào $\mathrm{X}$. Viết thứ tư các $\mathrm{PTHH}$ xảy ra.
Hướng dẵn
Vì $\mathrm{nCuO}=\mathrm{nH}_{2} \mathrm{SO}_{4}$ nên $\mathrm{mA}=114$ và $\mathrm{mB}=261$.
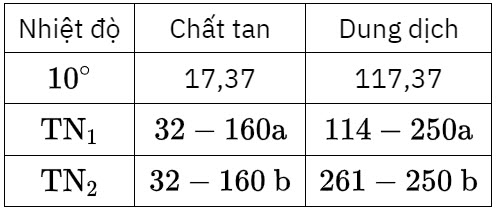
Ta có $\left|\begin{array}{l}17,37(114-250 \mathrm{a})=117,37(32-160 \mathrm{a}) \\ 17,37(261-250 \mathrm{~b})=117,37(32-160 \mathrm{~b})\end{array} \rightarrow\right| \begin{aligned} & \mathrm{a}=0,123 \\ & \mathrm{~b}<0\end{aligned}$ vậy $\mathrm{TN}_{1} \mathrm{mCuSO}_{4} .5 \mathrm{H}_{2} \mathrm{O}$ tách ra 30,75 gam; $\mathrm{TN}_{2}$ không
2. Để đơn giân bài toán, giả sử số mol $\mathrm{KOH}: 3(\mathrm{~mol}) ; \mathrm{Ba}(\mathrm{OH})_{2}: 1(\mathrm{~mol})$ và $\mathrm{BaCl}_{2}: 1(\mathrm{~mol})$.
$\mathrm{CO}_{2}+\mathrm{Ba}(\mathrm{OH})_{2} \rightarrow \mathrm{BaCO}_{3}+\mathrm{H}_{2} \mathrm{O} \quad \mathrm{CO}_{2}+2 \mathrm{KOH} \rightarrow \mathrm{K}_{2} \mathrm{CO}_{3}+\mathrm{H}_{2} \mathrm{O} \quad \mathrm{BaCl}_{2}+\mathrm{K}_{2} \mathrm{CO}_{3} \rightarrow \mathrm{BaCO}_{3}+2 \mathrm{KCl}$
$\mathrm{CO}_{2}+\mathrm{BaCO}_{3}+\mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{Ba}\left(\mathrm{HCO}_{3}\right)_{2} \quad$ Dung dịch $\mathrm{X}: \mathrm{K}_{2} \mathrm{CO}_{3(d u r)}, \mathrm{Ba}\left(\mathrm{HCO}_{3}\right)_{2}, \mathrm{KCl}$
$2 \rightarrow$
$\mathrm{KHSO}_{4}+\mathrm{KHCO}_{3} \rightarrow \mathrm{K}_{2} \mathrm{SO}_{4}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O} \quad 2 \mathrm{KHSO}_{4}+\mathrm{Ba}\left(\mathrm{HCO}_{3}\right)_{2} \rightarrow \mathrm{BaSO}_{4}+\mathrm{K}_{2} \mathrm{SO}_{4}+2 \mathrm{CO}_{2}+2 \mathrm{H}_{2} \mathrm{O}$
2. Giả sử nguyên tử $\mathrm{Fe}$ dạng hình cầu có bán kỉnh $\mathrm{r}=1,28 \cdot 10^{-8} \mathrm{~cm}$. Trong tinh thể sắt có $74 \%$ thể tích bị chiểm bờ các nguyển từ, còn lại là khe rổng. Cho số Avogardo $\mathrm{N}_{\mathrm{A}}=6,022 \cdot 10^{23}$. Tính khối lượng riêng cúa tinh thể sắt (biết thể tích hình cầu được tinh theo công thức $V=(4 / 3) \pi r^{3}$.
$\mathrm{Na}_{2} \mathrm{CO}_{3}+2 \mathrm{HCl} \rightarrow 2 \mathrm{NaCl}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O} \quad \mathrm{NaCl} \stackrel{\mathrm{dpnc}}{\longrightarrow} \mathrm{Na}+0,5 \mathrm{Cl}_{2} \quad \mathrm{BaCO}_{3}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{Ba}\left(\mathrm{HCO}_{3}\right)_{2}$ $\mathrm{Ba}\left(\mathrm{HCO}_{3}\right)_{2} \underset{\text { dun }}{\text { nóng }} \mathrm{BaCO}_{3}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O} \quad \mathrm{BaCO}_{3} \stackrel{\mathrm{t}^{\circ}}{\longrightarrow} \mathrm{BaO}+\mathrm{CO}_{2} \quad \mathrm{BaO} \stackrel{\text { dpnc }}{\longrightarrow} \mathrm{Ba}+0,5 \mathrm{O}_{2}$ 2. Thể tích của 1 mol nguyên tử $\mathrm{Fe}$ là: $\mathrm{V}=\frac{4}{3} \cdot \pi \cdot\left(1,28 \cdot 10^{-8}\right)^{3} \cdot 6,022 \cdot 10^{23}: 74 \%=7,1487\left(\mathrm{~cm}^{3}\right) \rightarrow \mathrm{d}=\frac{\mathrm{m}}{\mathrm{V}}=\frac{56}{7,1487}=7,8336(\mathrm{~g} / \mathrm{ml})$
Câu 5: (1,0 điểm)
1. Viết các PTHH theo sơ đồ sau, ghi rõ điều kiện phản ứng (nếu có):
$$
\mathrm{CH}_{3} \mathrm{COONa} \stackrel{(1)}{\longrightarrow} \mathrm{X} \stackrel{(2)}{\longrightarrow} \mathrm{Y} \stackrel{(3)}{\longrightarrow} \mathrm{C}_{2} \mathrm{H}_{4} \stackrel{(4)}{\longrightarrow} \mathrm{Z} \stackrel{(5)}{\longrightarrow} \mathrm{T} \stackrel{(6)}{\longrightarrow} \mathrm{CH}_{3} \mathrm{COOC}_{2} \mathrm{H}_{5}
$$
Biết $\mathrm{X}$ là thành phần chính của khí thiên nhiên.
2. Thủy phân hoàn toàn chất béo $\mathrm{X}$ trong dung dịch $\mathrm{NaOH}$, thu được glixerol, $\mathrm{C}_{17} \mathrm{H}_{35} \mathrm{COONa}$ và $\mathrm{C}_{17} \mathrm{H}_{33} \mathrm{COONa}$. Đốt cháy hoàn toàn $\mathrm{m}$ gam $\mathrm{X}$ cần vừa đủ $4,025 \mathrm{~mol}_{2}$ thu được $\mathrm{H}_{2} \mathrm{O}$ và $2,85 \mathrm{~mol} \mathrm{CO}_{2}$. Mặt khác, $\mathrm{m}$ gam $\mathrm{X}$ tác dụng tối đa với a mol $\mathrm{Br}_{2}$ trong dung dịch. Tìm giá trị của $\mathrm{m}$ và $\mathrm{a}$.
Hướng dẫn
1. $\mathrm{CH}_{3} \mathrm{COONa}+\mathrm{NaOH} \underset{\mathrm{t}^{\circ}}{\stackrel{\mathrm{CaO}}{\longrightarrow}} \mathrm{CH}_{4}+\mathrm{Na}_{2} \mathrm{CO}_{3} \quad 2 \mathrm{CH}_{4} \frac{1500^{\circ} \mathrm{C}}{\text { làm lạnh nhanh }} \mathrm{CH} \equiv \mathrm{CH}+3 \mathrm{H}_{2}$
$\mathrm{CH} \equiv \mathrm{CH}+\mathrm{H}_{2} \underset{\mathrm{Pd}_{2} \mathrm{t}^{\circ}}{\underset{\mathrm{PdCO}_{3}}{\longrightarrow}} \mathrm{CH}_{2}=\mathrm{CH}_{2} \quad \mathrm{CH}_{2}=\mathrm{CH}_{2}+\mathrm{H}_{2} \mathrm{O} \underset{\mathrm{H}_{2} \mathrm{SO}_{4}}{\text { loăng }} \mathrm{C}_{2} \mathrm{H}_{5} \mathrm{OH}$
$\mathrm{C}_{2} \mathrm{H}_{5} \mathrm{OH}+\mathrm{O}_{2} \underset{\text { meñám }}{\stackrel{\text { gen }}{\longrightarrow}} \mathrm{CH}_{3} \mathrm{COOH}+\mathrm{H}_{2} \mathrm{O} \quad \mathrm{CH}_{3} \mathrm{COOH}+\mathrm{C}_{2} \mathrm{H}_{5} \mathrm{OH} \underset{\mathrm{H}_{2} \mathrm{SO}_{4(\text { dạc) }}}{\mathrm{t}^{\mathrm{o}}} \mathrm{CH}_{3} \mathrm{COOC}_{2} \mathrm{H}_{5}+\mathrm{H}_{2} \mathrm{O}$
2. $\mathrm{X}\left|\begin{array}{l}\left(\mathrm{C}_{17} \mathrm{H}_{35} \mathrm{COO}\right)_{3} \mathrm{C}_{3} \mathrm{H}_{5}{ }^{\mathrm{b}} \\ -\mathrm{H}_{2}{ }^{2}\end{array} \rightarrow\right| \begin{aligned} & \frac{\mathrm{O}_{2}}{4,025} 881,5 \mathrm{~b}-0,5 \mathrm{a}=4,025 \\ & \frac{\mathrm{CO}_{2}}{2,85} \rightarrow 57 \mathrm{~b}=2,85\end{aligned} \rightarrow \mid \begin{aligned} & \mathrm{a}=0,1 \\ & \mathrm{~b}=0,05\end{aligned} \rightarrow \mathrm{m}=44,3(\mathrm{~g})$
Câu 6: (1,0 điểm)
Trong công nghiệp, axit sunfuric được sản xuất bằng phương pháp tiếp xúc qua ba giai đoạn. Nguyên liệu là: lưu huỳnh (hoặc quặng pirit sắt), không khí và nước.
Giai đoạn 1: oxi hóa lưu huỳnh hoặc quặng pirit sắt bằng không khí giàu oxi
Giai đoạn 2: oxi hóa sản phẩm chứa lưu huỳnh thu được ở giai đoạn 1 bằng xúc tác thích hợp.
Giai đoạn 3: hấp thụ sản phẩm chứa lưu huỳnh thu được ở giai đoạn 2 bằng dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc để tạo oleum a. Viết các PTHH xảy ra ở ba giai đoạn trên.
b. Ở giai đoạn 3 có nên dùng nước thay thế dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc để hấp thụ sản phẩm chứa lưu huỳnh thu được ở giai đoạn 2 hay không? Vì sao.
c. Một trong các ứng dụng của axit $\mathrm{H}_{2} \mathrm{SO}_{4}$ là điều chế tinh thể $\mathrm{FeSO}_{4} \cdot 7 \mathrm{H}_{2} \mathrm{O}$ theo qui trình sau: thêm từng lượng nhỏ $\mathrm{FeCO}_{3}$ đến dư vào dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ loãng. Sau đó lọc hỗn hợp phản ứng thu lấy dung dịch. Đun nóng dung dịch đến khi thu được dung dịch bão hòa rồi để nguội. Lọc thu lấy tinh thể chất rắn và thẩm khô bằng giấy lọc. Tại sao phải dùng lượng dư $\mathrm{FeCO}_{3}$ và cho biết hợp chất nào có thể thay thế $\mathrm{FeCO}_{3}$ trong qui trình trên.
Hướng dẫn
a. Giai đoạn 1: $\mathrm{S}+\mathrm{O}_{2} \stackrel{\mathrm{t}^{\mathrm{o}}}{\longrightarrow} \mathrm{SO}_{2} \quad 4 \mathrm{FeS}_{2}+11 \mathrm{O}_{2} \stackrel{\mathrm{t}^{\mathrm{o}}}{\longrightarrow} 2 \mathrm{Fe}_{2} \mathrm{O}_{3}+8 \mathrm{SO}_{2}$
Giai đoạn 2: $\mathrm{SO}_{2}+0,5 \mathrm{O}_{2} \underset{\mathrm{v}_{2} \mathrm{O}_{5}}{\mathrm{t}^{0}} \mathrm{SO}_{3} \quad$ Giai đoạn 3: $\mathrm{H}_{2} \mathrm{SO}_{4(\text { dăc) }}+\mathrm{nSO}_{3} \rightarrow \mathrm{H}_{2} \mathrm{SO}_{4} \cdot \mathrm{nSO}_{3}$ (oleum)
b. Không nên thay dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc để hấp thụ $\mathrm{SO}_{3}$ vì $\mathrm{SO}_{3}$ mới điều chế ở dạng sương, khó hấp thụ nước.
c. Phải dùng lượng dư $\mathrm{FeCO}_{3}$ để dung dịch thu được có $\mathrm{FeSO}_{4}$ tinh khiết. Có thể thay $\mathrm{FeCO}_{3}$ bởi: $\mathrm{FeSO}_{3}, \mathrm{FeS}$
$\mathrm{FeCO}_{3}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{FeSO}_{4}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O} \quad$ ddFeSO${ }_{4} \stackrel{\text { dun nóng }}{\longrightarrow}$ dd bão hòa $+\mathrm{FeSO}_{4} \cdot 7 \mathrm{H}_{2} \mathrm{O}$
Câu 7: (1,0 điểm)
Hidrocacbon mạch hở $\mathrm{X}$ là chất khí điều kiện thường. Nhiệt phân hoàn toàn $\mathrm{X}$ (trong điều kiện không có oxi) thu được sản phẩm gồm cacbon và hidro, trong đó thể tích khí hidro thu được gấp đôi thể tích khí $\mathrm{X}$ (đo cùng điều kiện nhiệt độ và áp suất).
a. Xác định các CTPT và viết CTCT có thể có của X.
b. Nếu $X$ là một anken, nhận biết các chất khí riêng biệt: $X$, etan, axetilen bằng phương pháp hóa học. c. Nếu X là một ankan, chiếm $60 \%$ thể tích khí Biogas (còn lại tạp chất trơ). Đốt cháy 1 mol khí X tỏa ra lượng nhiệt là $875 \mathrm{~kJ}$. Để đun sôi một ấm nước có thể tích 2 lít cần một lượng nhiệt là $630 \mathrm{~kJ}$. Tính thể tích (lít) khí Biogas (đktc) cần dùng để đun sôi 5 ấm nước trên, biết lượng nhiệt thất thoát ra ngoài môi trường là $40 \%$.
Hướng dẫn
a. Giả sử CTPT $\mathrm{X}: \mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}+2-2 \mathrm{k}} \rightarrow \mathrm{nC}+(\mathrm{n}+1-\mathrm{k}) \mathrm{H}_{2}$ và: $\mathrm{nH}_{2}=2 \mathrm{nX} \rightarrow \mathrm{n}+1-\mathrm{k}=2 \rightarrow \mathrm{n}=\mathrm{k}+1(\mathrm{n} \leq 4)$
Vậy $X$ có thể là: $\mathrm{CH}_{4}, \mathrm{C}_{2} \mathrm{H}_{4}\left(\mathrm{CH}_{2}=\mathrm{CH}_{2}\right), \mathrm{C}_{3} \mathrm{H}_{4}\left(\mathrm{CH} \equiv \mathrm{C}-\mathrm{CH}_{3}\right.$ hoặc $\left.\mathrm{CH}_{2}=\mathrm{C}=\mathrm{CH}_{2}\right), \mathrm{C}_{4} \mathrm{H}_{4}\left(\mathrm{CH} \equiv \mathrm{C}-\mathrm{CH}=\mathrm{CH}_{2}\right)$.
b. Lấy mẫu từng khí $\mathrm{C}_{2} \mathrm{H}_{4}, \mathrm{C}_{2} \mathrm{H}_{6}, \mathrm{C}_{2} \mathrm{H}_{2}$ đánh số thứ tự để thuận tiện đối chiếu kết quả thực nghiệm
– Cho từng mẫu khí đi qua dung dịch $\mathrm{AgNO}_{3} / \mathrm{NH}_{3}$ dư, quan sát hiện tượng thấy một mẫu khí có xuất hiện kết tủa
– Cho hai mẫu khí đi vào nước brom dư, mẫu khí làm nhạt màu brom là: $\mathrm{CH}_{2}=\mathrm{CH}_{2}+\mathrm{Br}_{2} \rightarrow \mathrm{CH}_{2}(\mathrm{Br})-\mathrm{CH}_{2}(\mathrm{Br})$ Mẫu khí còn lại là etan.
c. Nhiệt lượng để đun sôi 5 ấm nước là: $630.5: 60 \%=5250 \mathrm{~kJ}$
Thể tích khí Biogas cần dùng là: $5250: 875: 60 \% .22,4=224$ (lít).
Câu 8: (2,0 điểm)
Hòa tan hỗn hợp gồm $\mathrm{Fe}_{2} \mathrm{O}_{3}$, $\mathrm{CuO}$ vào 1,1 lít dung dịch $\mathrm{HCl} 1 \mathrm{M}$ chỉ thu được dung dịch $\mathrm{Y}$. Cho a gam $\mathrm{Al}$ và $\mathrm{Y}$, thu được dung dịch $\mathrm{Z}$ và chất rắn $\mathrm{T}$ chứa hai kim loại. Cho dung dịch $\mathrm{AgNO}_{3}$ dư vào $\mathrm{Z}$, thu được 168,65 gam kết tủa. Mặt khác, cũng lượng a gam $\mathrm{Al}$ trên tác dụng vừa đủ với dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ loãng, thu được khí $\mathrm{H}_{2}$ và dung dịch $\mathrm{G}$. Cho $\mathrm{G}$ tác dụng với $\mathrm{V} \mathrm{ml}$ dung dịch $\mathrm{Ba}(\mathrm{OH})_{2} 0,5 \mathrm{M}$ thu được 85,5 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Viết các PTHH xảy ra và tính $\mathrm{a}, \mathrm{V}$.
Hướng dẫn
Rắn T chứa hai kim loại: $\mathrm{Cu}, \mathrm{Fe}$. Dung dịch $\mathrm{Y}: \mathrm{FeCl}_{3}, \mathrm{CuCl}_{2}, \mathrm{HCl}_{\mathrm{du}}$ nên $\mathrm{T}$ có $\mathrm{Fe}$ thì $\mathrm{Z}$ chứa: $\mathrm{AlCl}_{3}, \mathrm{FeCl}_{2}$.
Thứ tự: $\mathrm{Al}+3 \mathrm{FeCl}_{3} \rightarrow \mathrm{AlCl}_{3}+3 \mathrm{FeCl}_{2} \quad 2 \mathrm{Al}+3 \mathrm{CuCl}_{2} \rightarrow 2 \mathrm{AlCl}_{3}+3 \mathrm{Cu} \quad 2 \mathrm{Al}+6 \mathrm{HCl} \rightarrow 2 \mathrm{AlCl}_{3}+3 \mathrm{H}_{2}$ $\mathrm{Z}\left|\begin{array}{l}\mathrm{AlCl}_{3}{ }^{\mathrm{x}} \\ \mathrm{FeCl}_{2}{ }^{\mathrm{y}}\end{array} \rightarrow \downarrow\right| \begin{aligned} & \mathrm{AgCl}^{1,1} \\ & \mathrm{Ag}^{0,1}\end{aligned} \rightarrow\left|\begin{array}{l}\underset{\mathrm{Cl}}{\longrightarrow} 3 \mathrm{x}+2 \mathrm{y}=1,1 \\ \mathrm{y}=0,1 \rightarrow \mathrm{x}=0,3\end{array} \rightarrow\right| \begin{aligned} & \mathrm{Al}^{0,3} \rightarrow \mathrm{a}=8,1 \\ & \left.\mathrm{Al}_{2}\left(\mathrm{SO}_{4}\right)_{3}\right)^{0,15}\end{aligned} ; \mid \begin{aligned} & \mathrm{Al}_{2}\left(\mathrm{SO}_{4}\right)_{4}+3 \mathrm{Ba}(\mathrm{OH})_{2} \rightarrow 3 \mathrm{BaSO}_{4}+2 \mathrm{Al}(\mathrm{OH})_{3} \\ & \stackrel{85,5 \mathrm{~g}}{\longrightarrow} \mathrm{Ba}(\mathrm{OH})_{2}{ }^{0,3} \rightarrow \mathrm{V}=600(\mathrm{ml})\end{aligned}$
Câu 9: (1,0 điểm)
Cho 7,36 gam hỗn hợp $\mathrm{E}$ gồm hai este thuần chức, mạch hở $\mathrm{X}$ và $\mathrm{Y}$ (đều tạo từ axit cacboxylic và ancol, khối lượng mol phân tử $\mathrm{M}_{\mathrm{X}}<\mathrm{M}_{\mathrm{Y}}<150 \mathrm{~g} / \mathrm{mol}$ ), tác dụng vừa đủ với dung dịch $\mathrm{NaOH}$, thu được một ancol $\mathrm{Z}$ và 6,76 gam hỗn hợp muối $\mathrm{T}$. Cho toàn bộ $\mathrm{Z}$ tác dụng với $\mathrm{Na}$ dư, thu được 1,12 lít khí $\mathrm{H}_{2}$. Đốt cháy hoàn toàn $\mathrm{T}$, thu được $\mathrm{H}_{2} \mathrm{O}, \mathrm{Na}_{2} \mathrm{CO}_{3}$ và $0,05 \mathrm{~mol} \mathrm{CO}_{2}$.
a. Xác định CTCT và \% khối lượng của $\mathrm{X}, \mathrm{Y}$ trong $\mathrm{E}$.
b. Cho hỗn hợp muối $\mathrm{T}$ tác dụng với dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ thu được hỗn hợp $\mathrm{G}$ gồm hai axit hữu cơ. Cho $\mathrm{G}$ tác dụng với etilen glycol $\left(\mathrm{HOCH}_{2} \mathrm{CH}_{2} \mathrm{OH}\right)$, xúc tác $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc, đun nóng thu được chất hữu cơ $\mathrm{H}$ mạch hở có khối lượng mol nhỏ hơn $207 \mathrm{~g} / \mathrm{mol}$. Biết $\mathrm{H}$ tác dụng hoàn toàn với $\mathrm{NaOH}$ dư trong dung dịch, đun nóng tỉ lệ mol $1: 3$. Xác định CTCT của $\mathrm{H}$.
Hướng dẫn
$\left|\begin{array}{l}\mathrm{HCOONa}^{\mathrm{a}} \\ (\mathrm{COONa})_{2}{ }^{\mathrm{b}}\end{array} \rightarrow\right| \begin{aligned} & 68 \mathrm{a}+134 \mathrm{~b}=6,76 \\ & \mathrm{a}+2 \mathrm{~b}=0,1\end{aligned} \rightarrow\left|\begin{array}{l}\mathrm{a}=0,06 \\ \mathrm{~b}=0,02\end{array} \rightarrow \mathrm{E}\right| \begin{aligned} & \mathrm{HCOOC}_{2} \mathrm{H}_{5}^{0,06}: 60,33 \% \\ & \left(\mathrm{COOC}_{2} \mathrm{H}_{5}\right)_{2}^{0,02}: 39,67 \%\end{aligned}$
Câu 10: (2,0 điểm)
1. Bằng kiến thức hóa học, tìm hóa chất và dụng cụ thích hợp để điều chế $\mathrm{Cl}_{2}$ trong thí nghiệm.
2. Có một mẫu vải chất liệu bằng sợi bông tự nhiên (thành phần chủ yếu là xenlulozo).
a. Nhỏ vào mẫu vải vài giọt dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc, tại vị trí tiếp xúc với axit vải bị đen rồi thủng.
b. Nếu thay $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc bằng dung dịch $\mathrm{HCl}$ đặc thì có hiện tượng gì xảy ra.
Viết PTHH để giải thích các hiện tượng trên.
Hướng dẫn
1. Điều chế $\mathrm{Cl}_{2}$ trong PTN:
$2 \mathrm{KMnO}_{4}+16 \mathrm{HCl} \rightarrow 2 \mathrm{KCl}+2 \mathrm{MnCl}_{2}+5 \mathrm{Cl}_{2}+8 \mathrm{H}_{2} \mathrm{O} \quad \mathrm{MnO}_{2}+4 \mathrm{HCl} \rightarrow \mathrm{MnCl}_{2}+\mathrm{Cl}_{2}+2 \mathrm{H}_{2} \mathrm{O}$





