FIle Word Đề thi HKI Hoá 10 THPT Bùi Hưng Hoà TP HCM – Năm học 2022 2023
Nội dung Đề thi HKI Hoá 10 THPT Bùi Hưng Hoà TP HCM – Năm học 2022 2023
PHẦN 1: TRẮC NGHIỆM (4 ĐIỂM)
MÃ ĐỀ: 01
Phần trắc nghiệm bao gồm 16 câu hỏi. Học sinh ghi đáp án trên giấy làm bài (A3)
Câu 1. Chất nào sau đây có liên cộng hóa trị?
A. $\text{CaO}$.
B. ${{\text{H}}_{2}}$.
C. $\text{KCl}$.
D. $\text{N}{{\text{a}}_{2}}\text{O}$.
Câu 2. Khi tham gia liên kết, nguyên tử $\text{Al}$ có xu hướng tạo thành ion có điện tích là
A. $1+$.
B. $4+$.
C. $3+$.
D. $2+$.
Câu 3. Cho bảng sau:
$\text{X},\text{Y}$ và $\text{Z}$ lần lượt là
| Công thức hợp chất ion | Cation | Anion |
| $\text{CaC}{{\text{l}}_{2}}$ | $\text{X}$ | $\text{Y}$ |
| $\text{Z}$ | $\text{N}{{\text{a}}^{+}}$ | ${{\text{O}}^{2-}}$ |
A. $\text{C}{{\text{a}}^{2+}},\text{C}{{\text{l}}^{-}},\text{N}{{\text{a}}_{2}}\text{O}$.
B. $\text{C}{{\text{a}}^{2+}},\text{C}{{\text{l}}^{-}},\text{NaO}$.
C. $\text{C}{{\text{a}}^{+}},\text{C}{{\text{l}}^{2-}},\text{NaO}$.
D. $\text{C}{{\text{a}}^{2+}},\text{C}{{\text{l}}^{2-}},\text{N}{{\text{a}}_{2}}\text{O}$.
Câu 4. Số electron tối đa có trong một orbital là
A. 2 .
B. 4 .
C. 3 .
D. 1 .
Câu 5. Nguyên tử của nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm Argon khi tham gia hình thành liên kết hóa học?
A. Sulfur.
B. Hydrogen.
C. Fluorine.
D. Berrylium.
Câu 6. Số proton và số neutron có trong một nguyên tử $\text{Copper}\left( ~_{29}^{63}\text{Cu} \right)$ lần lượt là:
A. 29 và 29.
B. 29 và 34.
C. 34 và 29 .
D. 63 và 63 .
Câu 7. Trong tự nhiên, argon có các đồng vị ${{~}^{40}}\text{Ar},{{~}^{38}}\text{Ar},{{~}^{36}}\text{Ap}$ chiếm tương ứng khoảng $99,604\text{ }\!\!%\!\!\text{ }$; $0,063\text{ }\!\!%\!\!\text{ }$ và $0,333\text{ }\!\!%\!\!\text{ }$ số nguyên tử. Giá trị nguyên tử khối trung bình của Ar là
A. 37,9946 .
B. 38,0054 .
C. 39,98542 .
D. 36,01458 .
Câu 8. Phát biểu nào sau đây không đúng?
A. Phân lớp $\text{p}$ có 3 orbital.
C. Năng lượng electron trên lớp $\text{K}$ là thấp nhất.
B. Lớp $M$ có 9 phân lớp.
D. Lớp L có 4 orbital.
Câu 9. Liên kết $\pi $ là liên kết hình thành do
A. sự xen phủ bên của hai orbital.
B. lực hút tĩnh điện giữa hai ion trái dấu.
C. cặp electron dùng chung.
D. sự xen phủ trục của hai orbital.
Câu 10. Hai nguyên tố $\text{X}$ và $\text{Y}$ đứng kế tiếp nhau trong một chu kì và có tổng số proton trong hai hạt nhân là 25 . $\text{X}$ và $\text{Y}$ thuộc chu kì và nhóm nào trong bảng tuần hoàn?
A. Chu kì 2 , nhóm IA và IIA.
B. Chu kì 3, nhóm IA và IIA.
C. Chu kì 2, nhóm IIIA và IVA.
D. Chu kì 3, nhóm IIA và IIIA.
Câu 11. Các nguyên tố nhóm VA trong bảng tuần hoàn là
A. Các nguyên tố d.
C. Các nguyên tố p.
B. Các nguyên tố $\text{f}$.
D. Các nguyên tố s.
đây gồm các nguyên tử thuộc cùng một nguyên tố hoá học?
A. $~_{8}^{16}\text{Z},~_{8}^{17}\text{Q},~_{8}^{18}\text{ }\!\!~\!\!\text{ L}$
B. $~_{6}^{14}\text{X},~_{7}^{14}\text{Y},~_{8}^{16}\text{Z}$.
C. $~_{8}^{16}\text{Z},~_{9}^{16}\text{M},~_{7}^{16}\text{G}$.
D. $~_{8}^{17}\text{Q},~_{9}^{16}\text{M},~_{10}^{19}\text{E}$.
Câu 13. Tính chất nào sau đây là tính chất của hợp chất ion?
A. Hợp chất ion có nhiệt độ sôi không xác định.
B. Hợp chất ion có nhiệt độ nóng chảy cao.
C. Hợp chất ion dễ hoá lỏng.
D. Hợp chất ion có nhiệt độ nóng chảy thấp.
Câu 14. Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
A. electron, proton và neutron
B. electron và neutron.
C. proton và neutron.
D. neutron và electron.
Câu 15. Xu hướng biến đổi độ âm điện của các nguyên tố trong bảng tuần hoàn tương tự như xu hướng biến đổi của yếu tố nào sau đây?
A. Bán kính nguyên tử.
B. Tính phi kim.
C. Tính kim loại và bán kính nguyên tử.
D. Tính kim loại.
Câu 16. Ở trạng thái cơ bản, nguyên tử nguyên tố $\text{X}$ có tổng số hạt electron trong phân lớp $\text{p}$ là 11 . Nguyên tử nguyên tố $\text{Y}$ có tổng số hạt proton, notron và electron là 10 . Điều khẳng định nào sau đây là sai?
A. Công thức phân tử của hợp chất tạo thành giữa $\text{X}$ và $\text{Y}$ là $\text{XY}$.
B. Trong tự nhiên nguyên tố $\text{Y}$ tồn tại cả dạng đơn chất và hợp chất.
C. Hợp chất giữa $X$ và $Y$ là hợp chất ion.
D. $X$ có bán kính nguyên tử nhỏ nhất so với các nguyên tố trong cùng chu kì với nó.
PHẦN 2: TỰ LUẬ̣N (6 ĐIỂM)
Học sinh ghi câu trả lời (ngắn gọn) vào phần trả lời đã để trống.
Câu 1: [3.0] Cho các phân tử sau: ${{\text{K}}_{2}}\text{O},\text{N}{{\text{H}}_{3}}$, ${{\text{H}}_{2}}\text{ }\!\!~\!\!\text{ S},{{\text{H}}_{2}}\text{O}$.
(a) Biết:
| $\mathbf{K}$ | $\mathbf{N}$ | $\mathbf{S}$ | $\mathbf{O}$ | $\mathbf{H}$ | |
| Độ âm điẹn | $0.82$ | $3.04$ | $2.58$ | $3.44$ | $2.20$ |
(b) Trình bày sự hình thành liên kết trong phân tử ${{\text{K}}_{2}}\text{O}$ [0.75]
Phân tử nào có liên kết phân cực nhât? Giải thích? [0.5] (c) Viết công thức electron, công thức Lewis, công thức cấu tạo của phân tử $\text{N}{{\text{H}}_{3}}$. [0.75]
(d) Sắp xếp các nguyên tố $\text{K},\text{S},\text{O}$ theo thứ tự:
a. Bán kính nguyên tử tăng dần [0.25]
c. Điện tích hạt nhân tăng dần [0.25]
b. Tính phi kim tăng dần [0.25]
(e) Biết nhiệt độ sôi của nước và hydrogen sulfide lần lượt là ${{100}^{\circ }}\text{C}$ và $-{{60}^{\circ }}\text{C}$. Giải thích vì sao có sự khác biệt lớn về nhiệt độ sôi của 2 chất này. [0.25]
Câu 2: [1.0] Cho một mẫu kim loại kiềm $\text{M}$ nặng 0,552 gam vào lượng dư nước thấy xuất hiện khí không màu, không mùi. Tiến hành thu khí và đo thể tích khí thì được kết quả $\text{V}=297,48$ $\text{mL}$ (khí đo ở điều kiện chuẩn, 1 bar và ${{25}^{\circ }}\text{C}$ ). Dựa vào dữ kiện thu được hãy xác định tên của kim loại $\mathbf{M}$.
Câu 3: [1.0] Oxide cao nhất của 1 nguyên tố ứng với công thức ${{\text{R}}_{2}}{{\text{O}}_{7}}$. Trong đó nguyên tố oxygen chiếm $61,12\text{ }\!\!%\!\!\text{ }$ về khối lượng. Xác định tên của $R$. Viết công thức hydroxide tương ứng với oxide cao nhất cảu $\text{R}$.
Câu 4: [1.0] Năng lượng ion hóa của một nguyên tử hay một phân tử là năng lượng cần thiết để tách một electron từ nguyên tử hay phân tử đó ở trạng thái khí cơ bản. Một cách tổng quát hơn, năng lượng ion hóa thứ $\text{n}$ là năng lượng cần thiết để tách điện tử thứ $\text{n}$ sau khi đã tách ( $\text{n}$ 1) điện tử đầu tiên.
Dưới đây là bảng dữ liệu và biểu đồ biểu diễn năng lượng ion hóa thứ nhất (tách electron đầu tiên) đến năng lượng ion hóa thứ 12 (tách electron cuối cùng) của Magnesium.
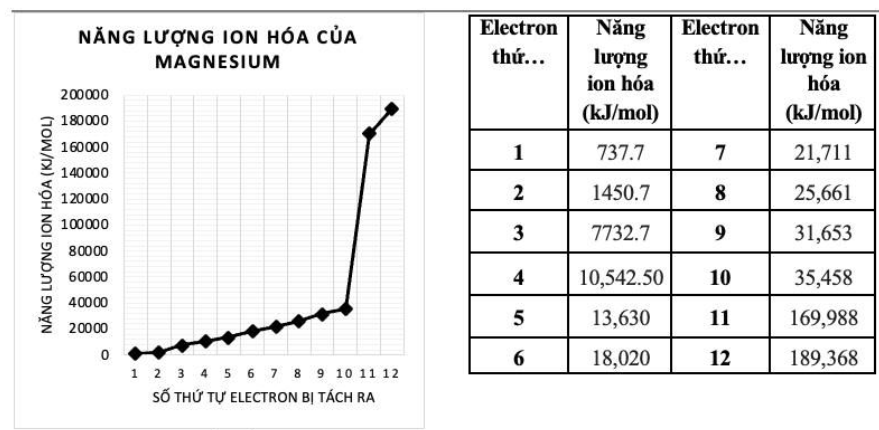
| Electron thứ… | Năng lượng ion hóa (kJ/mol) | Electron thứ… | Năng lượng ion hóa (kJ/mol) |
| $1$ | $737.7$ | $7$ | 21,711 |
| $2$ | $1450.7$ | $8$ | 25,661 |
| $3$ | $7732.7$ | $9$ | 31,653 |
| $4$ | $10,542.50$ | $10$ | 35,458 |
| $5$ | 13,630 | $11$ | 169,988 |
| $6$ | 18,020 | $12$ | 189,368 |
(a) Nhận xét biểu đồ trên [0.75]
(b) Bằng các kiến thức đã học về vỏ nguyên tử, giải thích vì sao có sự thay đổi đột ngột giá trị năng lượng ion hóa giữa electron thứ $2-3$ và electron thứ $10-11$. [0.25]
FIle PDF Đề thi HKI Hoá 10 THPT Bùi Hưng Hoà TP HCM – Năm học 2022 2023
FIle Word Đề thi HKI Hoá 10 THPT Bùi Hưng Hoà TP HCM – Năm học 2022 2023
Đủ 10 comment mình sẽ word và chia sẻ cùng các bạn