File word đề thi vào 10 Chuyên Hóa Đồng Nai – Năm học 2023 – 2024
File word đề thi vào 10 Chuyên Hóa Đồng Nai – Năm học 2023 – 2024
Câu 1: (2,0 điểm)
1. Chất rắn $\mathrm{A}_1$ là một axit dễ tan trong nước, phản ứng với $\mathrm{KOH}$ tạo thành các sản phẩm khác nhau là $\mathrm{A}_2$ hoặc $\mathrm{A}_3$ (tùy vào tỉ lệ các chất phản ứng). Khi cho hai sản phẩm này tác dụng với nhau, $\mathrm{A}_2$ đóng vai trò là axit, $\mathrm{A}_3$ đóng vai trò là bazo. Trộn lẫn các dung dịch có cùng số mol của $\mathrm{A}_2$ và $\mathrm{A}_3$ sẽ tạo thành chất $\mathrm{A}_4$. Cho $\mathrm{A}_4$ tác dụng với lượng dư $\mathrm{KOH}$ lại thu được $\mathrm{A}_3$. Biết rằng, các chất $\mathrm{A}_1, \ldots \mathrm{A}_4$ đều chứa nguyên tố $\mathrm{P}$. Xác định công thức các chất $\mathrm{A}_1 \ldots \mathrm{A}_4$ và viết $\mathrm{PTHH}$ minh họa.
Hướng dẫn
$\mathrm{A}_1: \mathrm{H}_3 \mathrm{PO}_4 ; \mathrm{A}_2: \mathrm{KH}_2 \mathrm{PO}_4 ; \mathrm{A}_3: \mathrm{K}_3 \mathrm{PO}_4 ; \mathrm{A}_4: \mathrm{K}_2 \mathrm{HPO}_4$
$\mathrm{KOH}+\mathrm{H}_3 \mathrm{PO}_4 \rightarrow \mathrm{KH}_2 \mathrm{PO}_4+\mathrm{H}_2 \mathrm{O} \quad 2 \mathrm{KOH}+\mathrm{H}_3 \mathrm{PO}_4 \rightarrow \mathrm{K}_2 \mathrm{HPO}_4+2 \mathrm{H}_2 \mathrm{O} \quad \mathrm{KH}_2 \mathrm{PO}_4+\mathrm{K}_3 \mathrm{PO}_4 \rightarrow 2 \mathrm{~K}_2 \mathrm{HPO}_4$
2. Tại Seagame 32, đoàn thể thao Việt Nam đã xuất sắc hoàn thành kỳ Đại hội ở vị trí nhất toàn đoàn trên bản xếp hạng với 136 huy chương vàng trong tổng số 359 huy chương.
a. Thực tế, những tấm huy chương vàng không phải được làm từ vàng nguyên chất mà trong thành phần có cả vàng, bạc và đồng. Một mẫu vật liệu làm huy chương vàng nặng 5 gam được cho vào dung dịch $\mathrm{HNO}_3$ đặc nóng, lấy dư phần chất rắn không tan còn lại được lọc rửa cẩn thận, làm khô rồi đem cân, có khối lượng 0,067 gam. Tiếp tục cho thêm $\mathrm{HCl}$ vào dung dịch sau khi lọc, thu được tối đa 6,144 gam kết tủa. Tính \% khối lượng vàng, bạc và đồng có trong vật liệu làm huy chương vàng.
b. Mặt khác, vật liệu làm huy chương đồng có phần trăm khối lượng đồng lên đến $96 \%$. Sau khi hoàn tan hoàn toàn đồng kim loại trong 0,08 gam mẫu vật liệu trên bằng $\mathrm{HNO}_3$, trung hòa axit dư và loại bỏ hết các phụ phẩm. Thêm tiếp một lượng dư KI để chuyển hết muối đồng (II) thành $\mathrm{CuI}$ và giải phóng $\mathrm{I}_2$. Lượng $\mathrm{I}_2$ sinh ra phản ứng vừa đủ với $\mathrm{V} \mathrm{ml}$ dung dịch $\mathrm{Na}_2 \mathrm{~S}_2 \mathrm{O}_3 0,1 \mathrm{M}$ theo phương trình: $\mathrm{I}_2+2 \mathrm{Na}_2 \mathrm{~S}_2 \mathrm{O}_3 \rightarrow 2 \mathrm{NaI}+\mathrm{Na}_2 \mathrm{~S}_4 \mathrm{O}_6$. Trong điều kiện các thao tác kỹ thuật chính xác, tính giá trị $\mathrm{V}$ cần dùng.
c. Trong quá trình sản xuất, vàng có thể được hòa tan thông qua phản ứng với nước cường thủy (hỗn hợp dung dịch $\mathrm{HCl}$ và $\mathrm{HNO}_3$ ). Viết $\mathrm{PTHH}$ giữa $\mathrm{Au}$ và nước cường thủy, biết rằng sản phẩm sinh ra có axit $\mathrm{HauCl}_4$ và $\mathrm{NO}_2$ Hướng dẫn
$
\begin{aligned}
& \text { a. } \mathrm{Cu}+4 \mathrm{HNO}_3 \rightarrow \mathrm{Cu}\left(\mathrm{NO}_3\right)_2+2 \mathrm{NO}_2+\mathrm{H}_2 \mathrm{O} \quad \mathrm{Ag}+2 \mathrm{HNO}_3 \rightarrow \mathrm{AgNO}_3+\mathrm{NO}_2+\mathrm{H}_2 \mathrm{O} \quad \mathrm{AgNO}_3+\mathrm{HCl} \rightarrow \mathrm{AgCl} \\
& \text { Ta có: } \mathrm{nAgCl}=6,144: 143,5 \rightarrow \mathrm{mAg}=4,624 ; \mathrm{mAu}=0,067 \rightarrow \% \mathrm{Cu}^{6,18 \%} ; \mathrm{Ag}^{92,48 \%} ; \mathrm{Au}^{1,34 \%} \\
& \text { b. } \mathrm{Cu}^{2+}+2 \mathrm{KI} \rightarrow \mathrm{CuI}+1 / 2 \mathrm{I}_2+2 \mathrm{~K}^{+} \quad \mathrm{I}_2+2 \mathrm{Na}_2 \mathrm{~S}_2 \mathrm{O}_3 \rightarrow 2 \mathrm{NaI}+\mathrm{Na}_2 \mathrm{~S}_4 \mathrm{O}_6 \\
& 0,0012 \rightarrow \quad 0,0006 \quad 0,0006 \rightarrow 0,0012 \quad \text { Suy ra: } \mathrm{V}=12(\mathrm{ml}) \text {. } \\
&
\end{aligned}
$
Câu 2: (2,0 điểm)
1. Tiến hành các thao tác thí nghiệm sau:
Bước 1: cân chính xác 40 gam tinh thể $\mathrm{CuSO}_4 \cdot \mathrm{nH}_2 \mathrm{O}$ trong lọ (1) cho vào cốc (2). Thêm từ từ nước cất, khuấy đều cho tan hết để thu được đúng $400 \mathrm{ml}$ dung dịch $\mathrm{A}$.
Bước 2: lấy $10 \mathrm{ml}$ dung dịch $\mathrm{A}$ tứ cốc (2), cho phản ứng với $10 \mathrm{ml}$ dung dịch $\mathrm{NaOH} 1 \mathrm{M}$. Sau khi phản ứng xảy ra hoàn toàn, lọc bỏ kết tủa, thu được dung dịch $\mathrm{B}$.
Bước 3 : thêm vài giọt phenolphtalein vào dung dịch $\mathrm{B}$, rồi nhỏ từ từ dung dịch $\mathrm{HCl} 0,1 \mathrm{M}$ cho đến khi dung dịch $\mathrm{B}$ trở lại không màu thì thấy dùng hết $20 \mathrm{ml}$ dung dịch $\mathrm{HCl} 0,1 \mathrm{M}$.
Lặp lại thao tác ở bước 2 và bước 3 thêm ba lần nữa để xác định đúng hóa chất ở lọ (1). Trình bày cách tính khối lượng tinh thể $\mathrm{CuSO}_4 \cdot \mathrm{nH}_2 \mathrm{O}$ và thể tích nước cất cần dùng thêm để pha chế được $500 \mathrm{ml}$ dung dịch $\mathrm{CuSO}_4$ $0,5 \mathrm{M}$ nhằm giảm tối đa sự lãng phí hóa chất. Cho khối lượng riêng của nước là $1 \mathrm{~g} / \mathrm{ml}$. Bỏ qua sự thay đổi thể tích khi hòa tan các chất và không xét đến các phản ứng phụ.
Hướng dẫn
* Đồng nhất dữ kiện, nhân dữ kiện bước 2 và 3 với 40 lần.
$
\begin{array}{lll}
\mathrm{NaOH}+\mathrm{HCl} \rightarrow \mathrm{NaCl}+\mathrm{H}_2 \mathrm{O} & \mathrm{CuSO}_4+2 \mathrm{NaOH} \rightarrow \mathrm{Cu}(\mathrm{OH})_2+\mathrm{Na}_2 \mathrm{SO}_4 \\
0,08 \leftarrow 0,08 & 0,16 \quad \leftarrow 0,32 \rightarrow & 0,16
\end{array}
$
Suy ra: $\mathrm{M}_{\text {Tinh thế }}=40: 0,16=250 \rightarrow \mathrm{n}=5 \rightarrow \mathrm{CuSO}_4 \cdot 5 \mathrm{H}_2 \mathrm{O}$.
* Ta có: $\mathrm{nCuSO}_4=0,25 \rightarrow \mathrm{mCuSO}_4 \cdot 5 \mathrm{H}_2 \mathrm{O}=62,5$ gam. Pha chế: rót nước cất vào bình chứa 62,5 gam tinh thể $\mathrm{CuSO}_4 \cdot 5 \mathrm{H}_2 \mathrm{O}$ đến khi thu được $500 \mathrm{ml}$ dung dịch.
2. Hỗn hợp $\mathrm{X}$ gồm ba kim loại $\mathrm{Al}, \mathrm{Mg}, \mathrm{Cu}$. Cho $\mathrm{m}$ gam $\mathrm{X}$ vào dung dịch $\mathrm{CuSO}_4$ dư, sau khi phản ứng hoàn toàn thu được 1,6 gam kim loại. Mặt khác, cho $\mathrm{m}$ gam X vào $50 \mathrm{ml}$ dung dịch $\mathrm{HCl} 1 \mathrm{M}$ cho đến khi phản ứng hoàn toàn thu được 0,448 lít khí (đktc), dung dịch $\mathrm{Y}$ và a gam chất rắn. Cho từ từ 0,02 lít dung dịch $\mathrm{NaOH} \mathrm{bM}$ (dung dịch $\mathrm{Z}$ ) vào dung dịch $\mathrm{Y}$ thì thấy bắt đầu xuất hiện kết tủa, thêm tiếp dung dịch $\mathrm{Z}$ cho đến khi lượng kết tủa không đổi cần dùng thêm 0,1 lít dung dịch $Z$. Tính các giá trị $\mathrm{a}, \mathrm{b}, \mathrm{m}$.
Hướng dẫn
1,6 gam kim loại là $\mathrm{Cu} . \mathrm{NaOH}+\mathrm{HCl} \rightarrow \mathrm{NaCl}+\mathrm{H}_2 \mathrm{O}$
$
2 \mathrm{NaOH}+\mathrm{MgCl}_2 \rightarrow \mathrm{Mg}(\mathrm{OH})_2+2 \mathrm{NaCl}
$
$
3 \mathrm{NaOH}+\mathrm{AlCl}_3 \rightarrow \mathrm{Al}(\mathrm{OH})_3+3 \mathrm{NaCl} \quad \mathrm{NaOH}+\mathrm{Al}(\mathrm{OH})_3 \rightarrow \mathrm{NaAlO}_2+2 \mathrm{H}_2 \mathrm{O}
$
Câu 3: (2,0 điểm)
1. Diesel (dầu DO) là một loại nhiên liệu lỏng, được tinh chế từ dầu mỏ. Có hai loại dầu $D O$, thứ nhất là $D O$ $0,05 \mathrm{~S}$ có hàm lượng lưu huỳnh (S) không lớn hơn $500 \mathrm{mg} / \mathrm{Kg}(500 \mathrm{ppm})$, thứ hai là dầu $\mathrm{DO} 0,25 \mathrm{~S}$ có hàm lượng $\mathrm{S}$ không lớn hơn $2500 \mathrm{mg} / \mathrm{kg}$ (2500 ppm). Dầu $\mathrm{DO}$ có hàm lượng $\mathrm{S}$ càng cao khi cháy sẽ phát thải hàm lượng muội và khí $\mathrm{SO}_x$ càng cao. Do đó từ ngày $01 / 0,1 / 2016$ tại Việt Nam chỉ cho phép sử dụng loại dầu $\mathrm{DO} 0,05 \mathrm{~S}$. Để xác định hàm lượng $\mathrm{S}$ trong một loại dầu $\mathrm{DO}$, người ta lấy 100 gam dầu $\mathrm{DO}$ đốt cháy hoàn toàn, sản phẩm tạo ra gồm $\mathrm{SO}_2, \mathrm{CO}_2$ và hơi nước. Lượng $\mathrm{SO}_2$ thu được phản ứng vừa đủ với $12,5 \mathrm{ml}$ dung dịch $\mathrm{KMnO}_4$ $0,016 \mathrm{M}$. Xác định hàm lượng $\mathrm{S}$ trong loại dầu $\mathrm{DO}$ trên, cho biết dầu $\mathrm{DO}$ đó có được phép sử dụng Việt Nam hay không ?
Hướng dẫn
$
5 \mathrm{SO}_2+2 \mathrm{KMnO}_4+2 \mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{K}_2 \mathrm{SO}_4+2 \mathrm{MnSO}_4+2 \mathrm{H}_2 \mathrm{SO}_4 \text { suy ra mS }=0,016 \mathrm{~g} / 100 \mathrm{~g} \rightarrow 160 \mathrm{mg} / \mathrm{kg}<500 \mathrm{mg} / \mathrm{kg}
$
Vậy loại dầu $\mathrm{DO}$ này được phép sử dụng.
2. Thành phần chính của biogas là khí $\mathrm{B}_1$. Ngoài khí $\mathrm{B}_1$ trong biogas còn chứa một lượng nhỏ các khí $\mathrm{B}_2, \mathrm{~B}_3, \mathrm{~B}_4$ a. Xác định các khí $\mathrm{B}_1 \ldots \mathrm{B}_4$ và viết $\mathrm{PTHH}$ tương ứng với thông tin sau :
– $\mathrm{B}_1$ là hidrocacbon, trong phân tử $\mathrm{B}_1$ có $\mathrm{mC}: \mathrm{mH}=3: 1$. Oxi hóa hoàn toàn khí $\mathrm{B}_1$ thu được khí $\mathrm{B}_2$ (là oxit của nguyên tố $\mathrm{X}$ ). Khí $\mathrm{B}_2$ không duy trì sự cháy, tuy nhiên ở nhiệt độ cao một số kim loại mạnh như $\mathrm{Mg}$ ‘cháy’ mãnh liệt trong khí $\mathrm{B}_2$
– Khí $\mathrm{B}_3$ cũng là oxit của nguyên tố $\mathrm{X}$, khí $\mathrm{B}_3$ có thể phản ứng với $\mathrm{O}_2$ tạo thành khí $\mathrm{B}_2$
– Khí $\mathrm{B}_4$ là hợp chất khí của một nguyên tố nhóm VIA với hidro, có mùi đặc trưng, khí $\mathrm{B}_4$ cũng có thể phản ứng với $\mathrm{O}_2$ tạo thành chất rắn màu vàng.
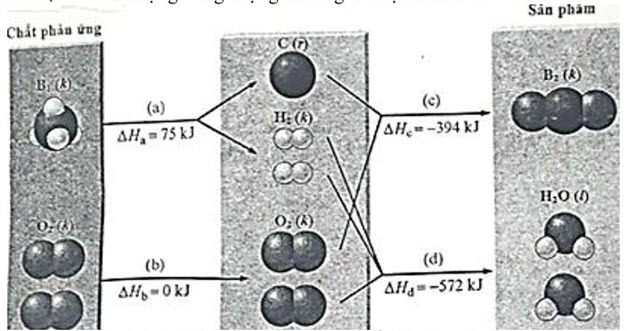
Quá trình đốt cháy khí $\mathrm{B}_1$ nhằm sử dụng năng lượng từ biogas được biểu diễn theo sơ đồ :
Biến thiên enthalpy của một quá trình (khí hiệu là $\Delta \mathrm{H}$ ) được hiểu là năng lượng (ở dạng nhiệt) tỏa ra hoặc thu vào khi quá trình xảy ra. Nếu quá trình tỏa nhiệt thì $\Delta \mathrm{H}$ có giá trị âm và ngược lại, nếu quá trình thu nhiệt thì $\Delta \mathrm{H}$ có giá trị dương. Trên sơ đồ, các giá trị $\Delta \mathrm{H}$ được ghi nhận tương ứng với phản ứng đốt cháy $1 \mathrm{~mol}$ khí $\mathrm{B}_1$ (1). Biển thiên enthalpy của toàn bộ phản ứng bằng tổng biến thiên enthalpy của các quá trình $\mathrm{a}, \mathrm{b}, \mathrm{c}, \mathrm{d}$. b. Hãy tính giá trị $\Delta \mathrm{H}$ cho phản ứng (1) và cho biết đó là quá trình thu nhiệt hay tỏa nhiệt.
c. Cần đốt cháy hoàn toàn bao nhiêu gam khí $\mathrm{B}_1$ để cung cấp đủ nhiệt cho phản ứng tạo thành $112 \mathrm{gam} \mathrm{CaO}$ bằng cách nung $\mathrm{CaCO}_3$ với hiệu suất $100 \%$. Biết rằng phản ứng nhiệt phân $1 \mathrm{~mol} \mathrm{CaCO}_{3(\mathrm{~s})}$ có $\Delta \mathrm{H}=179,2 \mathrm{~kJ}$. d. Đốt cháy hoàn toàn 1 gam khí $\mathrm{C}_2 \mathrm{H}_2$ thu được $\mathrm{CO}_{2(\mathrm{k})}$ và $\mathrm{H}_2 \mathrm{O}_{(\mathrm{l})}$ giải phóng $50,01 \mathrm{~kJ}$. Tính biến thiên enthalpy của phản ứng đốt cháy 1 mol khí $\mathrm{C}_2 \mathrm{H}_2$, từ đó cho biết vì sao $\mathrm{C}_2 \mathrm{H}_2$ được sử dụng trong đèn xì hàn cắt kim loại mà không dùng $B_1$.
e. $\mathrm{H}_2$ cũng là một nhiên liệu được nghiên cứu sử dụng để giảm thiểu các khí thải gây ô nhiễm môi trường. Tính năng lượng tỏa ra khi đốt cháy hoàn toàn 3 gam khí $\mathrm{H}_2$. Cho biết tất cả các quá trình trên đều được thực hiện ở điều kiện tiêu chuẩn.
Hướng dẫn
a. $\mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}+2-2 \mathrm{k}}$ vì $\mathrm{mC}=3 \mathrm{mH} \rightarrow 12 \mathrm{n}=3 \cdot(2 \mathrm{n}+2-2 \mathrm{k}) \rightarrow \mathrm{n}=1-\mathrm{k}$ chọn $\mathrm{k}=0, \mathrm{n}=1 \rightarrow \mathrm{CH}_4$
Oxi hóa $\mathrm{CH}_4$ thu được $\mathrm{B}_2$ không duy trì sự cháy, khử được $\mathrm{Mg}$ ở t ${ }^0$ cao nên $\mathrm{B}_2: \mathrm{CO}_2$
$
\mathrm{CH}_4+2 \mathrm{O}_2 \rightarrow \mathrm{CO}_2+2 \mathrm{H}_2 \mathrm{O} \quad 2 \mathrm{Mg}+\mathrm{CO}_2 \rightarrow 2 \mathrm{MgO}+\mathrm{C}
$
$\mathrm{B}_3$ là oxit của $\mathrm{C}, \mathrm{B}_3$ pứ với $\mathrm{O}_2$ tạo $\mathrm{B}_2$ nên $\mathrm{B}_3$ là: $\mathrm{CO}+1 / 2 \mathrm{O}_2 \rightarrow \mathrm{CO}_2$
$\mathrm{B}_4$ là $\mathrm{H}_2 \mathrm{~S}$ (mùi trứng thối): $2 \mathrm{H}_2 \mathrm{~S}+\mathrm{O}_2 \rightarrow 2 \mathrm{~S}+2 \mathrm{H}_2 \mathrm{O}$
b. $\mathrm{CH}_4 \rightarrow \mathrm{C}+2 \mathrm{H}_2 \Delta \mathrm{H}_{\mathrm{a}}=75 \mathrm{~kJ} \quad \mathrm{C}+\mathrm{O}_2 \rightarrow \mathrm{CO}_2 \Delta \mathrm{H}_{\mathrm{c}}=-394 \mathrm{~kJ} \quad 2 \mathrm{H}_2+\mathrm{O}_2 \rightarrow 2 \mathrm{H}_2 \mathrm{O} \Delta \mathrm{H}_{\mathrm{d}}=-572 \mathrm{~kJ}$
Khi đó: $\Delta \mathrm{H}=-891 \mathrm{~kJ}<0 \rightarrow$ pứ tỏa nhiệt. PTHH: $\mathrm{CaCO}_3 \rightarrow \mathrm{CaO}+\mathrm{CO}_2 \quad \Delta \mathrm{H}=179,2 \mathrm{~kJ}$
c. Để tạo $112 \mathrm{gam} \mathrm{CaO}$ cần $\mathrm{Q}=179,2.2=358,4 \mathrm{~kJ} \rightarrow \mathrm{mCH}_4=358,4: 891.16=9,01$ gam.
d. Đốt cháy $1 \mathrm{~mol} \mathrm{C}_2 \mathrm{H}_2$ thì: $\Delta \mathrm{H}=50,01:(1: 26)=1300,26 \mathrm{~kJ}>891 \mathrm{~kJ}$ nên trong đèn xì hàn cắt kim loại người ta sử dụng $\mathrm{C}_2 \mathrm{H}_2$ chứ không dùng $\mathrm{CH}_4$.
e. $2 \mathrm{H}_2+\mathrm{O}_2 \rightarrow 2 \mathrm{H}_2 \mathrm{O} \Delta \mathrm{H}_{\mathrm{d}}=-572 \mathrm{~kJ}$ vậy đốt 3 gam $\mathrm{H}_2$ tỏa ra $1,5.572: 2=429 \mathrm{~kJ}$
Câu 4: (2,0 điểm)
1. Cho a lít (đktc) hỗn hợp khí $D$ gồm hai hidrocacbon $F_1$ (thuộc dãy đồng đẳng của etilen) và $F_2$ (thuộc dãy đồng đẳng của axetilen) tác dụng hết với dung dịch brom dư, khối lượng brom đã tham gia phản ứng là $10 \mathrm{a}$ gam. Tính \% thể tích mỗi khí trong D.
2. Tiến hành phân tích định lượng hai chất hữu cơ $\mathrm{G}_1$ và $\mathrm{G}_2$ thu được số liệu có sự tương đồng như sau : oxi hóa hoàn toàn 1,84 gam chất cần phân tích $\left(\mathrm{G}_1\right.$ hoặc $\left.\mathrm{G}_2\right)$ chỉ thu được 1,44 gam $\mathrm{H}_2 \mathrm{O}$ và khí $\mathrm{CO}_2$. Khi dẫn toàn bộ lượng $\mathrm{CO}_2$ đó vào $100 \mathrm{ml}$ dung dịch $\mathrm{Ba}(\mathrm{OH})_2 1 \mathrm{M}$ để phản ứng xảy ra hoàn toàn thì thấy xuất hiện 11,82 gam kết tủa. Biết tỉ khối hơi của $\mathrm{G}_1$ và $\mathrm{G}_2$ so với không khí $\left(\mathrm{M}_{\text {không khi }}=29\right)$ đều nhỏ hơn 4 . Mặt khác, khi xét các phản ứng hóa học của $\mathrm{G}_1$ và $\mathrm{G}_2$ thì có sự khác biệt sau :
– $\mathrm{G}_1$ tác dụng với $\mathrm{Na}$ thu được số mol khí $\mathrm{H}_2$ gấp 1,5 lần số $\mathrm{mol}_{\mathrm{G}} \mathrm{G}_1$ phản ứng
– $\mathrm{G}_2$ phản ứng với dung dịch $\mathrm{AgNO}_3$ trong $\mathrm{NH}_3$ tạo ra kết tủa $\mathrm{G}_3$ có $\mathrm{M}_{\mathrm{G} 3}-\mathrm{M}_{\mathrm{G} 2}=214 \mathrm{~g} / \mathrm{mol}$. Viết $\mathrm{CTCT}$ có thể có của $\mathrm{G}_1$ và $\mathrm{G}_2$.
Hướng dẫn
1. Để đơn giản bài toán, giả sử $\mathrm{a}=22,4$ (lít) $\left.\mathrm{D}\left|\begin{array}{l}\mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}}: 1-\mathrm{b} \\ \mathrm{C}_{\mathrm{m}} \mathrm{H}_{2 \mathrm{~m}-2}: \mathrm{b}\end{array} \rightarrow\right| \begin{aligned} & \mathrm{n}_{\mathrm{Br}_2}=1-\mathrm{b}+2 \mathrm{~b}=1,4 \\ & \mathrm{~b}=0,4\end{aligned} \rightarrow \% \mathrm{~V}\right|_{40 \%} ^{60 \%}$
2. Nhận xét: $\mathrm{nBa}(\mathrm{OH})_2=0,1>0,06$ nên có hai trường hợp:
$\mathrm{TH}_1$ : kết tủa chứa bị hòa $\tan \mathrm{CO}_2+\mathrm{Ca}(\mathrm{OH})_2 \rightarrow \mathrm{CaCO}_3+\mathrm{H}_2 \mathrm{O}$
$\mathrm{TH}_2$ : kết tủa bị hòa tan một phần
$
\begin{aligned}
& \mathrm{CH} \equiv \mathrm{CCH}_2 \mathrm{CH}_2 \mathrm{CH}_2 \mathrm{C} \equiv \mathrm{CH} ; \mathrm{CH} \equiv \mathrm{C}-\mathrm{CH}_2 \mathrm{CH}\left(\mathrm{CH}_3\right) \mathrm{CH}_2 \mathrm{C} \equiv \mathrm{CH} ; \mathrm{CH} \equiv \mathrm{C}-\mathrm{CH}\left(\mathrm{C}_2 \mathrm{H}_5\right) \mathrm{C} \equiv \mathrm{CH} ; \mathrm{CH} \equiv \mathrm{C}-\mathrm{C}\left(\mathrm{CH}_3\right)_2 \mathrm{C} \equiv \mathrm{CH} \\
&
\end{aligned}
$
Câu 5: (2,0 điểm)
1. Thực hiện phản ứng este hóa giữa axit cacboxylic $\mathrm{E}_1$ và ancol $\mathrm{E}_2$ theo tỉ lệ mol $1: 1$ :
$
\mathrm{R}_1 \mathrm{COOH}+\mathrm{R}_2 \mathrm{OH} \stackrel{\left.\mathrm{H}_2 \mathrm{SO}_{4(d a ̆ c}\right), \mathrm{t}^{\circ}}{\longrightarrow} \mathrm{R}_1 \mathrm{COOR}_2\left(\mathrm{E}_3\right)+\mathrm{H}_2 \mathrm{O}
$
Biết $\mathrm{E}_3\left(72<\mathrm{M}_{\mathrm{E} 3}<108\right)$ là hợp chất hữu cơ mạch hở, trong phân tử có một liên kết pi. Khi đốt cháy hoàn toàn $\mathrm{E}_3$ thu được số mol $\mathrm{CO}_2$ bằng số mol $\mathrm{O}_2$ phản ứng. $\mathrm{E}_1, \mathrm{E}_2$ đều có cấu tạo mạch hở và chỉ chứa một loại nhóm chức. Xác định CTCT của $\mathrm{E}_1, \mathrm{E}_2, \mathrm{E}_3$.
Hướng dẫn
Nếu $\mathrm{E}_3$ là este no, 1 chức : $\mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}} \mathrm{O}_2+(1,5 \mathrm{n}-1) \mathrm{O}_2 \rightarrow \mathrm{nCO}_2+\mathrm{nH}_2 \mathrm{O}$ vì: $\mathrm{nO}_2=\mathrm{nCO}_2 \rightarrow \mathrm{n}=2(\mathrm{M}=60) \rightarrow \mathrm{ktm}$
Suy ra $\mathrm{E}$ có chức $\mathrm{OH}: \mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}} \mathrm{O}_{\mathrm{a}}+(1,5 \mathrm{n}-0,5 \mathrm{a}) \mathrm{O}_2 \rightarrow \mathrm{nCO}_2+\mathrm{nH}_2 \mathrm{O}$ vì $\mathrm{nO}_2=\mathrm{nCO}_2, \mathrm{M}_{\mathrm{E} 3}<108 \rightarrow \mathrm{a}=3, \mathrm{n}=3$
CTCT E $3: \mathrm{HCOOCH}_2 \mathrm{CH}_2 \mathrm{OH} ; \mathrm{E}_1: \mathrm{HCOOH} ; \mathrm{E}_2: \mathrm{HOCH}_2 \mathrm{CH}_2 \mathrm{OH}$
2. Cho PTHH thủy phân etyl axetat trong môi trường axit: $\mathrm{CH}_3 \mathrm{COOC}_2 \mathrm{H}_5+\mathrm{H}_2 \mathrm{O} \stackrel{\mathrm{xt}}{\stackrel{\mathrm{Ht}}{\longrightarrow}} \mathrm{CH}_3 \mathrm{COOH}^2+\mathrm{C}_2 \mathrm{H}_5 \mathrm{OH}$ Nghiên cứu phản ứng thủy phân este người ta tiến hành các thí nghiệm:
Thí nghiệm 1: thay $\mathrm{H}$ trong $\mathrm{H}_2 \mathrm{O}$ và $\mathrm{HCl}$ bởi Doteri (là đồng vị của $\mathrm{H}$, nghĩa là nguyên tử có cùng số proton nhưng khác nhau về số khối, được khí hiệu $\mathrm{D}={ }_1^2 \mathrm{H}$ ), ta được $\mathrm{D}_2 \mathrm{O}$ và $\mathrm{DCl}$. Sau khi thực hiện phản ứng thủy phân etyl axetat và $\mathrm{D}_2 \mathrm{O}$ với sự có mặt của $\mathrm{DCl}$, người ta tiến hành tách riêng và xác định phân tử khối hai sản phẩm tạo thành.
Thí nghiệm 2: thay ${ }_8^{16} \mathrm{O}$ bằng ${ }_8^{18} \mathrm{O}$ ta được $\mathrm{H}_2{ }^{18} \mathrm{O}$. Sau khi thực hiện phản ứng thủy phân giữa etyl axetat và $\mathrm{H}_2{ }^{18} \mathrm{O}$ tiếp tục tách riêng và xác định phân tử khối hai sản phẩm tạo thành, thu được $\mathrm{M}_{\mathrm{Ancol}} \mathrm{TN} 2=46 ; \mathrm{M}_{\text {axit }} \mathrm{TN} 2=$ 62.
a. Hãy cho biết phân tử khối $\mathrm{M}_{\text {ancol TN1 }}$ và $\mathrm{M}_{\text {axit TN1 }}$ đo được ở thí nghiệm 1.