File word Đề thi vào 10 Chuyên Hóa Tỉnh Yên Bái – Năm học 2023 – 2024
File word Đề thi vào 10 Chuyên Hóa Tỉnh Yên Bái – Năm học 2023 – 2024
Câu 1. (1,5 điểm)
Hợp chất A có công thức phân tử RX2. Tổng số hạt proton, nơtron, electron trong một phân tử chất A là 178 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 54 hạt. Số hạt mang điện trong một nguyên từ R nhiều hơn số hạt mang điện trong một nguyên tử X là 20 hạt.
Tìm công thức phân tử hợp chất A.
Đốt cháy hoàn toàn m gam chất A trong oxy vừa đủ, toàn bộ sản phẩm khí thu được hấp thụ hết bởi 1 lít dung dịch chứa hỗn hợp gồm Ba(OH)2 0,2M và KOH 0,2M, sau phản ứng thu được dung dịch Y và 32,55 gam kết tủa. Xác định giá trị của m.
Câu 2. (2,0 điểm)
Hỗn hợp A gồm các chất Na2O, NaHCO3, NH4Cl và BaCl2 có số mol mỗi chất bằng nhau. Hoà tan A vào nước dư, sau phản ứng đun nóng thu được khí X, dung dịch Y và kết tủa M. Xác định X, M và thành phần chất tan trong Y. Viết các phương trình phản ứng xảy ra.
| 2. Cho từ từ dung dịch KOH vào 100 ml dung dịch hỗn hợp gồm FeCl3 xM và AlCl3 yM, thu được kết tủa. Đồ thị biểu diễn mối quan hệ giữa số mol kết tủa và số mol KOH như hình vẽ bên. Tìm x, y. | 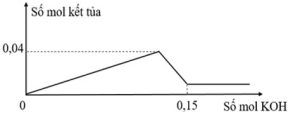 |
Câu 3. (1,5 điểm)
Vận dụng kiến thức hóa học để giải thích các vấn đề thực tiễn dưới đây, viết phương trình hóa học xảy ra (nếu có).
Khi nhiệt kế thủy ngân bị vỡ, người ta thường dùng bột lưu huỳnh rắc lên thủy ngân rơi vãi.
Vỏ trứng gà sủi bọt khi ngâm trong dung dịch giấm ăn.
Khi bón phân đạm ure cho đồng ruộng không nên trộn chung với vôi.
Người ta thường đặt miếng bông tẩm xút trên miệng bình thu khi trong thí nghiệm điều chế khí sunfurơ.
Cho sơ đồ chuyển hóa có sự tham gia của sắt và một số hợp chất của sắt:
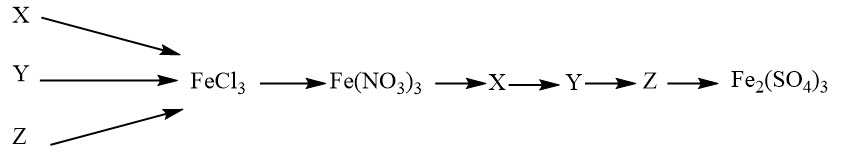
Xác định X, Y, Z và viết các phương trình phản ứng hoàn thành sơ đồ chuyển hóa trên.
Câu 4. (1 điểm)
Nung m gam X gồm nhôm và một oxit sắt trong điều kiện không có không khí, thu được hỗn hợp chất rắn Y. Chia Y thành hai phần:
– Phần 1: Tác dụng với lượng dư dung dịch NaOH, thu được 1,68 lít khí và 12,6 gam chất rắn.
– Phần 2: Tác dụng với dung dịch H2SO4 đặc, nóng, dư thu được 27,72 lít khí SO2 và dung dịch Z chứa 263,25 gam muối sunfat. Biết các phản ứng xảy ra hoàn toàn, các thể tích khí đo ở đktc.
Viết phương trình hoá học của các phản ứng xảy ra.
Tính m và xác định công thức của oxit sắt.
Câu 5. (2,5 điểm)
Bốn hợp chất hữu cơ mạch hở X, Y, Z, T có công thức phân tử: C2H2, C4H8, C2H4O2, C2H6O (không theo thứ tự). X, Y, Z, T có các tính chất sau:
– X tác dụng được với Na và CaCO3.
– Y, T làm mất màu nước brom. Y có cấu tạo đối xứng.
– Z tác dụng được với Na nhưng không tác dụng được với dung dịch NaOH.
– T tác dụng với dung dịch AgNO3 trong NH3 (Ag2O/NH3) thu được kết tủa màu vàng nhạt.
Xác định công thức cấu tạo của X, Y, Z, T và viết các phương trình phản ứng xảy ra.
Từ T và các chất vô cơ cần thiết (thiết bị và điều kiện đầy đủ) hãy viết các phương trình phản ứng điều chế cao su Buna.
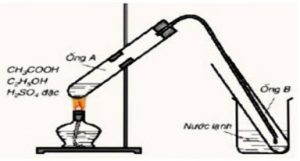
Cho sơ đồ điều chế etyl axetat trong phòng thí nghiệm từ ancol etylic và axit axetic với xúc tác H2SO4 đặc.
| a. Viết phương trình phản ứng xảy ra trong thí nghiệm.
b. Cho biết vai trò của cốc nước lạnh trong thí nghiệm. Sau khi kết thúc phản ứng, thêm một ít nước vào chất lỏng trong ống nghiệm B, lắc nhẹ thì có hiện tượng gì xảy ra? c. Có thể dùng cồn 40o và giấm ăn để điều chế etyl axetat được không? |
 |
Nung metan ở 1500°C trong bình kín, sau đó làm lạnh ngay thu được hỗn hợp khí X gồm CH4, C2H2 và H2. Đốt cháy hoàn toàn X cần 8,96 lít O2 (đktc). Hấp thụ toàn bộ sản phẩm cháy vào 150 ml dung dịch Ca(OH)2 1M thu được dung dịch Y.
Tính khối lượng hỗn hợp X.
Dung dịch Y có khối lượng thay đổi như thế nào so với dung dịch Ca(OH)2 ban đầu?
Câu 6. (1,5 điểm)
Cho các chất: C2H5OH; CH3COOH; C6H12O6 (glucozơ); CH3COOC2H5; C12H22O11 (saccarozơ) và CH3COONa. Lập dãy chuyển hóa gồm 5 phản ứng của 6 chất trên và viết phương trình phản ứng xảy ra.
A là một axit cacboxylic no, đơn chức, mạch hở. Đốt cháy hoàn toàn 2,84 gam A rồi dẫn toàn bộ sản phẩm cháy vào dung dịch nước vôi trong dư, sau phản ứng thu được 18 gam kết tủa.
Viết phương trình phản ứng xảy ra và xác định công thức phân tử của A.
Chất béo B tạo bởi glixerol C3H5(OH)3 và axit A. Thực hiện lần lượt các bước thí nghiệm như sau:
(1) Cho 222,5 gam B và 128 gam dung dịch NaOH 25% vào trong một bát sứ.
2) Đun nóng hỗn hợp trong bát sứ, đồng thời khuấy đều trong thời gian 20 phút. Cứ sau mỗi khoảng thời gian 3 – 5 phút lại thêm vào hỗn hợp một ít nước cất.
3) Thêm vào hỗn hợp thu được sau bước (2) một lượng dư dung dịch NaCl bão hòa rồi tách lấy phần chất rắn nổi lên, thêm hương liệu và tạo hình để thu được xà phòng thành phẩm.
+ Viết công thức cấu tạo của chất béo B và phương trình phản ứng xảy ra ở bước 2.
+ Tại sao ở bước 2 cứ sau 3 – 5 phút lại phải thêm nước cất vào hỗn hợp?
+ Tính khối lượng xà phòng thành phẩm, giả sử hiệu suất của toàn bộ quá trình điều chế xả phòng là 80% và xà phòng thành phẩm chứa 60% khối lượng là muối của axit A.
Cho biết:
Khối lượng nguyên tử của các nguyên tố sau: H=1;C=12;O=16; Na=23; Al = 27; S = 32; Cl=35,5; K=39; Ca=40; Fe=56; Ba= 137.
Số hiệu nguyên tử của một số nguyên tố sau: H (Z=1);O (Z=8); S (Z=16); Cl (Z=17); K (Z=19); Ca (Z=20); Fe (Z=26).
—-HẾT—-
Thí sinh không sử dụng tài liệu, cán bộ coi thi không giải thích gì thêm.





