File word đề thi vào 10 Chuyên Hóa Lâm Đồng – Năm học 2023 – 2024
File word đề thi vào 10 Chuyên Hóa Lâm Đồng – Năm học 2023 – 2024


Câu 1. (3,5 điểm)
1.1. Nêu hiện tượng và viết phương trình hóa học cho các phản ứng xảy ra khi tiến hành các thí nghiệm sau: sunfat.
a) Cho dung dịch axit sunfuric vào ống nghiệm có chứa dung dịch bari clorua.
b) Cho một mẩu nhỏ kim loại natri vào cốc thủy tinh có chứa dung dịch đồng (II)
c) Cho dung dịch nhôm clorua vào ống nghiệm có chứa dung dịch natri sunfua.
– 1.2. Viết phương trình hóa học hoàn thành sơ đồ phản ứng sau:
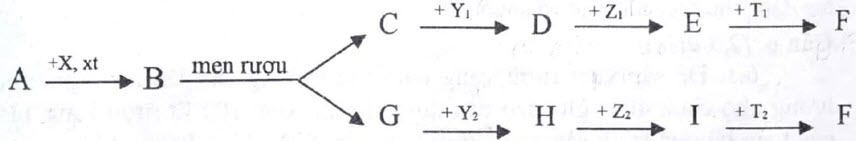
Cho biết : A là hợp chất hữu cơ; $\mathrm{F}$ là bari sunfat.
Câu 2. (2,5 điểm)
2.1. Cho sơ đồ điều chế khí $\mathrm{SO}_{2}$ như hình vẽ bên:
a) Xác định chất (1), (2) và chất được tẩm trong bông (3). Viết phương trình hóa học điều chế $\mathrm{SO}_{2}$ theo các chất đã xác định.
b) Giải thích vai trò của $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc và dung dịch được tẩm trong bông. Viết phương trình hóa học minh họa (nếu có).
c) Làm thế nào để biết khí $\mathrm{SO}_{2}$
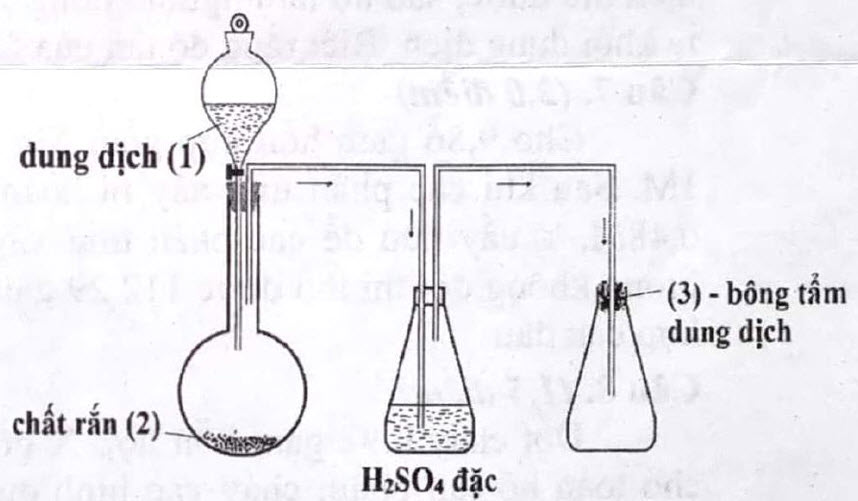
đã được thu đầy bình (biết khí $\mathrm{SO}_{2}$ không màu).
2.2. Khí $\mathrm{SO}_{2}$ là một trong những chất gây ô nhiễm không khí và cũng là một trong các nguyên nhân gây ra mưa axit. Tổ chức Y tế Thế giới (WHO) quy định không khí bị ô nhiễm khí $\mathrm{SO}_{2}$ khi lượng khí $\mathrm{SO}_{2}$ vượt quá $3.10^{-5} \mathrm{~mol} / \mathrm{m}^{3}$. Tại thành phố $\mathrm{A}$, khi tiến hành phân tích 50 lít không khí thấy có $0,012 \mathrm{mg}$ khí $\mathrm{SO}_{2}$. Vậy không khí ở thành phố $\mathrm{A}$ có bị ô nhiễm khí $\mathrm{SO}_{2}$ không?
Câu 3. (3,0 điểm)
3.1. Có 5 lọ hóa chất không nhãn đựng một trong 5 dung dịch không màu: $\mathrm{KOH}$, $\mathrm{HCl}, \mathrm{H}_{2} \mathrm{SO}_{4}, \mathrm{~K}_{2} \mathrm{SO}_{4}, \mathrm{Ba}\left(\mathrm{NO}_{3}\right)_{2}$. Chỉ được dùng thêm dung dịch phenolphtalein, hãy nhận biết dung dịch trong mỗi lọ. Viết phương trình hóa học minh họa.
3.2. Bằng phương pháp hóa học, hãy tách riêng từng khí sau ra khỏi hỗn hợp: $\mathrm{CH}_{4}$, $\mathrm{C}_{2} \mathrm{H}_{2}, \mathrm{C}_{2} \mathrm{H}_{4}, \mathrm{NH}_{3}, \mathrm{SO}_{2}$. Viết phương trình hóa học minh họa.
Câu 4. (1,5 điểm)
Trong quy trình xử lý nước sinh hoạt, giai đoạn cuối cùng thường khử trùng bằng khí clo; lượng clo được bơm vào nước trong bể tiếp xúc theo tỉ lệ $5 \mathrm{gam} / \mathrm{m}^{3}$.
a) Giải thích vì sao clo trong nước có khả năng khử trùng và diệt khuẩn.
b) Em hãy đề xuất hai biện pháp làm giảm hàm lượng clo trong nước sinh hoạt khi hàm lượng clo vượt quá mức cho phép (clo là một khí độc, vì vậy việc dùng nước máy nếu chứa hàm lượng clo vượt quá mức cho phép sẽ ảnh hưởng đến sức khỏe).
c) Tính khối lượng clo cần dùng cho việc xử lý nước sinh hoạt mỗi ngày ở tỉnh Lâm Đồng nếu dân số của tỉnh là 1,3 triệu dân và mỗi người dùng hết 100 lít nước/ngày.
Câu 5. (3,5 điểm)
5.1. Hòa tan 11,2 gam hỗn hợp gồm kim loại $\mathrm{Cu}$ và kim loại $\mathrm{M}$ trong dung dịch $\mathrm{HCl}$ dư, thu được 3,136 lít khí (đktc). Mặt khác, nếu hòa tan hết 11,2 gam hỗn hợp kim loại trên trong dung dịch $\mathrm{HNO}_{3}$ dư thì thu được 3,92 lít khí $\mathrm{NO}$ (đktc, sản phẩm khử duy nhất). Xác định kim loại $\mathrm{M}$.
5.2. Đốt cháy hoàn toàn 22,2 gam một hỗn hợp gồm este có công thức $\mathrm{CH}_{3} \mathrm{COOC}_{n} \mathrm{H}_{2 n+1}$ và ancol $\mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}+1} \mathrm{OH}$, thu được 44 gam khí $\mathrm{CO}_{2}$ và 19,8 gam $\mathrm{H}_{2} \mathrm{O}$. Hãy xác định công thức cấu tạo dạng thu gọn của este và ancol.
Câu 6. (2,5 điểm)
6.1. Để sản xuất rượu vang người ta thường cho lên men quả nho chín. Tính khối lượng nho chứa $40 \%$ glucozơ cần dùng để sản xuất 100 lít rượu vang $11,5^{\circ}$. Biết hiệu suất của toàn bộ quá trình sản xuất rượu vang đạt $80 \%$, khối lượng riêng của $\mathrm{C}_{2} \mathrm{H}_{5} \mathrm{OH}$ bằng 0,8 gam $/ \mathrm{ml}$.
6.2. Cho 16 gam $\mathrm{CuO}$ tác dụng hoàn toàn với dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4} 20 \%$. Đun nóng dung dịch thu được, sau đó làm nguội xuống $10^{\circ} \mathrm{C}$. Tính khối lượng tinh thể $\mathrm{CuSO}_{4} \cdot 5 \mathrm{H}_{2} \mathrm{O}$ đã tách ra khỏi dung dịch. Biết rằng độ tan của $\mathrm{CuSO}_{4}$ ở $10^{\circ} \mathrm{C}$ là 14,4 gam.
Câu 7. (2,0 điểm)
Cho 9,86 gam hỗn hợp gồm $\mathrm{Mg}$ và $\mathrm{Zn}$ vào một cốc chứa $430 \mathrm{ml}$ dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ 1M. Sau khi các phản ứng xảy ra hoàn toàn, thêm tiếp vào cốc 1 lít dung dịch $\mathrm{Ba}(\mathrm{OH})_{2}$ $0,48 \mathrm{M}$, khuấy đều để các phản ứng xảy ra hoàn toàn. Lọc lấy kết tủa và nung đến khối lượng không đổi thì thu được 112,29 gam chất rắn. Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu.
Câu 8. (1,5 điểm)
Đốt cháy 0,92 gam hỗn hợp $\mathrm{X}$ gồm $\mathrm{C}_{2} \mathrm{H}_{4}, \mathrm{H}_{2}, \mathrm{C}_{3} \mathrm{H}_{6}, \mathrm{CO}, \mathrm{C}_{4} \mathrm{H}_{8}$ bằng $\mathrm{O}_{2}$ vừa đủ, rồi cho toàn bộ sản phẩm cháy vào bình đựng 2 lít dung dịch $\mathrm{Ca}(\mathrm{OH})_{2} 0,02 \mathrm{M}$ thấy xuất hiện $\mathrm{m}_{1}$ gam kết tủa. Lọc bỏ kết tủa, thu được dung dịch $\mathrm{Y}$ có khối lượng tăng 0,82 gam so với dung dịch $\mathrm{Ca}(\mathrm{OH})_{2}$ ban đầu. Thêm từ từ dung dịch $\mathrm{Ba}(\mathrm{OH})_{2}$ vào dung dịch $\mathrm{Y}$ đến khi phản ứng xảy ra hoàn toàn, thấy có $\mathrm{m}_{2}$ gam kết tủa. Biết $\mathrm{m}_{1}+\mathrm{m}_{2}=6,955$. Tính thành phần $\%$ theo khối lượng của $\mathrm{CO}$ và $\mathrm{H}_{2}$ có trong hỗn hợp $\mathrm{X}$.
Xem thêm: File word đề thi vào 10 Chuyên Hóa Lâm Đồng – Năm học 2020 – 2021
Cho biết nguyên tủ khối:
$S=32 ; O=16 ; C l=35.5 ; C u=64 ; H=1 ; N=14 ; F e=56 ; Z n=65 ; A l=27 ; M g=24$ $C a=40 ; B a=137 ; C=12 ; A g=108$
File word tải ở phần comment
Dap an Hoa Lam DongHãy vào facebook của nhóm để tham gia dự án góp đề và đáp án chuyên Hóa năm 2023 các tỉnh thành trong cả nước ngay nào






FIle word vào chuyên hóa Lâm Đồng: https://docs.google.com/document/d/1ltdHMEhYv7oDmkDrawaENaV8eJrYV4Ez/edit?usp=sharing&ouid=116298212205166366384&rtpof=true&sd=true