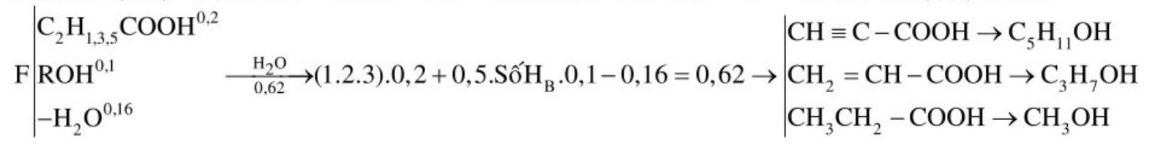File word Đề thi vào 10 Chuyên Hóa Nghệ An – Năm học 2023 – 2024
File gốc Đề thi vào 10 Chuyên Hóa Nghệ An – Năm học 2023 – 2024


Nội dung và lời giải Đề thi vào 10 Chuyên Hóa Nghệ An – Năm học 2023 – 2024
Câu 1: (3,0 điểm)
1. Khí $\mathrm{A}$ là một chất độc, thường có trong các suối nước nóng. Đốt cháy khí $\mathrm{A}$ trong khí $\mathrm{O}_2$ dư tạo ra khí $\mathrm{X}$, khí $\mathrm{X}$ tác dụng với khí $\mathrm{A}$ nhiệt độ thường tạo ra chất rắn $\mathrm{Y}$. Trong phòng thí nghiệm, chất có thể dùng $\mathrm{Y}$ để thu hồi đơn chất $\mathrm{Z}$ (độc) bị rơi vãi do có phản ứng tạo ra chất rắn T. Đốt cháy $\mathrm{T}$, khí sinh ra cho tác dụng với dung dịch $\mathrm{KMnO}_4$ tạo ra axit $\mathrm{E}$. Khí $\mathrm{A}$ tác dụng với $\mathrm{E}$ trong điều kiện thích hợp tạo ra khí $\mathrm{X}$. Xác định các chất $\mathrm{A}, \mathrm{X}, \ldots \mathrm{T}$ và viết $\mathrm{PTHH}$ của các phản ứng xảy ra.
2. Hoàn thành PTHH của các phản ứng sau: (1) $\mathrm{FeCl}_2+\mathrm{Br}_2 \rightarrow$
(2) $\mathrm{KNO}_3+\mathrm{C}+\mathrm{S} \rightarrow$
Hướng dẫn
(3) $\mathrm{Ca}\left(\mathrm{HCO}_3\right)_2+\mathrm{NaOH}_{\mathrm{dur}} \rightarrow$
(4) $\mathrm{H}_2 \mathrm{~S}+\mathrm{NaOH}_{\text {thiếu }} \rightarrow$
1. A: $\mathrm{H}_2 \mathrm{~S} ; \mathrm{X}: \mathrm{SO}_2 ; \mathrm{Y}: \mathrm{S} ; \mathrm{Z}: \mathrm{Hg} ; \mathrm{T}: \mathrm{HgS} ; \mathrm{E}: \mathrm{H}_2 \mathrm{SO}_4$
$$
\begin{aligned}
& 2 \mathrm{H}_2 \mathrm{~S}+3 \mathrm{O}_2 \stackrel{t^{\circ}}{\longrightarrow} 2 \mathrm{SO}_2+2 \mathrm{H}_2 \mathrm{O} \quad \mathrm{SO}_2+2 \mathrm{H}_2 \mathrm{~S} \stackrel{\mathrm{t}^{\circ}}{\longrightarrow} 3 \mathrm{~S}+2 \mathrm{H}_2 \mathrm{O} \quad \mathrm{S}+\mathrm{Hg} \stackrel{t^{\circ}}{\longrightarrow} \mathrm{HgS} \\
& 2 \mathrm{HgS}+3 \mathrm{O}_2 \stackrel{\mathrm{t}^{\circ}}{\longrightarrow} 2 \mathrm{SO}_2+2 \mathrm{HgO} \quad 5 \mathrm{SO}_2+2 \mathrm{KMnO}_4+2 \mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{K}_2 \mathrm{SO}_4+2 \mathrm{MnSO}_4+2 \mathrm{H}_2 \mathrm{SO}_4 \\
& \mathrm{H}_2 \mathrm{~S}+3 \mathrm{H}_2 \mathrm{SO}_4 \rightarrow 4 \mathrm{SO}_2+4 \mathrm{H}_2 \mathrm{O} \\
&
\end{aligned}
$$
2. (1) $3 \mathrm{FeCl}_2+1,5 \mathrm{Br}_2 \rightarrow 2 \mathrm{FeCl}_3+\mathrm{FeBr}_3$
(2) $2 \mathrm{KNO}_3+3 \mathrm{C}+\mathrm{S} \rightarrow \mathrm{K}_2 \mathrm{~S}+3 \mathrm{CO}_2+\mathrm{N}_2$
(3) $\mathrm{Ca}\left(\mathrm{HCO}_3\right)_2+2 \mathrm{NaOH}_{\mathrm{du}} \rightarrow \mathrm{CaCO}_3+\mathrm{Na}_2 \mathrm{CO}_3+2 \mathrm{H}_2 \mathrm{O}$
(4) $\mathrm{H}_2 \mathrm{~S}+\mathrm{NaOH}_{\text {thiếu }} \rightarrow \mathrm{NaHS}+\mathrm{H}_2 \mathrm{O}$
Câu 2: (3,0 điểm)
Cho dung dịch $\mathrm{HCl}$ đặc tác dụng với $\mathrm{KMnO}_4$ thu được khí X. Tiến hành các thí nghiệm sau:
– Thí nghiệm 1: cho $\mathrm{X}$ tác dụng với dung dịch $\mathrm{NaOH}$ ở nhiệt độ thường thu được dung dịch $\mathrm{A}$, thêm dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ loãng vào dung dịch $\mathrm{A}$.
– Thí nghiệm 2: sục khí $\mathrm{X}$ đến dư vào dung dịch $\mathrm{H}_2 \mathrm{~S}$ thu được dung dịch $\mathrm{B}$, thêm $\mathrm{BaCl}_2$ vào $\mathrm{B}$
– Thí nghiệm 3: nung nóng đỏ sợi dây sắt rồi đưa nhanh vào bình khí $X$. Hòa tan sản phẩm vào nước rồi thêm vào một mẫu $\mathrm{Cu}$ để phản ứng xảy ra hoàn toàn, cô cạn hỗn hợp sau phản ứng. Lấy chất rắn thu được cho tác dụng với dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ đặc, đun nóng.
Nêu hiện tượng và viết PTHH để giải thích các hiện tượng đó trong những thí nghiệm trên.
Hướng dẫn
$$
2 \mathrm{KMnO}_4+16 \mathrm{HCl} \rightarrow 2 \mathrm{KCl}+2 \mathrm{MnCl}_2+5 \mathrm{Cl}_2+8 \mathrm{H}_2 \mathrm{O}
$$
$\mathrm{TN}_1: \mathrm{Cl}_2+2 \mathrm{NaOH} \rightarrow \mathrm{NaCl}+\mathrm{NaClO}+\mathrm{H}_2 \mathrm{O} \quad 2 \mathrm{NaClO}+\mathrm{H}_2 \mathrm{SO}_4 \rightarrow \mathrm{Na}_2 \mathrm{SO}_4+\mathrm{Cl}_2+2 \mathrm{H}_2 \mathrm{O}$ quan sát thấy có khí màu vàng, mùi sốc thoát ra.
$\mathrm{TN}_2: 4 \mathrm{Cl}_2+\mathrm{H}_2 \mathrm{~S}+4 \mathrm{H}_2 \mathrm{O} \rightarrow 8 \mathrm{HCl}+\mathrm{H}_2 \mathrm{SO}_4 \quad \mathrm{BaCl}_2+\mathrm{H}_2 \mathrm{SO}_4 \rightarrow \mathrm{BaSO}_4+2 \mathrm{HCl}$ xuất hiện kết tủa trắng
$\mathrm{TN}_3: \mathrm{Fe}+1,5 \mathrm{Cl}_2 \rightarrow \mathrm{FeCl}_3$ sắt cháy sáng trong bình khí $\mathrm{Cl}_2$, tỏa nhiều khói màu nâu đỏ $\left(\mathrm{FeCl}_3\right)$, thêm nước vào bình ta thu được dung dịch nâu đỏ $\left(\mathrm{FeCl}_3\right)$. Cho mẩu $\mathrm{Cu}$ vào quan sát thấy dung dịch nâu đỏ nhạt dần, rồi chuyển sang màu xanh lam: $\mathrm{Cu}+2 \mathrm{FeCl}_3 \rightarrow \mathrm{CuCl}_2+2 \mathrm{FeCl}_2$ cô cạn dung dịch, lấy rắn khan thu được cho vào dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ đặc nóng, pứ thoát ra khí màu vàng, mùi sốc và khí không màu, mùi hắc, dung dịch chuyển màu vàng nâu: $2 \mathrm{FeCl}_2+6 \mathrm{H}_2 \mathrm{SO}_{4(\mathrm{dn})} \rightarrow \mathrm{Fe}_2\left(\mathrm{SO}_4\right)_3+2 \mathrm{Cl}_2+3 \mathrm{SO}_2+6 \mathrm{H}_2 \mathrm{O}$
Câu 3: (3,0 điểm)
1. Hãy viết $\mathrm{PTHH}$ của các phản ứng xảy ra trong tự nhiên hoặc trong đời sống.
– Quá trình quang hợp của cây xanh tạo ra tinh bột. Từ tinh bột người ta sản xuất ra chất $\mathrm{X}$ (có thể dùng trong dược phẩm). Ngoài $\mathrm{X}$ còn dùng để tráng ruột phích.
– Trong công nghiệp, chất $\mathrm{Y}$ được sản xuất từ butan. Dung dịch loãng $\mathrm{Y}$ có thể được dùng làm gia vị trong nấu ăn. Chất $\mathrm{Y}$ có thể được dùng để phá hủy lớp vỏ cứng của quả trứng gà.
– Một trong những quá trình sản xuất PVC trong công nghiệp là: nung nóng metan và làm lạnh đột ngột; sau đó tách lấy sản phẩm rổi cho tác dụng với khí hidro clorua (theo tỉ lệ thể tích và điểu kiện thích hợp) thì thu được vinyl clorua; cuối cùng trùng hợp vinyl clorua thu được PVC.
Hướng dẫn
$$
\begin{aligned}
& \mathrm{C}_5 \mathrm{H}_6(\mathrm{OH})_5 \mathrm{CHO}+2 \mathrm{AgNO}_3+3 \mathrm{NH}_3+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{C}_5 \mathrm{H}_6(\mathrm{OH})_5 \mathrm{COONH}_4+2 \mathrm{NH}_4 \mathrm{NO}_3+2 \mathrm{Ag} \downarrow \\
& -\mathrm{C}_4 \mathrm{H}_{10}+2,5 \mathrm{O}_2 \stackrel{\mathrm{Mn}^{2+}}{\mathrm{t}^0} 2 \mathrm{CH}_3 \mathrm{COOH}(\mathrm{Y})+\mathrm{H}_2 \mathrm{O} \quad 2 \mathrm{CH}_3 \mathrm{COOH}+\mathrm{CaCO}_3 \rightarrow\left(\mathrm{CH}_3 \mathrm{COO}\right)_2 \mathrm{Ca}+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O} \\
& -2 \mathrm{CH}_4 \frac{1500^{\circ}}{\text { làm lạn nhanh }} \mathrm{CH} \equiv \mathrm{CH}+3 \mathrm{H}_2 \quad \mathrm{CH} \equiv \mathrm{CH}+\mathrm{HCl} \underset{\mathrm{H}^{\circ}}{\stackrel{\mathrm{HgCl}_2}{\longrightarrow}} \mathrm{CH}_2=\mathrm{CHCl} \text { (vinyl clorua) } \\
& \mathrm{nCH}_2=\mathrm{CHCl} \underset{\mathrm{p}_{\mathrm{cag}} \mathrm{t}^{\circ}}{\mathrm{xtb}}-\left(\mathrm{CH}_2 \mathrm{CHCl}\right)_{\mathrm{n}^{-}}(\mathrm{PVC}) \\
&
\end{aligned}
$$
2. Đun nóng hỗn hợp rượu $\mathrm{X}\left(\mathrm{CH}_4 \mathrm{O}\right)$ và rượu $\mathrm{Y}\left(\mathrm{C}_2 \mathrm{H}_6 \mathrm{O}\right)$ với axit đa chức $\mathrm{Z}\left(\mathrm{C}_2 \mathrm{H}_2 \mathrm{O}_4\right)$ xúc tác $\mathrm{H}_2 \mathrm{SO}_4$ đặc để thực hiện phản ứng este hóa. Trong số các chất hữu cơ thu được, có hai chất hữu cơ $\mathrm{E}$ và $\mathrm{F}$ có cùng $\mathrm{CTPT}$ $\mathrm{C}_4 \mathrm{H}_6 \mathrm{O}_4 \cdot$ a. Viết CTCT của $\mathrm{X}, \mathrm{Y}, \mathrm{Z}$.
b. Viết PTHH của các phản ứng tạo thành $\mathrm{E}, \mathrm{F}$ (viết dạng CTCT)
Hướng dẫn
$\mathrm{X}: \mathrm{CH}_{3} \mathrm{OH} ; \mathrm{Y}: \mathrm{C}_{2} \mathrm{H}_{5} \mathrm{OH} ; \mathrm{Z}:(\mathrm{COOH})_{2} ; \mathrm{E}:\left(\mathrm{COOCH}_{3}\right)_{2} ; \mathrm{F}: \mathrm{HOOC}-\mathrm{COOC}_{2} \mathrm{H}_{5}$
$(\mathrm{COOH})_{2}+2 \mathrm{CH}_{3} \mathrm{OH} \underset{\mathrm{H}_{2} \mathrm{SO}_{4(\text { dăc })}}{\mathrm{t}^{\circ}}\left(\mathrm{COOCH}_{3}\right)_{2}+2 \mathrm{H}_{2} \mathrm{O}$
$(\mathrm{COOH})_{2}+\mathrm{C}_{2} \mathrm{H}_{5} \mathrm{OH} \underset{\mathrm{H}_{2} \mathrm{SO}_{4(d a ̆ c)}}{\mathrm{t}^{\circ}} \mathrm{HOOC}-\mathrm{COOC}_{2} \mathrm{H}_{5}+\mathrm{H}_{2} \mathrm{O}$
Câu 4: (3,0 điểm)
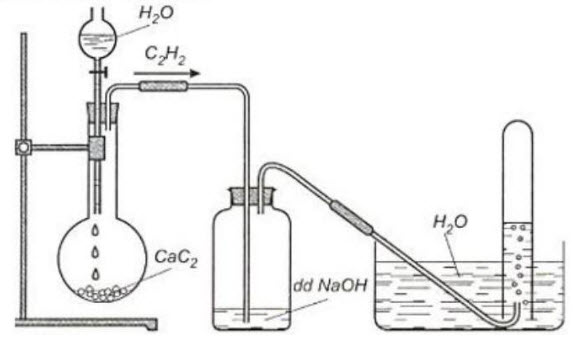
a. Viết PTHH của phản ứng điều chế axetilen trong thí nghiệm trên.
b. Viết PTHH có thể xảy ra trong bình đựng dung dịch $\mathrm{NaOH}$
Nêu và giải thích phương pháp thu khí axetilen trong thí nghiệm trên.
Hướng dẫn
$\mathrm{CaC}_{2}+2 \mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{Ca}(\mathrm{OH})_{2}+\mathrm{CH} \equiv \mathrm{CH} \quad \mathrm{SO}_{2}+2 \mathrm{NaOH} \rightarrow \mathrm{Na}_{2} \mathrm{SO}_{3}+\mathrm{H}_{2} \mathrm{O} \quad \mathrm{CO}_{2}+2 \mathrm{NaOH} \rightarrow \mathrm{Na}_{2} \mathrm{CO}_{3}+\mathrm{H}_{2} \mathrm{O}$ Khí axetilen đi ra khỏi bình cầu thường lẫn tạp khí $\mathrm{CO}_{2}, \mathrm{SO}_{2}, \mathrm{H}_{2} \mathrm{~S}$ nên dẫn qua dung dịch $\mathrm{NaOH}$ để loại bỏ các tạp khí. Axetilen không tan trong nước nên dùng phương pháp đẩy nước để thu khí có độ tinh khiết cao.
2. Dùng kiến thức hóa học, viết PTHH của các phản ứng xảy ra và giải thích:
– Dùng thuốc Antacid [chứa $\mathrm{NaHCO}_{3}, \mathrm{Al}(\mathrm{OH})_{3}$ ] để chữa đau dạ dày (có triệu chứng ợ chua).
– Trong công nghiệp: để sản xuất $\mathrm{CuSO}_{4}$ người ta cho $\mathrm{Cu}$ tác dụng với dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ loãng và liên tục sục
khí $\mathrm{O}_{2}$ vào. Không cho $\mathrm{Cu}$ tác dụng với $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc, nóng.
– Để sản xuất $\mathrm{KClO}_{3}$ người ta cho $\mathrm{Cl}_{2}$ tác dụng với dung dịch $\mathrm{Ca}(\mathrm{OH})_{2}$ đun nóng, sau đó thêm $\mathrm{KCl}$ rồi để nguội thì $\mathrm{KClO}_{3}$ được tách ra. Không cho $\mathrm{Cl}_{2}$ tác dụng với dung dịch $\mathrm{KOH}$ đặc nóng.
Hướng dẫn
– Dạ dày chứa axit $\mathrm{HCl}: \mathrm{NaHCO}_{3}+\mathrm{HCl} \rightarrow \mathrm{NaCl}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O} \quad \mathrm{Al}(\mathrm{OH})_{3}+3 \mathrm{HCl} \rightarrow \mathrm{AlCl}_{3}+3 \mathrm{H}_{2} \mathrm{O}$
– Cách 1: $\mathrm{Cu}+0,5 \mathrm{O}_{2}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{CuSO}_{4}+\mathrm{H}_{2} \mathrm{O} \quad$ Cách 2: $\mathrm{Cu}+2 \mathrm{H}_{2} \mathrm{SO}_{4(\mathrm{dan})} \rightarrow \mathrm{CuSO}_{4}+\mathrm{SO}_{2}+2 \mathrm{H}_{2} \mathrm{O}$
Cách 1 tiết kiệm $\mathrm{H}_{2} \mathrm{SO}_{4}$ và không thoát ra khí độc $\mathrm{SO}_{2}$.
– Cách 1: $\mathrm{Cl}_{2}+\mathrm{Ca}(\mathrm{OH})_{2} \rightarrow \mathrm{CaOCl}_{2}+\mathrm{H}_{2} \mathrm{O} \quad \mathrm{KCl}+3 \mathrm{CaOCl}_{2} \rightarrow \mathrm{KClO}_{3}+3 \mathrm{CaCl}_{2}$
Cách 2: $\mathrm{Cl}_{2}+6 \mathrm{KOH} \rightarrow 5 \mathrm{KCl}+\mathrm{KClO}_{3}+3 \mathrm{H}_{2} \mathrm{O}$
Nhận thấy cách 2 cần nhiều dung dịch $\mathrm{KOH}$ gây tốn chi phí và sản phẩm có lẫn $\mathrm{KCl}$ nên $\mathrm{KClO}_{3}$ khó kết tinh.
Cách 1 sử dụng nguyên liệu nước vôi giá thành rẻ và dung dịch thu được có $\mathrm{KClO}_{3}$ kết tinh được tách ra.
Câu 5: (4,0 điểm)
1. Hấp thụ hoàn toàn $\mathrm{V}$ lít $\mathrm{CO}_{2}$ vào $600 \mathrm{ml}$ dung dịch $\mathrm{KOH} 1 \mathrm{M}$ thu được dung dịch $\mathrm{X}$. Nhỏ từ từ đến hết dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ vào $\mathrm{X}$, thu được dung dịch $\mathrm{Y}$ và thoát ra $0,25 \mathrm{~V}$ lít khí. $\mathrm{Y}$ tác dụng với dung dịch $\mathrm{Ba}(\mathrm{OH})_{2}$ dư, thấy xuất hiện 89,22 gam kết tủa (biết các phản ứng xảy ra hoàn toàn, khí đo ở đktc). Tính $\mathrm{V}$.
Hướng dẫn
$\mathrm{TH}_{1}$ : dung dịch $\mathrm{X}$ chứa $\mathrm{KHCO}_{3}, \mathrm{~K}_{2} \mathrm{CO}_{3}$. Giả sử $\mathrm{nCO}_{2}=\mathrm{a}(\mathrm{mol})$. Ta có:
$$
\begin{aligned}
& \mathrm{CO}_{2}+\mathrm{KOH} \rightarrow \mathrm{KHCO}_{3} \quad \mathrm{CO}_{2}+2 \mathrm{KOH} \rightarrow \mathrm{K}_{2} \mathrm{CO}_{3}+\mathrm{H}_{2} \mathrm{O} \\
& (2 \mathrm{a}-0,6) \quad \leftarrow(2 \mathrm{a}-0,6) \quad(0,6-\mathrm{a})(1,2-2 \mathrm{a}) \leftarrow(0,6-\mathrm{a}) \\
& \mathrm{H}_{2} \mathrm{SO}_{4}+2 \mathrm{~K}_{2} \mathrm{CO}_{3} \rightarrow 2 \mathrm{KHCO}_{3}+\mathrm{K}_{2} \mathrm{SO}_{4} \quad \mathrm{H}_{2} \mathrm{SO}_{4}+2 \mathrm{KHCO}_{3} \rightarrow \mathrm{K}_{2} \mathrm{SO}_{4}+2 \mathrm{CO}_{2}+2 \mathrm{H}_{2} \mathrm{O} \\
& (0,3-0,5 \mathrm{a}) \leftarrow(0,6-\mathrm{a})(0,6-\mathrm{a}) \quad(0,3-0,5 \mathrm{a}) \quad 0,125 \mathrm{a} \quad 0,25 \mathrm{a} \quad 0,125 \mathrm{a} \leftarrow 0,25 \mathrm{a} \\
& \mathrm{K}_{2} \mathrm{SO}_{4}+\mathrm{Ba}(\mathrm{OH})_{2} \rightarrow \mathrm{BaSO}_{4}+\mathrm{KOH} \quad \mathrm{KHCO}_{3}+\mathrm{Ba}(\mathrm{OH})_{2} \rightarrow \mathrm{BaCO}_{3}+\mathrm{H}_{2} \mathrm{O} \\
& (0,3-0,375 \mathrm{a}) \rightarrow(0,3-0,375 \mathrm{a}) \quad 0,75 \mathrm{a} \rightarrow \quad 0,75 \mathrm{a}
\end{aligned}
$$
Suy ra: 233.(0,3-0,375a)+197.0,75a $=89,22 \rightarrow \mathrm{a}=0,32 \rightarrow \mathrm{V}=7,168$ (lít).
$\mathrm{TH}_{2}$ : dung dịch $\mathrm{X}$ chứa $\mathrm{KOH}, \mathrm{K}_{2} \mathrm{CO}_{3}$
$$
\begin{aligned}
& \mathrm{CO}_{2}+2 \mathrm{KOH} \rightarrow \mathrm{K}_{2} \mathrm{CO}_{3}+\mathrm{H}_{2} \mathrm{O} \\
& \mathrm{H}_{2} \mathrm{SO}_{4}+2 \mathrm{KOH} \rightarrow \mathrm{K}_{2} \mathrm{SO}_{4}+2 \mathrm{H}_{2} \mathrm{O} \\
& \mathrm{a} \rightarrow \quad 2 \mathrm{a} \quad \mathrm{a} \quad(0,3-\mathrm{a}) \leftarrow(0,6-2 \mathrm{a}) \quad(0,3-\mathrm{a}) \\
& \mathrm{H}_{2} \mathrm{SO}_{4}+2 \mathrm{~K}_{2} \mathrm{CO}_{3} \rightarrow 2 \mathrm{KHCO}_{3}+\mathrm{K}_{2} \mathrm{SO}_{4} \quad \mathrm{H}_{2} \mathrm{SO}_{4}+2 \mathrm{KHCO}_{3} \rightarrow \mathrm{K}_{2} \mathrm{SO}_{4}+2 \mathrm{CO}_{2}+2 \mathrm{H}_{2} \mathrm{O} \\
& 0,5 \mathrm{a} \leftarrow \mathrm{a} \rightarrow \quad \mathrm{a} \quad 0,5 \mathrm{a} \quad 0,125 \mathrm{a} \quad 0,25 \mathrm{a} \quad 0,125 \mathrm{a} \leftarrow 0,25 \mathrm{a} \\
& \mathrm{K}_{2} \mathrm{SO}_{4}+\mathrm{Ba}(\mathrm{OH})_{2} \rightarrow \mathrm{BaSO}_{4}+\mathrm{KOH} \quad \mathrm{KHCO}_{3}+\mathrm{Ba}(\mathrm{OH})_{2} \rightarrow \mathrm{BaCO}_{3}+\mathrm{H}_{2} \mathrm{O} \\
& (0,3-0,375 \mathrm{a}) \rightarrow(0,3-0,375 \mathrm{a}) \quad 0,75 \mathrm{a} \rightarrow \quad 0,75 \mathrm{a}
\end{aligned}
$$
Suy ra: 233.(0,3 $-0,375 \mathrm{a})+197 \cdot 0,75 \mathrm{a}=89,22 \rightarrow \mathrm{a}=0,32 \rightarrow \mathrm{V}=7,168$ (lít) (loại vì $0,3-\mathrm{a}<0)$
Vậy giá trị $\mathrm{V}=7,168$ (lít).
2. Hỗn hợp $\mathrm{E}$ gồm $\mathrm{Fe}, \mathrm{Fe}_{3} \mathrm{O}_{4}, \mathrm{Fe}(\mathrm{OH})_{2}, \mathrm{FeCO}_{3}$ (\% khối lượng của nguyên tố oxi trong $\mathrm{E}$ là $\left.25,287 \%\right)$. Hòa tan hoàn toàn 69,6 gam $\mathrm{E}$ bằng lượng vừa đủ dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ 19,6\%. Sau khi kết thúc phản ứng, thu được dung dịch $\mathrm{F}$ chứa một chất tan $\mathrm{G}$ duy nhất, đồng thời thoát ra 4,8 gam hỗn hợp khí $\mathrm{A}$ có tỉ khối so với $\mathrm{H}_{2}$ bằng 8 . a. Viết PTHH xảy ra. b. Tính \% khối lượng các chất trong E.
c. Khi làm lạnh $\mathrm{F}$ đến $10^{\circ} \mathrm{C}$ thì có 130,66 gam muối $\mathrm{T}$ tách ra khỏi dung dịch. Biết độ tan của $\mathrm{G}$ ở $10^{\circ} \mathrm{C}$ là 20,5. Xác định CTHH của muối T.
Hướng dẫn

$\mathrm{T}$ : $\mathrm{FeSO}_{4} \cdot \mathrm{nH}_{2} \mathrm{O}^{\mathrm{x}(\mathrm{mol})}$ độ tan của $\mathrm{T}$ là 20,5 nên $\mathrm{C} \%$ dung dịch bão hòa: 20,5 : $(20,5+100)=17,012 \%$.
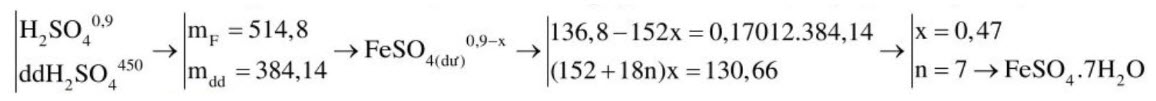
Câu 6: (2,0 điểm)
1. Hỗn hợp $\mathrm{A}$ gồm ba hidrocacbon $\mathrm{X}, \mathrm{Y}, \mathrm{Z}$ đều mạch hở, không phân nhánh, có cùng số nguyên tử cacbon ( $\mathrm{M}_{\mathrm{X}}$ $<\mathrm{M}_{\mathrm{Y}}<\mathrm{M}_{\mathrm{Z}}$ ). Đốt cháy hoàn toàn 0,5 mol $\mathrm{A}$ cần dùng vữa đủ $2,65 \mathrm{~mol}_{2}$ thu được $\mathrm{CO}_{2}$ và $\mathrm{H}_{2} \mathrm{O}$. Mặt khác sục 0,5 mol $\mathrm{A}$ vào bình đựng dung dịch $\mathrm{Br}_{2}$ dư, thấy thoát ra 0,1 mol khí duy nhất (biết các phản ứng hoàn toàn).
a. Xác định CTPT, viết CTCT các chất $\mathrm{X}, \mathrm{Y}, \mathrm{Z}$. b. Tính \% về thể tích của $\mathrm{X}, \mathrm{Y}, \mathrm{Z}$ trong $\mathrm{A}$.
Hướng dẫn
Vì $\mathrm{X}, \mathrm{Y}, \mathrm{Z}$ cùng số $\mathrm{C}$ và có 1 khí thoát ra bình brom nên khí đó là ankan và số $\mathrm{C}_{\mathrm{A}} \leq 4$
Giả sử $\mathrm{A}: \mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}+2-2 \mathrm{k}}+0,5 \cdot(3 \mathrm{n}+1-\mathrm{k}) \mathrm{O}_{2} \rightarrow \mathrm{nCO}_{2}+(\mathrm{n}+1-\mathrm{k}) \mathrm{H}_{2} \mathrm{O}$
$0,5 \rightarrow \quad 2,65$ suy ra: $0,25(3 \mathrm{n}+1-\mathrm{k})=2,65 \rightarrow \mathrm{n}>3$ và $\mathrm{n}=4 ; \mathrm{k}=2,4 \rightarrow \mathrm{C}_{4} \mathrm{H}_{10}: 0,1(\mathrm{~mol})$
$\mathrm{A}:(\mathrm{X}, \mathrm{Y})^{0,4} ; \mathrm{C}_{4} \mathrm{H}_{10} 0^{0,1}$ và $(\mathrm{X}, \mathrm{Y}) \mathrm{C}_{4} \mathrm{H}_{\mathrm{m}}+(4+0,25 \mathrm{~m}) \mathrm{O}_{2} \rightarrow 4 \mathrm{CO}_{2}+0,5 \mathrm{mH}_{2} \mathrm{O}$
$0,4 \rightarrow \quad 2 \quad$ suy ra: $0,4 .(4+0,25 \mathrm{~m})=2 \rightarrow \mathrm{m}=4 \rightarrow \mathrm{C}_{4} \mathrm{H}_{2}$
$\mathrm{C}_{4} \mathrm{H}_{10}: \mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{CH}_{2} \mathrm{CH}_{3} ; \mathrm{C}_{4} \mathrm{H}_{2}: \mathrm{CH} \equiv \mathrm{C}-\mathrm{C} \equiv \mathrm{CH}$
$\mathrm{TH}_{1}:\left|\begin{array}{l}\mathrm{C}_{4} \mathrm{H}_{2}{ }^{\mathrm{x}} \\ \mathrm{C}_{4} \mathrm{H}_{8}{ }^{\mathrm{y}}\end{array} \rightarrow\right| \begin{aligned} & \mathrm{x}+\mathrm{y}=0,4 \\ & 4,5 \mathrm{x}+6 \mathrm{y}=2\end{aligned} \rightarrow \mid \begin{aligned} & \mathrm{x}=4: 15 \\ & \mathrm{y}=2: 15\end{aligned}(\mathrm{tm}) \rightarrow \% \mathrm{~V}: 53,33: 26,67: 20$
$\mathrm{TH}_{2}:\left|\begin{array}{l}\mathrm{C}_{4} \mathrm{H}_{2}{ }^{\mathrm{x}} \\ \mathrm{C}_{4} \mathrm{H}_{6}{ }^{\mathrm{y}}\end{array} \rightarrow\right| \begin{aligned} & \mathrm{x}+\mathrm{y}=0,4 \\ & 4,5 \mathrm{x}+5,5 \mathrm{y}=2\end{aligned} \rightarrow \mid \begin{aligned} & \mathrm{x}=0,2 \\ & \mathrm{y}=0,2\end{aligned}(\mathrm{tm}) \rightarrow \% \mathrm{~V}: 40-40-20$
$\mathrm{C}_{4} \mathrm{H}_{8}: \mathrm{CH}_{2}=\mathrm{CH}-\mathrm{CH}_{2} \mathrm{CH}_{3} ; \mathrm{CH}_{3} \mathrm{CH}=\mathrm{CHCH}_{3}$
$\mathrm{C}_{4} \mathrm{H}_{6}: \mathrm{CH}_{2}=\mathrm{C}=\mathrm{CH}-\mathrm{CH}_{3} ; \mathrm{CH}_{2}=\mathrm{CH}-\mathrm{CH}=\mathrm{CH}_{2} ; \mathrm{CH} \equiv \mathrm{C}-\mathrm{CH}_{2} \mathrm{CH}_{3} ; \mathrm{CH}_{3}-\mathrm{C} \equiv \mathrm{C}-\mathrm{CH}_{3}$
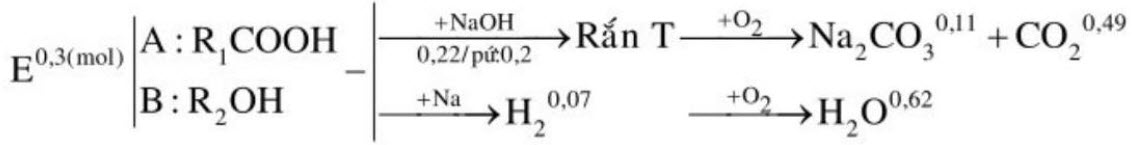
2. Hỗn hợp $\mathrm{E}$ gồm axit hữu cơ $\mathrm{A}$ và rượu no $\mathrm{B}(\mathrm{A}, \mathrm{B}$ đều đơn chức mạch hở, có mạch cacbon không phân nhánh). Lấy 0,9 mol $\mathrm{E}$ đun nóng (xúc tác $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc) thì thu được hỗn hợp $\mathrm{F}$ gồm các chất hữu cơ (giả sử chỉ xảy ra phả ứng este hóa). Chia $\mathrm{F}$ thành ba phần bằng nhau.
– Phần 1: tác dụng hoàn toàn với 50 gam dung dịch $\mathrm{NaOH} 17,6 \%$ (lấy dư $10 \%$ so với lượng phản ứng) rồi cô cạn dung dịch thu được chất rắn $\mathrm{T}$. Đốt cháy hết $\mathrm{T}$ trong $\mathrm{O}_{2}$ dư thu được $\mathrm{Na}_{2} \mathrm{CO}_{3}$ và 21,56 gam $\mathrm{CO}_{2}$.
– Phần 2: tác dụng hết với $\mathrm{Na}$ dư thu được $0,07 \mathrm{~mol} \mathrm{H}_{2}$
– Phần 3: đốt cháy hoàn toàn thu được 11,16 gam $\mathrm{H}_{2} \mathrm{O}$.
Xác định CTPT, viết CTCT của A, B.
Hướng dẫn
Nhận xét: $-\mathrm{OH}_{\text {(ancol, axit) }}+\mathrm{Na} \rightarrow-\mathrm{ONa}+0,5 \mathrm{H}_{2}$ nên $\mathrm{n}(\mathrm{OH}, \mathrm{COOH})_{(\mathrm{E})}=2 \cdot \mathrm{nH}_{2}=0,14$
F: A, B, $-\mathrm{H}_{2} \mathrm{O}$ nên n(A + B) $-\mathrm{n}\left(-\mathrm{H}_{2} \mathrm{O}\right)=\mathrm{n}(\mathrm{OH}, \mathrm{COOH})_{\mathrm{F}} \rightarrow \mathrm{n}\left(-\mathrm{H}_{2} \mathrm{O}\right)_{(\mathrm{F})}=0,16$
BT.C: $\mathrm{nC}_{(\text {Muóí) }}=\mathrm{nNa}_{2} \mathrm{CO}_{3}+\mathrm{nCO}_{2}=0,6 \rightarrow$ Số $\mathrm{C}_{\text {Muói }}=0,6: 0,2=3 \rightarrow$ Muối: $\mathrm{C}_{2} \mathrm{H}_{(1,3,5)} \mathrm{COOH}$