File word Đề thi vào 10 Chuyên Hóa Tỉnh Sơn La – Năm học 2023 – 2024
File word Đề thi vào 10 Chuyên Hóa Tỉnh Sơn La – Năm học 2023 – 2024
Cho nguyên tử khối: H=1: C=12 ; N=14 ; O=16: Na=23; O=16, P=31, K=39
Câu I. (2,0 điểm)
Tiến hành điều chế các chất khí A, B, C trong phòng thí nghiệm bằng các phản ứng sau:
(1) KClO3 (rắn ) $\xrightarrow{{{t}^{o}}}$
(2) MnO2 (rắn) + HCl (đặc) $\xrightarrow{{{t}^{o}}}$ Khí B.
(3) Na2SO3 + H2SO4 (rắn) $\xrightarrow{{{t}^{o}}}$ Khí C.
a) Xác định các khí A, B, C và hoàn thành các phương trình phản ứng trên.
b) Trong các khí trên, khí nào tác dụng với dung dịch NaOH ? Viết các phương trình phản úrng xảy ra.
| 2. Tiến hành thí nghiệm điều chế và thử tính chất của hiđrocacbon X theo hình vẽ và các thí nghiệm sau đây:
– Điều chế X: Mở khóa phễu cho H2O chảy từ từ xuống bình cầu đựng CaC2. – Thử tính chất của X: Thí nghiệm 1: Đốt cháy hoàn toàn X trong không khí. Thí nghiệm 2 : Dẫn X vào bình đựng dung dịch Br2 dư. a) Gọi tên và viết công thức cấu tạo của X. Viết các phương trình phản ứng hóa học xảy ra trong quá trình điều chế và thử tính chất của X. b) Trong phòng thí nghiệm người ta thu khí X bằng phương pháp nào? Tại sao? |
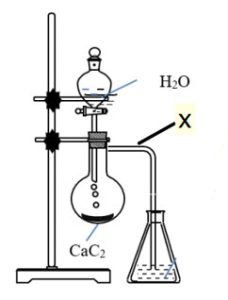 |
Câu II. (2,0 điểm)
Nêu hiện tượng, viết phương trình hóa học xảy ra khi tiến hành các thí nghiệm sau (biết các phản ứng xảy ra hoàn toàn):
a) Cho mẩu nhỏ kim loại Na vào cốc nước.
b) Cho thanh kim loại Fe vào cốc chứa dung dịch $\mathrm{CuSO}_4$.
c) Cho dung dịch $\mathrm{Ba}(\mathrm{OH})_2$ vào dung dịch $\mathrm{Na}_2 \mathrm{CO}_3$.
d) Sục khí SO2 đến dư vào dung dịch brom.
Có 5 dung dịch không màu riêng biệt: $\mathrm{KCl}, \mathrm{KNO}_3, \mathrm{BaCl}_2,\left(\mathrm{NH}_4\right)_2 \mathrm{SO}_4$ và $\mathrm{AlCl}_3$. Hãy trình bày cách nhận biết 5 dung dịch trên bằng phương pháp hóa học. Viết các phương trình phản ứng xảy ra.
Câu III. (2,0 điểm)
Viết các phương trình phản ứng thực hiện dãy chuyền hóa sau (ghi rõ điều kiện, nếu có):
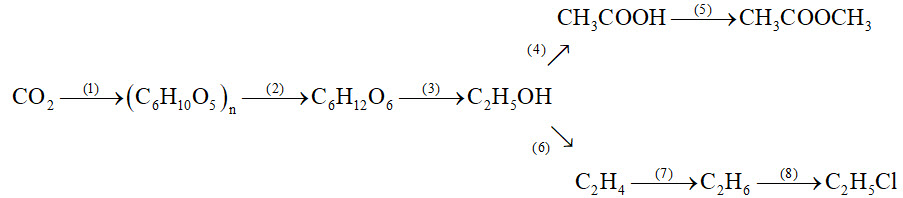
Nhóm chức: Là nhóm nguyên tử hoặc nguyên tử quyết định những tính chất hóa học đặc trưng của hợp chất hữu cơ. Ví dụ: ancol chứa nhóm $-\mathrm{OH}$; axit cacboxylic chứa nhóm – $\mathrm{COOH}$; este chứa nhóm $-\mathrm{COO}-\ldots$
Lưu ý: Ancol bền là hợp chất hũu cơ có nhóm-OH liên kết trực tiếp với nguyên tử cacbon no và mỗi nguyên tử cacbon no chi liên kết vói một nhóm – OH.
Cho A, B là các hợp chất hữu cơ bền, mạch hờ, đều có 2 nguyên tử cacbon và mỗi chất chỉ chứa 1 loại nhóm chức, biết:
– A tác dụng với dung dịch Na2CO3.
– B tác dụng với kim loại Na nhưng không tác dụng với dung dịch NaOH.
a) Hãy xác định công thức cấu tạo có thể có của A, B.
b) Viết các phương trình phản ứng xảy ra.
Câu IV. (2,0 diểm)
Cà phê là một loại cây công nghiệp lâu năm có giá trị kinh tế cao đang được mở rộng diện tích trồng tại Sơn La. Để đảm bảo độ dinh dưỡng của đất, với mỗi hecta đất trồng cà phê, một năm người dân cần cung cấp tối thiểu 200kg Nitơ; 34,93 kg photpho; 166 kg kali và 10 tấn phân chuồng. Loại phân hóa học mà người nông dân sử dụng để bón cho đất trồng cà phê là phân hỗn hợp NPK (16-16-8) trộn với phân kali (độ dinh dưỡng 60%) và phân đạm urê (độ dinh dưỡng 46%).
Biết:
– Kí hiệu 16-16-8 cho ta biết tỉ lệ khối lượng các thành phần của $\mathrm{N}-\mathrm{P}_2 \mathrm{O}_5-\mathrm{K}_2 \mathrm{O}$ trong mẫu phân đó.
– Độ dinh dưỡng của phân đạm, lân và kali được đánh giá bằng $\% m_N, \% m_{P_2 \mathrm{O}_5}$và $\% m_{K_2 \mathrm{O}}$.
a) Tính phần trăm khối lượng các nguyên tố N, P, K có trong phân NPK (16-16-8).
b) Tính tổng khối lượng phân bón hóa học tối thiểu cần cung cấp cho 1 hecta đất trồng cà phê trong một năm.
Tốc độ phản ứng (v) của một phản ứng hóa học là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc chất sản phẩm phản ứng trong một đơn vị thời gian. Tốc độ trung bình của một phản ứng ($\overline{v}$) là tốc độ tính trung bình trong một khoảng thời gian phản ứng.
Cho phản ứng tổng quát: $a A+b B \rightarrow m M+n N$
$\bar{v}=-\frac{1}{a}\frac{\Delta {{C}_{A}}}{\Delta t}=-\frac{1}{b}\frac{\Delta {{C}_{B}}}{\Delta t}=\frac{1}{m}\frac{\Delta {{C}_{M}}}{\Delta t}=\frac{1}{n}\frac{\Delta {{C}_{N}}}{\Delta t}$
(trong đó $\Delta C=C_2-C_1, \Delta t=t_2-t_l$, lần lượt là biến thiên nồng độ và biến thiên thời gian tương ứng. C1, C2 là nồng độ của một chất tại thời điểm tương ứng t1 và t2, với t2>t1 ).
a) Xét phản ứng phân hủy $\mathrm{N}_2 \mathrm{O}_5: 2 \mathrm{~N}_2 \mathrm{O}_{5(\mathrm{khi})} \rightarrow 4 \mathrm{NO}_{2(\mathrm{khi})}+\mathrm{O}_{2(\mathrm{khi})}$ Nồng độ của $\mathrm{N}_2 \mathrm{O}_5$ tại thời điểm
t1=0s và t2=100s lần lượt là 0,1563M và 0,1496M. Tính tốc độ trung bình của phản ứng phân hủy $\mathrm{N}_2 \mathrm{O}_5$ trong $100 \mathrm{~s}$ trên (ghi rõ đơn vị).
b) Một trong những yếu tố ảnh hưởng đến tốc độ phản ứng là nhiệt độ. Nhiệt độ càng cao, tốc độ phản ứng càng lớn. Với đa số các phản ứng, khi nhiệt độ tăng $10^{\circ} \mathrm{C}$ thì tốc độ phản ứng tăng từ 2 đến 4 lần. Giá trị $\gamma=2 \div 4$ này được gọi là hệ số nhiệt độ Van’t Hoff.
Mối liên hệ của hệ số nhiệt độ Van’t Hoff với tốc độ và nhiệt độ như sau:
$\frac{v_2}{v_1}=\gamma^{\left(\frac{T_2-T_1}{10}\right)}$
Trong đó, $v_2$ và $v_1$ là tốc độ phản ứng ở nhiệt độ $T_2$ và $T_1$ tương ứng.
Khi để ở nhiệt độ $30^{\circ} \mathrm{C}$, một quả cà chua bị hỏng sau 3 ngày. Khi bảo quản ở trong tủ lạnh (0oC) , quả cà chua đó bị hỏng sau 24 ngày. Nếu bảo quản ở $20^{\circ} \mathrm{C}$ thì quả cà chua sẽ bị hỏng sau bao nhiêu ngày?
Câu V. (2,0 điểm)
Hòa tan $\mathrm{m}$ gam ancol etylic (rượu etylic) vào 207 gam nước tạo thành dung dịch A. Cho kim loại $\mathrm{Na}$ dư vào dung dịch A, sau khi phản ứng xảy ra hoàn toàn thu được 155,68 lít khí H2 (đktc).
a) Tính độ rượu của dung dịch A.
Biết: khối lượng riêng của ancol etylic nguyên chất là 0,8g/ml, khối luợng riêng của nước là 1,0g/ml.
b) Lây $\frac{1}{10} \mathrm{~m}$ gam ancol etylic ở trên trộn với axit $\mathrm{C}_{\mathrm{x}} \mathrm{H}_{\mathrm{y}} \mathrm{COOH}$ thu được hỗn hợp $\mathrm{X}$. Đun nóng hỗn hợp $\mathrm{X}$ với dung dịch H2SO4 đặc để thực hiện phản ứng este hóa thu được 29,94 gam hỗn hợp $\mathrm{Y}$ gồm axit, ancol và este. Cho 29,94 gam Y tác dụng vừa đủ với $300 \mathrm{ml}$ dung dịch NaOH 1M, sau phản ứng thu được 28,2 gam muối. Xác định công thức cấu tạo của axit và tính hiệu suất phản ứng este hóa.
Trong điều kiện nhiệt độ, xúc tác và áp xuất thích hợp axetilen có thể tham gia phản ứng trime hóa tạo ra benzen như sau:
| $3\text{HC}\equiv \text{CH}\xrightarrow[60-{{70}^{{}^\circ }}\text{C},15~\text{atm}]{\text{Ni}{{\left[ {{\left( {{\text{C}}_{6}}{{\text{H}}_{5}} \right)}_{3}}\text{P} \right]}_{2}}{{(\text{CO})}_{2}}}$ | 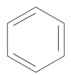 |
Các đồng đẳng của axetilen và cả dẫn xuất của chúng cũng bị trime hóa. Khi tiến hành trime hóa trong điều kiện thích hợp chất $\mathrm{X}$ có công thức cấu tạo $\mathrm{HC} \equiv \mathrm{C}-\mathrm{CH}_2-\mathrm{OH}$ thu được 2 sản phẩm hữu cơ có chứa vòng benzen. Hãy viết công thức cấu tạo của 2 sản phẩm hữu cơ đó.
—————————- Hết ————————–





