File word Đề thi vào 10 Chuyên Hóa ĐHSP Vinh – Nghệ An – Năm học 2023
File word Đề thi vào 10 Chuyên Hóa ĐHSP Vinh – Nghệ An – Năm học 2023
Câu 1: (3,0 điểm)
1. Viết PTHH xảy ra trong các thí nghiệm sau:
– Cho khí $\mathrm{H}_2$ cháy trong khí $\mathrm{Cl}_2 \quad$
– Đốt $\mathrm{FeS}_2$ trong khí $\mathrm{O}_2$
– Sục từ từ đến dư khí $\mathrm{CO}_2$ vào nước vôi trong
– Cho dung dịch $\mathrm{NaHCO}_3$ vào dung dịch $\mathrm{NaHSO}_4$
2. Khí $\mathrm{CO}$ không màu, không mùi nên khó phát hiện. Nếu hít phải lượng lớn khí $\mathrm{CO}$ vào cơ thể, gây nên tình trạng thiếu oxi trong màu, nguy cơ ngộ độc và tử vong rất cao. Em hãy nêu trường hợp trong thực tế có thể sinh ra khí $\mathrm{CO}$. Viết các $\mathrm{PTHH}$ xảy ra và đề xuất biện pháp phòng tránh ngộ độc khí $\mathrm{CO}$.
Hướng dẫn
$$
\begin{aligned}
& \text { 1. } \mathrm{H}_2+\mathrm{Cl}_2 \stackrel{t^{\circ}}{\longrightarrow} 2 \mathrm{HCl} \quad 4 \mathrm{FeS}_2+11 \mathrm{O}_2 \stackrel{t^{\circ}}{\longrightarrow} 2 \mathrm{Fe}_2 \mathrm{O}_3+8 \mathrm{SO}_2 \quad \mathrm{NaHCO}_3+\mathrm{NaHSO}_4 \rightarrow \mathrm{Na}_2 \mathrm{SO}_4+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O} \\
& \mathrm{CO}_2+\mathrm{Ca}(\mathrm{OH})_2 \rightarrow \mathrm{CaCO}_3+\mathrm{H}_2 \mathrm{O} \quad \mathrm{CO}_2+\mathrm{CaCO}_3+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{Ca}\left(\mathrm{HCO}_3\right)_2
\end{aligned}
$$
2. Vào mùa đông, nhiều gia đình vùng núi cao thường đốt than tổ ong trong phòng ngủ để chống rét. Than cháy chậm trong điều kiện thiểu oxi tạo ra khí CO, gây ngạt, hôn mê, nghiêm trọng có thể tử vong. Tình huống khác là trong các hầm lò khai thác than, có các túi khí metan, cacbon oxit gây nguy hiểm cho công nhân khai thác. Biện pháp phòng tránh: đảm bảo không gian sinh hoạt, làm việc luôn lưu thông khí tốt, sử dụng quạt, mở cửa. Câu 2: $(3,0$ điểm $)$
1. Nêu hiện tượng, viết các PTHH xảy ra trong các thí nghiệm sau:
– Cho hỗn hợp $\mathrm{Cu}$ và $\mathrm{Fe}_3 \mathrm{O}_4$ (tỉ lệ mol $1: 1$ ) vào dung dịch $\mathrm{HCl}$ dư.
– Cho dung dịch $\mathrm{AgNO}_3$ dư vào dung dịch $\mathrm{FeCl}_2$ – Cho mẩu kim loại $\mathrm{Ba}$ vào dung dịch $\mathrm{CuSO}_4$
2. Cho hỗn hợp bột $\mathrm{Ag}, \mathrm{Al}, \mathrm{Fe}$ và $\mathrm{Cu}$. Nêu phương pháp để thu được kim loại $\mathrm{Al}$ và $\mathrm{Ag}$ tính khiết mà không làm thay đổi khối lượng của chúng trong hỗn hợp ban đầu. Viết các PTHH xảy ra. Giả thiết các hóa chất và điều kiện cần thiết khác đủ, hiệu suất cả quá trình đạt $100 \%$.
Hướng dẫn
1. Hỗn hợp $\left(\mathrm{Cu}, \mathrm{Fe}_3 \mathrm{O}_4\right)$ tan hết trong dung dịch $\mathrm{HCl}$ dư, tạo dung dịch màu xanh nhạt:
$$
\mathrm{Fe}_3 \mathrm{O}_4+8 \mathrm{HCl} \rightarrow \mathrm{FeCl}_2+2 \mathrm{FeCl}_3+4 \mathrm{H}_2 \mathrm{O} \quad \mathrm{Cu}+2 \mathrm{FeCl}_3 \rightarrow \mathrm{CuCl}_2+2 \mathrm{FeCl}_2
$$
– Cho dung dịch $\mathrm{AgNO}_3$ vào dung dịch $\mathrm{FeCl}_2$ ta thấy xuất hiện kết tủa trắng, dung dịch màu xanh nhạt chuyển thành màu vàng: $3 \mathrm{AgNO}_3+\mathrm{FeCl}_2 \rightarrow \mathrm{Fe}\left(\mathrm{NO}_3\right)_3+2 \mathrm{AgCl}+\mathrm{Ag}$
– Cho mẩu kim loại $\mathrm{Ba}$ vào dung dịch $\mathrm{CuSO}_4$, quan sát thấy phản ứng xảy ra mãnh liệt, thoát nhiều khí không màu không mùi, đồng thời xuất hiện kết tủa xanh lam và trắng: $\mathrm{Ba}+2 \mathrm{H}_2 \mathrm{O}+\mathrm{CuSO}_4 \rightarrow \mathrm{BaSO}_4+\mathrm{Cu}(\mathrm{OH})_2+\mathrm{H}_2$
Câu 3: (3,0 điểm)
1. Một học sinh tiến hành thí nghiệm như sau: cho nước vào ống nghiệm có nhánh chứa sẵn đất đèn $\mathrm{CaC}_2$, đậy kín miệng ống nghiệm bằng nút cao su. Khí thoát ra dẫn qua ống nghiệm chứa dung dịch brom. Hãy nêu hiện tượng quan sát được và viết các $\mathrm{PTHH}$ xảy ra.
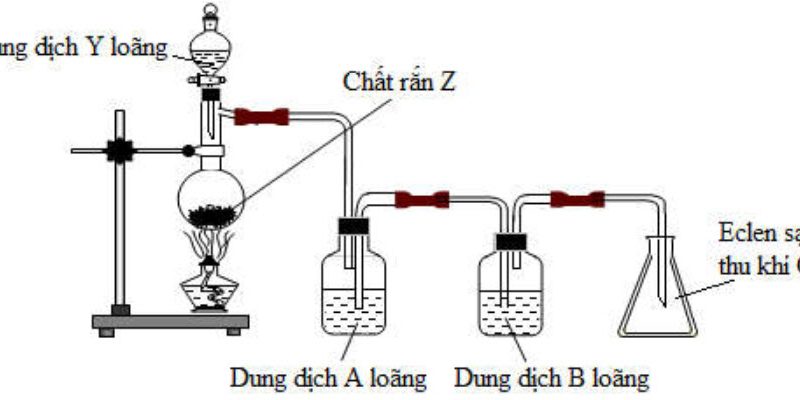
2. Thí nghiệm điều chế khí $\mathrm{CO}_2$ từ đá vôi và dung dịch $\mathrm{X}_1$ chứa $\mathrm{HCl}$ được mô tả bằng hình vẽ dưới đây:
a. Biết dung dịch $\mathrm{X}_2, \mathrm{X}_3$ có tác dụng loại bỏ các tạp chất để thu được khí $\mathrm{CO}_2$ khô, sạch. Trong các hóa chất: $\mathrm{NaHSO}_3, \mathrm{H}_2 \mathrm{SO}_4$ đặc, $\mathrm{NaHCO}_3$ chất nào phù hợp và không phù hợp dùng làm $\mathrm{X}_2, \mathrm{X}_3$. Hãy giải thích.
b. Giải thích phương pháp thu khí $\mathrm{CO}_2$ như hình trên. Nêu cách để nhận biết $\mathrm{CO}_2$ thu được đã đầy bình. Có thể sử dụng thêm các hóa chất, thiết bị, vật dụng trong phòng thí nghiệm.
Hướng dẫn
1. $\mathrm{CaC}_2+2 \mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{Ca}(\mathrm{OH})_2+\mathrm{CH} \equiv \mathrm{CH}$ dẫn khí $\mathrm{C}_2 \mathrm{H}_2$ vào nước brom thấy nước brom (nâu) bị nhạt màu.
$\mathrm{CH} \equiv \mathrm{CH}+\mathrm{Br}_2 \rightarrow \mathrm{CH}(\mathrm{Br})=\mathrm{CH}(\mathrm{Br}) \quad \mathrm{CH} \equiv \mathrm{CH}+\mathrm{Br}_2 \rightarrow \mathrm{CH}\left(\mathrm{Br}_2\right) \mathrm{CH}\left(\mathrm{Br}_2\right)$
2. $\mathrm{X}_2: \mathrm{NaHCO}_3$ hấp thụ hơi $\mathrm{HCl}, \mathrm{X}_3: \mathrm{H}_2 \mathrm{SO}_4$ đặc để hấp thụ hơi nước.
$\mathrm{NaHSO}_3$ hấp thụ hơi $\mathrm{HCl}$ tạo tạp khí $\mathrm{SO}_2$ nên không phù hợp.
Thu khí $\mathrm{CO}_2$ bằng phương pháp đẩy khí, để nhận biết khí $\mathrm{CO}_2$ đầy bình hay chưa ta đặt giấy quỳ tím ẩm ở miệng bình, khi $\mathrm{CO}_2$ đầy bình thì giấy quỳ chuyển màu đỏ nhạt.
Câu 4: (2,0 điểm)
1. Nêu phương pháp để phân biệt sáu chất lỏng và dung dịch riêng biệt đựng trong sáu lọ không dán nhãn : rượu etylic, dung dịch axit axetic, dung dịch glucozo, etyl axetat, hồ tinh bột, dung dịch lòng trắng trứng.
2. Cho sơ đồ chuyển hóa sau : $X_1 \stackrel{\text { (1) }}{\longrightarrow} X_2 \stackrel{(2)}{\longrightarrow} X_3 \stackrel{(3)}{\longrightarrow} X_4 \stackrel{(4)}{\longrightarrow} X_5 \stackrel{\text { (5) }}{\longrightarrow} \mathrm{C}_4 \mathrm{H}_8 \mathrm{O}_2$
Biết $X_1$ là thành phần chính của khí thiên nhiên ; $X_2, X_3, X_4, X_5$ là các hợp chất hữu cơ đều có hai nguyên tử cacbon. Xác định các chất (viết dưới dạng CTCT) $\mathrm{X}_1, \mathrm{X}_2 \ldots \mathrm{X}_5$ và viết các $\mathrm{PTHH}$ xảy ra trong sơ đồ trên.
Hướng dẫn
1. Lấy mẫu từng chất lỏng, đánh số thứ tự để thuận tiện đối chiếu kết quả thực nghiệm.
– Cho $\mathrm{NaHCO}_3$ vào từng mẫu, mẫu có khí không màu là: $\mathrm{CH}_3 \mathrm{COOH}+\mathrm{NaHCO}_3 \rightarrow \mathrm{CH}_3 \mathrm{COONa}^2+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O}$
– Cho Iot vào các mẫu còn lại, mẫu chuyển màu tím đen là hồ tinh bột.
– Cho dung dịch $\mathrm{Cu}(\mathrm{OH})_2 / \mathrm{OH}^{-}$vào từng mẫu, mẫu tạo phức xanh lam là glucozo, mẫu cho phản ứng màu biure (màu tím) là dung dịch lòng trắng trứng.
$$
\text { 2. } \mathrm{X}_1: \mathrm{CH}_4 \rightarrow \mathrm{X}_2: \mathrm{CH} \equiv \mathrm{CH} \rightarrow \mathrm{X}_3: \mathrm{CH}_2=\mathrm{CH}_2 \rightarrow \mathrm{X}_4: \mathrm{C}_2 \mathrm{H}_5 \mathrm{OH} \rightarrow \mathrm{X}_5: \mathrm{CH}_3 \mathrm{COOH} \rightarrow \mathrm{CH}_3 \mathrm{COOC}_2 \mathrm{H}_5
$$
$$
2 \mathrm{CH}_4 \frac{1500^{\circ}}{\text { làm lạnh nhanh }} \mathrm{CH} \equiv \mathrm{CH}+3 \mathrm{H}_2
$$
$$
\mathrm{CH} \equiv \mathrm{CH}+\mathrm{H}_2 \underset{\mathrm{t}^{\circ}}{\stackrel{\mathrm{Pd}}{\longrightarrow}} \mathrm{CH}_2=\mathrm{CH}_2 \quad \mathrm{CH}_2=\mathrm{CH}_2+\mathrm{H}_2 \mathrm{O} \stackrel{\mathrm{H}_2 \mathrm{SO}_{4(1)}}{\mathrm{t}^{\circ}} \mathrm{C}_2 \mathrm{H}_5 \mathrm{OH}
$$
$$
\mathrm{C}_2 \mathrm{H}_5 \mathrm{OH}+\mathrm{O}_2 \underset{\text { giấm }}{\stackrel{\text { men }}{\longrightarrow}} \mathrm{CH}_3 \mathrm{COOH}+\mathrm{H}_2 \mathrm{O}
$$
$$
\mathrm{CH}_3 \mathrm{COOH}+\mathrm{C}_2 \mathrm{H}_5 \mathrm{OH} \stackrel{\mathrm{H}_2 \mathrm{SO}_{4(\mathrm{dăc})}}{t^{\circ}} \mathrm{CH}_3 \mathrm{COOC}_2 \mathrm{H}_5+\mathrm{H}_2 \mathrm{O}
$$
Câu 5: (2,0 điểm)
1. Cho $200 \mathrm{ml}$ dung dịch $\mathrm{Ba}(\mathrm{OH})_2 1 \mathrm{M}$ tác dụng với $300 \mathrm{ml}$ dung dịch $\mathrm{NaHCO}_3 1 \mathrm{M}$, sau phản ứng thu được $\mathrm{m}$ gam kết tủa và dung dịch $\mathrm{X}$. Cho từ từ dung dịch $\mathrm{HCl} 2 \mathrm{M}$ vào dung dịch $\mathrm{X}$ và khuấy đều đến khi bắt đầu xuất hiện bọt khí thì dừng lại, quá trình dùng hết $\mathrm{V} \mathrm{ml}$ dung dịch $\mathrm{HCl}$. Tính $\mathrm{m}$ và $\mathrm{V}$ (Các phản ứng xảy ra hoàn toàn). Hướng dẫn
Nhận xét: $\mathrm{nNaHCO} \mathrm{OH}_3: \mathrm{nBa}(\mathrm{OH})_2=1,5$ nên xảy ra đồng thời hai quá trình:
$$
\begin{aligned}
& \mathrm{Ba}(\mathrm{OH})_2+\mathrm{NaHCO}_3 \rightarrow \mathrm{BaCO}_3+\mathrm{NaOH}+\mathrm{H}_2 \mathrm{O} \quad \mathrm{Ba}(\mathrm{OH})_2+2 \mathrm{NaHCO}_3 \rightarrow \mathrm{BaCO}_3+\mathrm{Na}_2 \mathrm{CO}_3+\mathrm{H}_2 \mathrm{O} \\
& \mathrm{a} \rightarrow \quad \mathrm{a} \quad \mathrm{a} \quad \mathrm{a} \quad \mathrm{b} \quad \mathrm{b} \quad \mathrm{b} \quad \mathrm{b} \\
& \text { Ta có }\left|\begin{array}{l}
\mathrm{a}+\mathrm{b}=0,2 \\
\mathrm{a}+2 \mathrm{~b}=0,3
\end{array} \rightarrow\right| \begin{array}{l}
\mathrm{a}=0,1 \\
\mathrm{~b}=0,1
\end{array} \rightarrow \mathrm{X}\left|\begin{array}{l}
\mathrm{NaOH}^{0,1} \\
\mathrm{Na}_2 \mathrm{CO}_3^{0,1}
\end{array} \rightarrow\right| \begin{array}{l}
\mathrm{n}_{\mathrm{HCl}}=\mathrm{n}_{\mathrm{NaOH}}+\mathrm{n}_{\mathrm{Na}_2 \mathrm{CO}_3}=0,2 \\
\rightarrow \mathrm{V}=0,1(\text { lít })=100(\mathrm{ml})
\end{array} \\
&
\end{aligned}
$$
2. Cho 1,76 gam hỗn hợp $\mathrm{A}$ gồm $\mathrm{Fe}, \mathrm{Cu}$ tác dụng hoàn toàn với dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ đặc, nóng dư sau phản ứng thu được khí $\mathrm{SO}_2$ (sản phẩ khử duy nhất). Dùng một lượng dung dịch $\mathrm{NaOH}$ tối thiểu để hấp thụ vừa hết lượng khí $\mathrm{SO}_2$ ở trên thì thu được dung dịch chứa 4,16 gam muối. Cho 1,76 gam A tác dụng với dung dịch chứa $0,07 \mathrm{~mol}$ $\mathrm{FeCl}_3$, sau phản ứng thu được dung dịch $\mathrm{B}$. Cho $1,125 \mathrm{~m}$ gam $\mathrm{Mg}$ tác dụng hết với dung dịch $\mathrm{B}$, thu được $\mathrm{m}$ gam kim loại. Biết các phản ứng xảy ra hoàn toàn. Tính $\mathrm{m}$.
Hướng dẫn
Câu 6: (2,0 điểm)
1. Đốt cháy hoàn toàn 4,48 lít (đktc) hỗn hợp $\mathrm{M}$ gồm hai hidrocacbon $\mathrm{X}, \mathrm{Y}\left(\mathrm{M}_{\mathrm{X}}<\mathrm{M}_{\mathrm{Y}}\right)$ cần dùng vừa đủ 9,52 lít $\mathrm{O}_2$ (đktc). Sản phẩm cháy cho hấp thụ hết vào bình đựng dung dịch $\mathrm{Ba}(\mathrm{OH})_2$. Sau khi các phản ứng xảy ra hoàn toàn, thu được 29,55 gam kết tủa và một dung dịch có khối lượng giảm 12,25 gam so với khối lượng dung dịch $\mathrm{Ba}(\mathrm{OH})_2$ ban đầu. a. Xác định CTPT của X, Y. b. Để đun sôi 2 lít nước trong ấm nhôm (có nhiệt độ ban đầu là $25^{\circ} \mathrm{C}$ ) cần cung cấp một nhiệt lượng là $663 \mathrm{~kJ}$. Đốt cháy hoàn toàn $\mathrm{m}$ gam hidrocacbon $\mathrm{X}$ thì nhiệt lượng tỏa ra vừa đủ để đun sôi ẩm nước ở trên. Biết hiệu suất sử dụng nhiệt lượng là $62,08 \%$ và khi đốt cháy hoàn toàn $1 \mathrm{~mol} \mathrm{X}$ thì nhiệt lượng tỏa ra là $890 \mathrm{~kJ}$. Tính $\mathrm{m}$.
Hướng dẫn
Khối lượng dung dịch $\mathrm{Ba}(\mathrm{OH})_2$ giảm $=\mathrm{mBaCO}_3-\mathrm{m}\left(\mathrm{CO}_2, \mathrm{H}_2 \mathrm{O}\right) \rightarrow \mathrm{m}\left(\mathrm{CO}_2, \mathrm{H}_2 \mathrm{O}\right)=17,3$ gam.
a. $\mathrm{Mol}\left|\begin{array}{l}\mathrm{CO}_2{ }^{\mathrm{a}} \\ \mathrm{H}_2 \mathrm{O}^{\mathrm{b}}\end{array} \rightarrow\right| \begin{aligned} & \stackrel{\text { вт.o }}{\rightarrow} 2 \mathrm{a}+\mathrm{b}=0,85 \\ & 44 \mathrm{a}+18 \mathrm{~b}=17,3\end{aligned} \rightarrow\left|\begin{array}{l}\mathrm{a}=0,25 \\ \mathrm{~b}=0,35\end{array} \rightarrow\right| \begin{aligned} & \text { Số } \mathrm{C}_{\mathrm{M}}=0,25: 0,2=1,25 \rightarrow \mathrm{X}: \mathrm{CH}_4 \\ & \mathrm{Số}_{\mathrm{M}} \mathrm{H}_{\mathrm{M}}=2.0,35: 0,2=3,5 \rightarrow \mathrm{Y}: \mathrm{C}_2 \mathrm{H}_2 \text { hoặc } \mathrm{C}_4 \mathrm{H}_2\end{aligned}$
b. Giá trị của $\mathrm{m}=\frac{663.16}{62,08 \% .890}=19,2(\mathrm{gam})$
2. Hỗn hợp $\mathrm{E}$ gồm hai este mạch hở $\mathrm{X}, \mathrm{Y}\left(\mathrm{M}_{\mathrm{X}}<\mathrm{M}_{\mathrm{Y}}\right)$. Cho 23,1 gam $\mathrm{E}$ tác dụng vừa đủ với dung dịch chứa 0,3 mol $\mathrm{NaOH}$ thu được hỗn hợp $\mathrm{F}$ gồm hai muối của hai axit cacboxylic có tỉ lệ mol $1: 1$ và hồn hợp $\mathrm{Q}$ gồm hai rượu no, mạch hở, có cùng số nguyên tử cacbon trong phân tử. Đốt cháy hoàn toàn $\mathrm{Q}$, thu được 11,2 lít khí $\mathrm{CO}{ }_2$ (đktc) và 13,5 gam $\mathrm{H}_2 \mathrm{O}$. a. Xác định $\mathrm{CTCT}$ của $\mathrm{X}$ và $\mathrm{Y}$.
b. Tính \% khối lượng của $\mathrm{X}, \mathrm{Y}$ trong $\mathrm{E}$.
Hướng dẫn
$$
\begin{aligned}
& \stackrel{23,1 \mathrm{~g}}{\stackrel{2}{*} \mathrm{R}_2}\left|\begin{array}{l}
0,1 \mathrm{R}_1+0,1 \mathrm{R}_2=2,7 \\
\mathrm{R}_1+\mathrm{R}_2=27
\end{array} \rightarrow\right| \begin{array}{l}
\mathrm{R}_1=26 \rightarrow \mathrm{C}_2 \mathrm{H}_2 \\
\mathrm{R}_2=1 \rightarrow \mathrm{H}
\end{array} \rightarrow \mathrm{E} \mid \begin{array}{l}
\mathrm{C}_2 \mathrm{H}_2\left(\mathrm{COOC}_2 \mathrm{H}_5\right)^{0,1}: 74,46 \% \\
(\mathrm{HCOO})_2 \mathrm{C}_2 \mathrm{H}_4^{0,05}: 25,54 \%
\end{array} \\
&
\end{aligned}
$$