Đề thi HSG Hóa 9 – Hà Nội – Năm học 2021 – 2022
Đề thi HSG Hóa 9 – Hà Nội – Năm học 2021 – 2022
Câu I (4,0 điểm)
1. Nêu hiện tượng và viết phương trình hóa học xảy ra trong các thí nghiệm sau:
a) Dẫn từ từ đến dư khí $\mathrm{CO}_{2}$ vào dung dịch nước vôi trong.
b) Cho hỗn hợp rắn gồm $\mathrm{Na}$ và $\mathrm{Al}_{2} \mathrm{O}_{3}$ có tỷ lệ mol tương ứng là $1: 1$ vào nước dư.
c) Cho từ từ dung dịch $\mathrm{K}_{2} \mathrm{~S}$ vào dung dịch $\mathrm{FeCl}_{3}$.
d) Dẫn từ từ đến dư khí $\mathrm{SO}_{2}$ vào dung dịch nước brom.
2. Cho hỗn hợp rắn gồm các chất $\mathrm{MgCO}_{3}, \mathrm{CuO}, \mathrm{NaCl}$. Lập sơ đồ, viết các phương trình hóa học điều chế các kim loại $\mathrm{Mg}, \mathrm{Cu}, \mathrm{Na}$ riêng biệt sao cho không làm thay đổi khối lượng các kim loại trong hỗn hợp ban đầu. Các điều kiện và dụng cụ cần thiết có đủ.
Câu II (4,0 điểm)
1. Giải thích vì sao:
a) Khí clo được dùng để khử trùng nước sinh hoạt, nước bể bơi.
b) Dây dẫn điện cao thế thường được làm bằng nhôm còn dây dẫn điện trong nhà thường được làm bằng đồng.
2. Cho $X_{1}, X_{2}, X_{3}, X_{4}, X_{5}, X_{6}, Y_{1}, Y_{2}, Y_{3}, Y_{4}, Y_{5}, Y_{6}$ đều là các hợp chất của lưu huỳnh. Tìm các chất và viết phương trình hóa học thực hiện sơ đồ chuyển hóa sau:
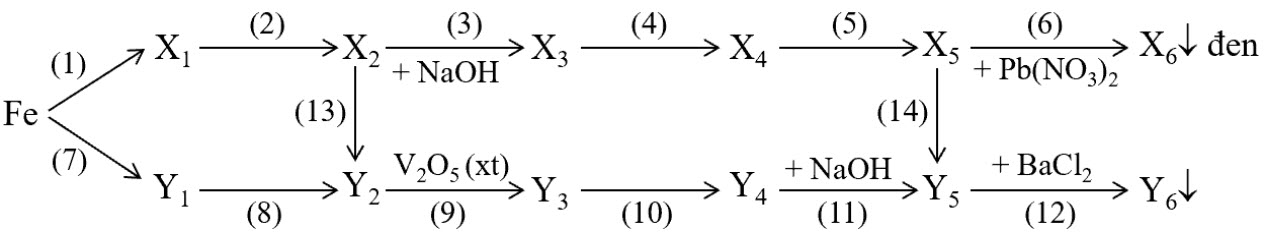
Cho biết: $\mathrm{M}_{\mathrm{X}_{1}}+\mathrm{M}_{\mathrm{Y}_{1}}=240 ; \mathrm{M}_{\mathrm{Y}_{2}}-\mathrm{M}_{\mathrm{X}_{2}}=30 ; \mathrm{M}_{\mathrm{X}_{4}}+\mathrm{M}_{\mathrm{Y}_{4}}=267 ; \mathrm{M}_{\mathrm{X}_{5}}+\mathrm{M}_{\mathrm{Y}_{5}}=220$.
Câu III (4,0 điểm)
1. Khí $X$ không màu, mùi hắc, độc. $X$ được dùng để tẩy trắng bột gỗ trong công nghiệp giấy, diệt nấm mốc… Thí nghiệm điều chế $\mathrm{X}$ từ chất rắn $\mathrm{Y}$ và dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ được mô tả như hình vẽ bên.
a) Xác định các chất $X, Y, Z$ và viết các phương trình hóa học xảy ra.
b) Nêu vai trò của bông tẩm dung dịch $Z$.
c) Có nên thay dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ bằng dung dịch $\mathrm{HCl}$ không? Vì sao?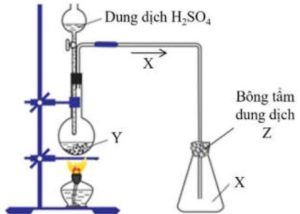
2. Hợp chất $A$ được tạo thành từ 2 nguyên tố $M$ và $X$ có công thức $M_{a} X_{b}$ trong đó $\mathrm{X}$ chiếm $64,615 \%$ về khối lượng. Trong hạt nhân nguyên tử $\mathrm{M}$, số hạt mang điện ít hơn số hạt không mang điện 1 hạt. Trong hạt nhân nguyên tử $\mathrm{X}$, số hạt hai loại bằng nhau. Cho $\mathrm{a}+\mathrm{b}=4$, một phân tử chất A có 32 hạt proton, nguyên tử khối được coi có giá trị bằng tổng số hạt proton và notron trong nguyên tử. Tính số hạt proton có trong mỗi nguyên tử $M$ và $X$.
3. Hỗn hợp $\mathrm{X}$ gồm $\mathrm{x}$ mol $\mathrm{Na}$, $\mathrm{y}$ mol $\mathrm{Zn}$ và $\mathrm{z}$ mol Fe; hỗn hợp $\mathrm{Y}$ gồm 18y gam $\mathrm{Al}$ và $(11,5 \mathrm{x}+28 \mathrm{z})$ gam kim loại $\mathrm{M}$. Hòa tan hoàn toàn $\mathrm{X}$ hoặc $\mathrm{Y}$ bằng lượng dư dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ 0,5 $\mathrm{M}$ đều thu được $\mathrm{V}$ lít khí $\mathrm{H}_{2}$ (đo ở cùng điều kiện nhiệt độ, áp suất).
a) Viết các phương trình hóa học xảy ra.
b) Xác định kim loại $M$.
Câu IV (4,0 điểm)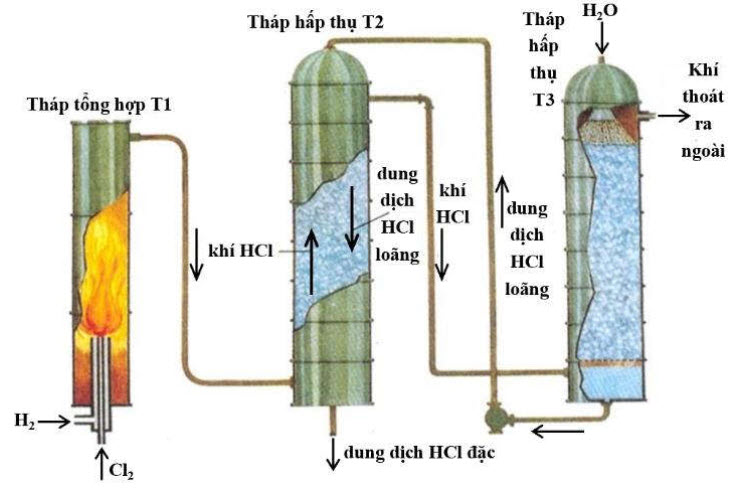
1. Cho sơ đồ tổng hợp axit $\mathrm{HCl}$ (hình bên):
a) Mô tả quá trình tổng hợp axit $\mathrm{HCl}$. Trong quá trình này, khí $\mathrm{HCl}$ được hấp thụ theo nguyên tắc nào?
b) Tính khối lượng $\mathrm{Cl}_{2}$ và $\mathrm{H}_{2}$ cần dùng để tổng hợp được 10 tấn $\mathrm{HCl}$, biết $\mathrm{H}_{2}$ được dùng dư $10 \%$ so với lượng cần thiết và phản ứng xảy ra hoàn toàn.
c) Vì sao người ta dùng dư $\mathrm{H}_{2}$ mà không dùng dư $\mathrm{Cl}_{2}$ ?
2. Dung dịch $X$ chứa $\mathrm{Na}_{2} \mathrm{CO}_{3}$ và $\mathrm{NaOH}$. Dung dịch $Y$ chứa $\mathrm{Ca}\left(\mathrm{HCO}_{3}\right)_{2} 0,25 \mathrm{M}$ và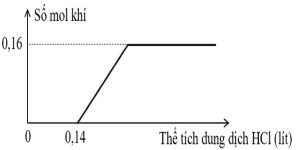 $\mathrm{NaHCO}_{3} 0,25 \mathrm{M}$. Trộn $\mathrm{X}$ và $\mathrm{Y}$ thu được 4 gam kết tủa và $250 \mathrm{ml}$ dung dịch $\mathrm{Z}$. Nhỏ từ từ từng giọt dung dịch $\mathrm{HCl} 1 \mathrm{M}$ vào $250 \mathrm{ml} \mathrm{Z}$, sự phụ thuộc số mol khí vào thể tích dung dịch $\mathrm{HCl}$ được mô tả như đồ thị hình bên. Tính nồng độ mỗi chất tan có trong dung dịch X. Coi thể tích của dung dịch không đổi.
$\mathrm{NaHCO}_{3} 0,25 \mathrm{M}$. Trộn $\mathrm{X}$ và $\mathrm{Y}$ thu được 4 gam kết tủa và $250 \mathrm{ml}$ dung dịch $\mathrm{Z}$. Nhỏ từ từ từng giọt dung dịch $\mathrm{HCl} 1 \mathrm{M}$ vào $250 \mathrm{ml} \mathrm{Z}$, sự phụ thuộc số mol khí vào thể tích dung dịch $\mathrm{HCl}$ được mô tả như đồ thị hình bên. Tính nồng độ mỗi chất tan có trong dung dịch X. Coi thể tích của dung dịch không đổi.
Câu V (4,0 điểm)
1. Hòa $\tan$ hoàn toàn 4,8 gam oxit kim loại $\mathrm{M}$ có hóa trị không đổi trong dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4} 28 \%$ ở nhiệt độ $\mathrm{t}_{1}$ thu được dung dịch $\mathrm{X}$ chỉ chứa 14,4 gam muối.
a) Tìm công thức hóa học của oxit kim loại $\mathrm{M}$.
b) Làm lạnh dung dịch $\mathrm{X}$ xuống nhiệt độ $\mathrm{t}_{2}\left(\mathrm{t}_{2}<\mathrm{t}_{1}\right)$ thấy tách ra 6,15 gam chất rắn và dung dịch $\mathrm{Y}$. Trong $\mathrm{Y}$, oxi chiếm 78,918\% về khối lượng. Tìm công thức hóa học của chất rắn tách ra.
2. Chia $\mathrm{m}$ gam hỗn hợp bột $\mathrm{X}$ gồm $\mathrm{Al}$ và $\mathrm{Fe}_{3} \mathrm{O}_{4}$ thành 2 phần bằng nhau:
– Phần 1: Cho tác dụng với dung dịch $\mathrm{NaOH}$ dư thu được 3,36 lít khí $\mathrm{H}_{2}$.
– Phần 2: Nung nóng trong điều kiện không có không khí thu được hỗn hợp chất rắn Y. Cho Y tác dụng với dung dịch $\mathrm{Z}$ chứa $\mathrm{NaOH}$ dư thu được dung dịch $\mathrm{T}$, phần không tan $\mathrm{E}$ và 0,672 lít khí $\mathrm{H}_{2}$. Phần không tan $\mathrm{E}$ cho tác dụng với dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc, nóng, thu được sản phẩm gồm một muối sắt, $\mathrm{V}$ lít khí $\mathrm{SO}_{2}$ và nước. Các thể tích khí đo ở đktc, các phản ứng xảy ra hoàn toàn.
a) Tính $m$ và $V$.
b) Cho từ từ đến hết $200 \mathrm{ml}$ dung dịch $\mathrm{HCl} 1 \mathrm{M}$ vào dung dịch $\mathrm{T}$ đến khi phản ứng kết thúc thu được 5,46 gam kết tủa. Tính số gam $\mathrm{NaOH}$ có trong dung dịch $\mathrm{Z}$.
Cho: $\mathrm{H}=1 ; \mathrm{C}=12 ; \mathrm{N}=14 ; \mathrm{O}=16 ; \mathrm{F}=19 ; \mathrm{Na}=23 ; \mathrm{Mg}=24 ; \mathrm{Al}=27 ; \mathrm{Si}=28 ; \mathrm{P}=31 ; \mathrm{S}=32$;
$\mathrm{Cl}=35,5 ; \mathrm{K}=39 ; \mathrm{Ca}=40 ; \mathrm{Fe}=56 ; \mathrm{Cu}=64 ; \mathrm{Zn}=65 ; \mathrm{Ag}=108 ; \mathrm{Ba}=137 ; \mathrm{Pb}=207$.