Đề thi HSG Hoá 9 Tỉnh Nghệ An Bảng A – Năm học 2022 – 2023
Đề thi HSG Hoá 9 Tỉnh Nghệ An Bảng A – Năm học 2022 – 2023
Câu 1: (3,0 điểm)
1. Viết phương trình hóa học của các phản ứng xảy ra trong các quá trình sau:
– Dùng dung dịch $\mathrm{Ca}(\mathrm{OH})_2$ dư để loại bỏ khí $\mathrm{SO}_2, \mathrm{CO}_2$ ra khỏi khí thải công nghiệp
– Dùng dung dịch $\mathrm{NaHCO}_3$ để rửa vết bỏng do $\mathrm{NaOH}$ hoặc $\mathrm{H}_2 \mathrm{SO}_4$
– Dùng đá vôi $\mathrm{CaCO}_3$ dùng để sản xuất vôi tôi
– Dung dịch $\mathrm{NaOH}$ để hòa tan $\mathrm{Al}_2 \mathrm{O}_3$ trong quặng boxit (trong quá trình sản xuất nhôm)
2. Nêu hiện tượng và viết phương trình hóa học xảy ra trong các thí nghiệm sau:
– Cho dung dịch $\mathrm{BaCl}_2$ vào dung dịch $\mathrm{Na}_2 \mathrm{SO}_4$
– Nung nóng $\mathrm{Cu}(\mathrm{OH})_2$ trên ngọn lửa đèn cồn
– Sục khí $\mathrm{CO}_2$ dư vào dung dịch muối natri aluminat
Hướng dẫn
1. $-\mathrm{CO}_2+\mathrm{Ca}(\mathrm{OH})_2 \rightarrow \mathrm{CaCO}_3+\mathrm{H}_2 \mathrm{O}$
$$
\begin{aligned}
& \mathrm{SO}_2+\mathrm{Ca}(\mathrm{OH})_2 \rightarrow \mathrm{CaSO}_3+\mathrm{H}_2 \mathrm{O} \\
& 2 \mathrm{NaHCO}_3+\mathrm{H}_2 \mathrm{SO}_4 \rightarrow \mathrm{Na}_2 \mathrm{SO}_4+2 \mathrm{CO}_2+2 \mathrm{H}_2 \mathrm{O} \\
& 2 \mathrm{NaOH}+\mathrm{Al}_2 \mathrm{O}_3 \rightarrow 2 \mathrm{NaAlO}_2+\mathrm{H}_2 \mathrm{O}
\end{aligned}
$$
$$
-\mathrm{NaHCO}_3+\mathrm{NaOH} \rightarrow \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{H}_2 \mathrm{O}
$$
$$
-\mathrm{CaCO}_3 \stackrel{\mathrm{t}^{\circ}}{\longrightarrow} \mathrm{CaO}+\mathrm{CO}_2
$$
2. – Cho dung dịch $\mathrm{BaCl}_2$ vào dung dịch $\mathrm{Na}_2 \mathrm{SO}_4$ ta thấy xuất hiện kết tủa màu trắng, khối lượng kết tủa tăng dần đến tối đa sau đó không đổi, dung dịch trong suốt: $\mathrm{BaCl}_2+\mathrm{Na}_2 \mathrm{SO}_4 \rightarrow 2 \mathrm{NaCl}+\mathrm{BaSO}_4$
– Nung nóng $\mathrm{Cu}(\mathrm{OH})_2$ trên ngọn lửa đèn cồn, sau một thời gian ta thấy rắn màu xanh $\mathrm{Cu}(\mathrm{OH})_2$ chuyển thành màu đen $(\mathrm{CuO}): \mathrm{Cu}(\mathrm{OH})_2 \stackrel{\mathrm{t}^{\circ}}{\longrightarrow} \mathrm{CuO}+\mathrm{H}_2 \mathrm{O}$
– Sục khí $\mathrm{CO}_2$ dư vào dung dịch $\mathrm{NaAlO}_2$ ta thấy có kết tủa kéo trắng, khối lượng kết tủa tăng dần đến tối đa sau đó không đổi, dung dịch trong suốt: $\mathrm{CO}_2+\mathrm{NaAlO}_2+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{NaHCO}_3+\mathrm{Al}(\mathrm{OH})_3$
Câu 2: $(3,0$ điểm)
1. Cho sơ đồ phản ứng sau: $\mathrm{X}_1+\mathrm{X}_2 \rightarrow \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{H}_2 \mathrm{O} \quad \mathrm{X}_3+\mathrm{H}_2 \mathrm{O} \stackrel{\text { diện phân dung dịch,màng ngăn }}{\rightarrow} \mathrm{X}_2+\mathrm{X}_4+\mathrm{H}_2$
$$
\mathrm{X}_5+\mathrm{X}_2 \rightarrow \mathrm{X}_6+\mathrm{H}_2 \mathrm{O} \quad \mathrm{X}_6+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{X}_7+\mathrm{X}_1 \quad \mathrm{X}_5 \stackrel{\text { diện phân nóng chảy,criolit }}{\rightarrow} \mathrm{Al}+\mathrm{O}_2
$$
Xác định các chất $X_1, X_2 \ldots X_7$ thỏa mãn sơ đồ trên và viết phương trình hóa học xảy ra.
2. Chọn các chất $X, Y$ thỏa mãn và viết các phương trình hóa học thực hiện sơ đồ chuyển hóa dưới đây. Biết mỗi mũi tên ứng với một phản ứng giữa hai chất đã cho trên sơ đồ:
Hướng dẫn
1. $\left|\begin{array}{l}\mathrm{X}_3: \mathrm{NaCl} \\ \mathrm{X}_2: \mathrm{NaOH}\end{array}\right| \begin{aligned} & \mathrm{X}_4: \mathrm{Cl}_2 \\ & \mathrm{X}_1: \mathrm{NaHCO}_3\end{aligned} ; \mid \begin{aligned} & \mathrm{X}_5: \mathrm{Al}_2 \mathrm{O}_3 \\ & \mathrm{X}_6: \mathrm{NaAlO}_2\end{aligned} ; \mathrm{X}_7: \mathrm{Al}(\mathrm{OH})_3$
$$
\mathrm{NaHCO}_3+\mathrm{NaOH} \rightarrow \mathrm{Na}_2 \mathrm{CO}_3 \quad 2 \mathrm{NaCl}+2 \mathrm{H}_2 \mathrm{O} \rightarrow 2 \mathrm{NaOH}+\mathrm{H}_2+\mathrm{Cl}_2 \quad \mathrm{Al}_2 \mathrm{O}_3+2 \mathrm{NaOH} \rightarrow 2 \mathrm{NaAlO}_2+\mathrm{H}_2 \mathrm{O}
$$
$$
\mathrm{NaAlO}_2+\mathrm{CO}_2+2 \mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{NaHCO}_3+\mathrm{Al}(\mathrm{OH})_3 \quad \mathrm{Al}_2 \mathrm{O}_3 \rightarrow 2 \mathrm{Al}+1,5 \mathrm{O}_2
$$
2. Chọn $\mathrm{X}: \mathrm{CO}_2$ và $\mathrm{Y}: \mathrm{Ba}(\mathrm{OH})_2$
$$
\begin{array}{ll}
2 \mathrm{NaOH}+\mathrm{CO}_2 \rightarrow \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{H}_2 \mathrm{O} & \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{Ba}(\mathrm{OH})_2 \rightarrow 2 \mathrm{NaOH}+\mathrm{BaCO}_3 \\
\mathrm{Na}_2 \mathrm{CO}_3+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O} \rightarrow 2 \mathrm{NaHCO}_3 & 2 \mathrm{NaHCO}_3+\mathrm{Ba}(\mathrm{OH})_2 \rightarrow \mathrm{BaCO}_3+\mathrm{Na}_2 \mathrm{CO}_3+2 \mathrm{H}_2 \mathrm{O} \\
\mathrm{NaOH}+\mathrm{CO}_2 \rightarrow \mathrm{NaHCO}_3 & \mathrm{NaHCO}_3+\mathrm{Ba}(\mathrm{OH})_2 \rightarrow \mathrm{BaCO}_3+\mathrm{NaOH}+\mathrm{H}_2 \mathrm{O}
\end{array}
$$
Câu 3: (3,0 điểm)
1. Tiến hành các thí nghiệm: nhiệt phân $\mathrm{KMnO}_4$ thu được khí $\mathrm{A}$; cho dung dịch $\mathrm{HCl}$ đặc vào $\mathrm{MnO}_2$ đun nóng thu được khí $\mathrm{B}$; cho $\mathrm{Cu}$ vào dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ đặc nóng thu được khí $\mathrm{C}$; cho $\mathrm{NH}_4 \mathrm{HCO}_3$ vào dung dịch $\mathrm{NaOH}$ thu được khí D.
a. Xác định $\mathrm{A}, \mathrm{B}, \mathrm{C}, \mathrm{D}$ và viết phương trình hóa học của các phản ứng trên.
b. Cho các khí A, B, C, D tác dụng với nhau từng đôi một. Viết phương trình hóa học xảy ra (ghi rõ điều kiện).
2. Hãy cho biết:
– Vì sao không nên đốt than trong phòng kín để sưởi ấm vào mùa đông? Viết phương trình hóa học xảy ra.
– Úng dụng dùng để dập tắt đám cháy dựa vào tính chất nào của $\mathrm{CO}_2$ ? Tuy nhiên không thể dùng bình chữa cháy chứa khí $\mathrm{CO}_2$ nén để dập tắt các đám cháy $\mathrm{Mg}, \mathrm{Al}$. Giải thích và viết phương trình hóa học.
Hướng dẫn
1. a. $2 \mathrm{KMnO}_4 \rightarrow \mathrm{K}_2 \mathrm{MnO}_4+\mathrm{MnO}_2+\mathrm{O}_2(\mathrm{~A})$
$$
\begin{array}{ll}
2 \mathrm{KMnO}_4 \rightarrow \mathrm{K}_2 \mathrm{MnO}_4+\mathrm{MnO}_2+\mathrm{O}_2(\mathrm{~A}) & \mathrm{MnO}_2+4 \mathrm{HCl} \rightarrow \mathrm{MnCl}_2+\mathrm{Cl}_2(\mathrm{~B})+2 \mathrm{H}_2 \mathrm{O} \\
\mathrm{Cu}+2 \mathrm{H}_2 \mathrm{SO}_{4(\mathrm{~d}, \mathrm{n})} \rightarrow \mathrm{CuSO}_4+\mathrm{SO}_2(\mathrm{C})+2 \mathrm{H}_2 \mathrm{O} & \mathrm{NH}_4 \mathrm{HCO}_3+2 \mathrm{NaOH} \rightarrow \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{NH}_3(\mathrm{D})+2 \mathrm{H}_2 \mathrm{O}
\end{array}
$$
b. $2 \mathrm{SO}_2+\mathrm{O}_2 \stackrel{\mathrm{V}_2 \mathrm{O}_5, \mathrm{t}^{\mathrm{o}}}{\rightarrow} 2 \mathrm{SO}_3 \quad 2 \mathrm{NH}_3+1,5 \mathrm{O}_2 \rightarrow \mathrm{N}_2+3 \mathrm{H}_2 \mathrm{O} \quad 3 \mathrm{Cl}_2+2 \mathrm{NH}_3 \rightarrow \mathrm{N}_2+6 \mathrm{HCl}$
2. – Đốt than trong phòng kín: $2 \mathrm{C}+\mathrm{O}_{2 \text { (thiếu) }} \rightarrow 2 \mathrm{CO}$ là khí độc thần kinh, giảm lượng oxi lên não, trong thời gian lâu sẽ gây hôn mê, nặng hơn có thể tử vong.
– Khí $\mathrm{CO}_2$ không duy trì sự cháy, khi dùng bình cứu hỏa nén khí $\mathrm{CO}_2$ xử lý đám cháy thì bọt tạo ra bao phủ vật liệu gây cháy, ngăn cách nguồn cháy với không khí. Bình chữa cháy chứa khí $\mathrm{CO}_2$ không dập tắt các đám cháy $\mathrm{Mg}, \mathrm{Al}$ được vì làm đám cháy xảy ra dữ dội hơn: $2 \mathrm{Mg}+\mathrm{CO}_2 \rightarrow 2 \mathrm{MgO}+\mathrm{C} \quad 4 \mathrm{Al}+3 \mathrm{CO}_2 \rightarrow 2 \mathrm{Al}_2 \mathrm{O}_3+3 \mathrm{C}$ Than sinh ra gặp nguồn nhiệt cao lại khiến đám cháy mạnh hơn.
Câu 4: (4,0 điểm)
1. Hòa tan hoàn toàn 12 gam hỗn hợp $\mathrm{X}$ gồm $\mathrm{Fe}$ và kim loại $\mathrm{M}$ có hóa trị II trong 175 gam dung dịch $\mathrm{HCl}$ 14,6\% thu được 6,72 lít khí $\mathrm{H}_2$ và dung dịch $\mathrm{Y}$. Mặt khác, cho 3,6 gam kim loại $\mathrm{M}$ vào $300 \mathrm{ml}$ dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ $1 \mathrm{M}$ thì sau phản ứng xảy ra hoàn toàn vẫn còn dư axit.
a. Xác định M.
b. Tính nồng độ \% các chất tan trong $\mathrm{Y}$.
2. Cho hỗn hợp $\mathrm{X}$ gồm $\mathrm{Cu}$ và $\mathrm{Fe}$ tác dụng với $\mathrm{V}$ lít khí $\mathrm{Cl}_2$ (đun nóng) thu được 8,99 gam hỗn hợp chất rắn $\mathrm{Y}$ gồm $\mathrm{Fe}, \mathrm{Cu}, \mathrm{CuCl}_2$ và $\mathrm{FeCl}_3$. Cho $\mathrm{Y}$ vào dung dịch $\mathrm{HCl}$ thu được $0,01 \mathrm{~mol}$ khí $\mathrm{H}_2$, dung dịch $\mathrm{Z}$ và chất rắn $\mathrm{E}$ gồm hai kim loại. Hòa tan toàn bộ $\mathrm{E}$ trong dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ đặc, nóng dư thu được 0,04 mol $\mathrm{SO}_2$. Cho dung dịch $\mathrm{AgNO}_3$ dư vào $\mathrm{Z}$ thu được 23,7 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn.
a. Viết các phương trình hóa học xảy ra.
b. Tính $\mathrm{V}$ và \% khối lượng mỗi kim loại trong $\mathrm{X}$.
Hướng dẫn
1. Vì $\mathrm{nHCl}=0,7>2 \mathrm{nH}_2$ nên $\mathrm{HCl}$ dư
$\left|\begin{array}{l}\mathrm{Fe}^{\mathrm{a}} \\ \mathrm{M}^{\mathrm{b}}\end{array} \rightarrow\right| \begin{aligned} & 56 \mathrm{a}+\mathrm{Mb}=12 \\ & \mathrm{a}+\mathrm{b}=0,3\end{aligned} \rightarrow 56=\frac{4,8}{\mathrm{~b}}+\mathrm{M} \stackrel{0<\mathrm{b}<0,3}{\longrightarrow}\left|\begin{array}{l}12<\mathrm{M}<40 \\ \rightarrow \mathrm{M}: \mathrm{Mg}\end{array} \rightarrow\right| \begin{aligned} & \mathrm{x}=0,15 \\ & \mathrm{y}=0,15\end{aligned} ; \mathrm{ddY}:\left(\mathrm{FeCl}_2^{10,22 \%}\left|\mathrm{MgCl}_2^{7,64 \%}\right| \mathrm{HCl}_{\mathrm{du}}^{1,96 \%}\right)$
Các pứ xảy ra hoàn toàn, trong $\mathrm{E}$ có $\mathrm{Fe}$ dư nên $\mathrm{ddZ}$ chỉ chứa $\mathrm{FeCl}_2$
Câu 5: (4,0 điểm)
1. Một loại phân bón $\mathrm{NPK}$ chứa $\mathrm{NH}_4 \mathrm{NO}_3,\left(\mathrm{NH}_4\right)_2 \mathrm{HPO}_4, \mathrm{KCl}$ và các tạp chất không chứa nguyên tố $\mathrm{N}, \mathrm{P}, \mathrm{K}$. Trên bao bì của phân bón NPK này có các chữ số 15.20 .8 . Tính \% khối lượng các chất $\mathrm{NH}_4 \mathrm{NO}_3,\left(\mathrm{NH}_4\right)_2 \mathrm{HPO}_4$, $\mathrm{KCl}$ trong loại phân bón NPK trên.
2. Cho $\mathrm{V}$ lít hỗn hợp gồm $\mathrm{Cl}_2$ và $\mathrm{O}_2$ phản ứng vừa đủ với hỗn hợp $\mathrm{X}$ gồm 5,4 gam $\mathrm{Al}$ và 7,2 gam $\mathrm{Mg}$ thu được 44,2 gam hỗn hợp chất rắn. Viết các phương trình hóa học và tính $\mathrm{V}$.
3. Cho 9 gam muối $\mathrm{X}$ khan tác dụng với dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ loãng, dư thu được $\mathrm{V}$ lít khí $\mathrm{CO}_2$. Hấp thụ hết $\mathrm{V}$ lít $\mathrm{CO}_2$ ở trên vào dung dịch chứa $0,06 \mathrm{~mol} \mathrm{Ba}(\mathrm{OH})_2$ thu được $2 \mathrm{~m}$ gam kết tủa và dung dịch $\mathrm{Y}$. Cho $15 \mathrm{ml}$ dung dịch $\mathrm{NaOH} 1 \mathrm{M}$ vào $\mathrm{Y}$ thu được $\mathrm{m}$ gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Tính giá trị $\mathrm{V}$ và xác định CTPT của $\mathrm{X}$.
Hướng dẫn
1. Giả sử khối lượng phân là 100 gam.
2. $\left|\begin{array}{l}\mathrm{Cl}_2{ }^{\mathrm{a}} \\ \mathrm{O}_2{ }^{\mathrm{b}}\end{array} \rightarrow\right| \begin{aligned} & \mathrm{m}_{\uparrow}+\mathrm{m}_{(\mathrm{Mg}, \mathrm{Al})}=\mathrm{m}_{\mathrm{Rán}} \rightarrow 71 \mathrm{a}+32 \mathrm{~b}+12,6=44,2 \\ & \stackrel{\mathrm{BT} . \mathrm{e}}{\longrightarrow} 2 \mathrm{n}_{\mathrm{Mg}}+3 \mathrm{n}_{\mathrm{Al}}=2 \mathrm{n}_{\mathrm{Cl}_2}+4 \mathrm{n}_{\mathrm{O}_2} \rightarrow 1,2=2 \mathrm{a}+4 \mathrm{~b}\end{aligned} \rightarrow \mid \begin{aligned} & \mathrm{a}=0,4 \\ & \mathrm{~b}=0,1\end{aligned} \rightarrow \mathrm{V}=11,2$ (lít)
3. $\mathbf{T H}_1: \mathrm{NaOH}$ cho vào dung dịch $\mathrm{Y}: \mathrm{Ba}\left(\mathrm{HCO}_3\right)_2$ thì hết sau pứ
$\mathrm{TH}_2$ : $\mathrm{NaOH}$ cho vào dung dịch $\mathrm{Ba}\left(\mathrm{HCO}_3\right)_2$ thì dư sau pứ
$$
2 \mathrm{NaOH}+\mathrm{Ba}\left(\mathrm{HCO}_3\right)_2 \rightarrow \mathrm{BaCO}_3+\mathrm{Na}_2 \mathrm{CO}_3+2 \mathrm{H}_2 \mathrm{O}
$$
$\mathrm{TH}_3: \mathrm{NaOH}$ cho vào dung dịch $\mathrm{Ba}\left(\mathrm{HCO}_3\right)_2$ thì sau pứ $\mathrm{Ba}\left(\mathrm{HCO}_3\right)_2$ dư
$\mathrm{NaOH}+\mathrm{Ba}\left(\mathrm{HCO}_3\right)_2 \rightarrow \mathrm{BaCO}_3+\mathrm{NaHCO}_3+\mathrm{H}_2 \mathrm{O}$
Vậy giá trị $\mathrm{V}=2,016$ (lít) và công thức muối là $\mathrm{CaCO}_3$ hoặc $\mathrm{KHCO}_3$.
Câu 6: $(3,0$ điểm)
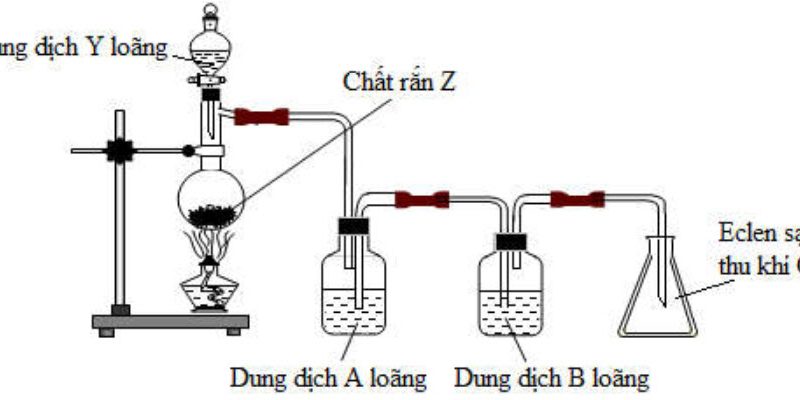
Thí nghiệm điều chế và thu khí $\mathrm{X}$ được mô tả như hình vẽ dưới đây:
– Xác định $\mathrm{X}$ và viết phương trình hóa học – Cho biết $\mathrm{Y}$ và vai trò bông tẩm dung dịch $\mathrm{Y}$. Viết $\mathrm{PTHH}$.
– Cho biết phương pháp thu khí $X$ và phương pháp này dữa trên tính chất nào của $X$
– Làm thế nào để biết khí $\mathrm{X}$ đầy bình thu? – Trình bày cách làm khô khí $\mathrm{X}$ – Úng dụng của khí $\mathrm{X}$ ?
Hướng dẫn
$-\mathrm{Na}_2 \mathrm{SO}_3+\mathrm{H}_2 \mathrm{SO}_4 \rightarrow \mathrm{Na}_2 \mathrm{SO}_4+\mathrm{SO}_2(\mathrm{X})+\mathrm{H}_2 \mathrm{O}$.
– Bông tẩm Y: $\mathrm{NaOH}$, ngăn không cho khí độc $\mathrm{SO}_2$ thoát ra ngoài: $\mathrm{SO}_2+2 \mathrm{NaOH} \rightarrow \mathrm{Na}_2 \mathrm{SO}_3+\mathrm{H}_2 \mathrm{O}$
– Phương pháp thu khí $\mathrm{SO}_2$ là phương pháp đẩy khí, $\mathrm{SO}_2$ tan tốt trong nước nên không sử dụng phương pháp đẩy nước, $\mathrm{d}\left(\mathrm{SO}_2 / \mathrm{kk}\right)=2,2$ nên để miệng bình hướng lên trên.
– Để biết khí $\mathrm{SO}_2$ đầy bình ta đặt quỳ tím ấm gần bông tẩm dung dịch $\mathrm{NaOH}$, nếu $\mathrm{SO}_2$ đầy bình thì quỳ tím ẩm bị mất màu và ngược lại.
– Để làm khô khí $\mathrm{SO}_2$ người ta cho hỗn hợp $\left(\mathrm{SO}_2, \mathrm{H}_2 \mathrm{O}\right)$ đi qua dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ đặc, dư.
– Ứng dụng của $\mathrm{SO}_2$ : tẩy trắng bột giấy, điều chể axit $\mathrm{H}_2 \mathrm{SO}_4$, điều chế thuốc chống sâu bọ, công nghiệp sấy…