File word Đề thi HSG Hóa 9 TP Vinh – Nghệ An – Năm học 2022 – 2023
File word Đề thi HSG Hóa 9 TP Vinh – Nghệ An – Năm học 2022 – 2023
Câu 1: (5,0 điểm)
1. a. Bằng các thí nghiệm đã học, hãy chứng minh các kim loại sau được sắp xếp theo chiều giảm dần mức độ hoạt động hóa học: $\mathrm{Fe}, \mathrm{Cu}, \mathrm{Ag}$.
b. Nêu ý nghĩa của dãy hoạt động hóa học của kim loại.
2. Cho biết $\mathrm{A}, \mathrm{B}, \mathrm{C}, \mathrm{D}, \mathrm{E}$ đều là hợp chất vô cơ của $\mathrm{Na}$. Chọn $\mathrm{A}, \mathrm{B}, \mathrm{C}, \mathrm{D}, \mathrm{E}$ thích hợp và hoàn thành chuỗi chuyển đổi sau (mỗi mũi tên ứng với một phản ứng hóa học).
Hướng dẫn
1. $\mathrm{Fe}+\mathrm{CuSO}_4 \rightarrow \mathrm{FeSO}_4+\mathrm{Cu} \quad \mathrm{Fe}+2 \mathrm{AgNO}_3 \rightarrow \mathrm{Fe}\left(\mathrm{NO}_3\right)_2+2 \mathrm{Ag} \quad \mathrm{Cu}+2 \mathrm{AgNO}_3 \rightarrow \mathrm{Cu}\left(\mathrm{NO}_3\right)_2+2 \mathrm{Ag}$
Dãy hoạt động hóa học của kim loại cho biết mức độ hoạt động của kim loại, mức độ này ảnh hưởng tới một số phản ứng hóa học của kim loại:
+ Mức độ hoạt động của kim loại giảm dần từ trái qua phải
+ Kim loại đứng trước $\mathrm{Mg}(\mathrm{K}, \mathrm{Na}, \mathrm{Ba}, \mathrm{Ca})$ phản ứng được với nước ở nhiệt độ thường
+ Kim loại đứng trước $\mathrm{H}(-\mathrm{Cu}, \mathrm{Ag}, \mathrm{Au})$ phản ứng được với $\mathrm{HCl}, \mathrm{H}_2 \mathrm{SO}_4$ loãng điều kiện thường
+ Kim loại từ $\mathrm{Mg}$ đến $\mathrm{Ag}$ thì kim loại mạnh hơn đẩy kim loại yếu hởn a khỏi muối
2. A: $\mathrm{NaHCO}_3|\mathrm{~B}: \mathrm{NaCl}| \mathrm{C}: \mathrm{Na}_2 \mathrm{CO}_3\left|\mathrm{D}: \mathrm{Na}_2 \mathrm{SO}_4\right| \mathrm{E}: \mathrm{NaOH}$
(1) $2 \mathrm{NaHCO}_3 \rightarrow \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O}$
(2) $\mathrm{Na}_2 \mathrm{CO}_3+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O} \rightarrow 2 \mathrm{NaHCO}_3$
(3) $2 \mathrm{NaCl}+\mathrm{Ag}_2 \mathrm{SO}_4 \rightarrow \mathrm{Na}_2 \mathrm{SO}_4+2 \mathrm{AgCl}$
(4) $\mathrm{Na}_2 \mathrm{SO}_4+\mathrm{BaCl}_2 \rightarrow 2 \mathrm{NaCl}+\mathrm{BaSO}_4$
(5) $\mathrm{Na}_2 \mathrm{CO}_3+\mathrm{Ba}(\mathrm{OH})_2 \rightarrow 2 \mathrm{NaOH}+\mathrm{BaCO}_3$
(6) $2 \mathrm{NaOH}+\mathrm{CO}_2 \rightarrow \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{H}_2 \mathrm{O}$
(7) $\mathrm{Na}_2 \mathrm{SO}_4+\mathrm{Ba}\left(\mathrm{HCO}_3\right)_2 \rightarrow 2 \mathrm{NaHCO}_3+\mathrm{BaSO}_4$
(8) $2 \mathrm{NaHCO}_3+\mathrm{H}_2 \mathrm{SO}_4 \rightarrow \mathrm{Na}_2 \mathrm{SO}_4+2 \mathrm{CO}_2+2 \mathrm{H}_2 \mathrm{O}$
(9) $\mathrm{NaOH}+\mathrm{HCl} \rightarrow \mathrm{NaCl}+\mathrm{H}_2 \mathrm{O}$
(10) $2 \mathrm{NaCl}+2 \mathrm{H}_2 \mathrm{O} \stackrel{\text { dpdd,màng ngăn }}{\longrightarrow} 2 \mathrm{NaOH}+\mathrm{H}_2+\mathrm{Cl}_2$
1. Một hỗn hợp chứa $\mathrm{Al}, \mathrm{Al}_2 \mathrm{O}_3, \mathrm{CuO}$. Trình bày phương pháp tách riêng từng chất ra khỏi hỗn hợp sao cho khối lượng của chúng được bảo toàn.
2. Trong phòng thí nghiệm có hai dung dịch không màu, mất nhãn: dung dịch $\mathrm{A}$ chứa $\mathrm{Ba}(\mathrm{OH})_2 0,1 \mathrm{M}$; dung dịch $\mathrm{B}$ chứa hỗn hợp gồm $\mathrm{Na}_2 \mathrm{CO}_3 0,1 \mathrm{M}$ và $\mathrm{NaHCO}_3 0,1 \mathrm{M}$. Không dùng thêm bất kỳ thuốc thử nào khác, kể cả phương pháp đun nóng, hãy trình bày cách để phân biệt hai dung dịch nói trên.
Hướng dẫn
$$
\begin{aligned}
& 2 \mathrm{Al}+3 \mathrm{Cu}\left(\mathrm{NO}_3\right)_2 \rightarrow 2 \mathrm{Al}\left(\mathrm{NO}_3\right)_3+3 \mathrm{Cu} \quad \mathrm{Al}\left(\mathrm{NO}_3\right)_3+4 \mathrm{NaOH} \rightarrow 3 \mathrm{NaNO}_3+\mathrm{NaAlO}_2+2 \mathrm{H}_2 \mathrm{O} \\
& \mathrm{Cu}\left(\mathrm{NO}_3\right)_2+2 \mathrm{NaOH} \rightarrow \mathrm{Cu}(\mathrm{OH})_2+2 \mathrm{NaNO}_3 \quad \mathrm{NaAlO}_2+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{Al}(\mathrm{OH})_3+\mathrm{NaHCO}_3 \\
& 2 \mathrm{Al}(\mathrm{OH})_3 \rightarrow \mathrm{Al}_2 \mathrm{O}_3+3 \mathrm{H}_2 \mathrm{O} \quad \mathrm{Al}_2 \mathrm{O}_3 \rightarrow 2 \mathrm{Al}+1,5 \mathrm{O}_2 \quad \mathrm{Al}_2 \mathrm{O}_3+6 \mathrm{HCl} \rightarrow 2 \mathrm{AlCl}_3+3 \mathrm{H}_2 \mathrm{O} \\
& \mathrm{CuO}+2 \mathrm{HCl} \rightarrow \mathrm{CuCl}_2+\mathrm{H}_2 \mathrm{O} \quad \mathrm{AlCl}_3+4 \mathrm{NaOH} \rightarrow 3 \mathrm{NaCl}+\mathrm{NaAlO}_2+2 \mathrm{H}_2 \mathrm{O} \\
& \mathrm{CuCl}_2+2 \mathrm{NaOH} \rightarrow 2 \mathrm{NaCl}+\mathrm{Cu}(\mathrm{OH})_2 \quad \mathrm{Cu}(\mathrm{OH})_2 \rightarrow \mathrm{CuO}+\mathrm{H}_2 \mathrm{O} \\
&
\end{aligned}
$$
2. Lấy mẫu hai dung dịch, đánh số thứ tự để thuận tiện đối chiếu kết quả thực nghiệm
– Đổ 1 lít dung dịch (1) vào 2 lít dung dịch (2), quan sát khối lượng kết tủa thu được:
$$
\mathrm{Ba}(\mathrm{OH})_2+\mathrm{Na}_2 \mathrm{CO}_3 \rightarrow \mathrm{BaCO}_3+2 \mathrm{NaOH} \quad \mathrm{Ba}(\mathrm{OH})_2+2 \mathrm{NaHCO}_3 \rightarrow \mathrm{BaCO}_3+\mathrm{Na}_2 \mathrm{CO}_3+2 \mathrm{H}_2 \mathrm{O}
$$
Nếu khối lượng kết tủa do 1 lít (1) và 2 lít (2) < kết tủa do 1 lít (2) và 2 lít (1) thì $(1)$ : $\mathrm{Ba}(\mathrm{OH})_2 ;(2)$ là $\mathrm{Na}_2 \mathrm{CO}_3, \mathrm{NaHCO}_3$. Và tương tự ngược lại.
Câu 3: (4,0 điểm)
1. Cho 13,52 gam chất $X$ tan hoàn toàn trong 100 gam nước thu được dung dịch $Y$. Trung hòa hết dung dịch $\mathrm{Y}$ cần vừa đủ 200 gam dung dịch $\mathrm{NaOH} 6,4 \%$. Cho dung dịch $\mathrm{BaCl}_2$ dư vào $\mathrm{Y}$, kết thúc phản ứng thấy tách ra 37,28 gam kết tủa trắng không tan trong axit $\mathrm{HNO}_3$. Coi quá trình thí nghiệm nước bay hơi không đáng kể. Xác định công thức hóa học của $\mathrm{X}$ và tính nồng độ $\%$ của dung dịch $\mathrm{Y}$.
Hướng dẫn
Nhận xét: $\mathrm{X}+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{Y}$ và $\mathrm{Y}$ có pứ trung hòa với $\mathrm{NaOH}$ nên $\mathrm{Y}$ có tính axit. Mặt khác $\mathrm{Y}+\mathrm{BaCl}_2 \rightarrow$ kết tủa trắng không tan trong $\mathrm{HNO}_3$ nên kết tủa là $\mathrm{BaSO}_4 \rightarrow \mathrm{Y}_2: \mathrm{H}_2 \mathrm{SO}_4$. CT X là $\mathrm{H}_2 \mathrm{SO}_4 \cdot \mathrm{nSO}_3$ : $\mathrm{a}(\mathrm{mol})$ $\mathrm{H}_2 \mathrm{SO}_4 \cdot \mathrm{nSO}_3+\mathrm{nH}_2 \mathrm{O} \rightarrow(\mathrm{n}+1) \mathrm{H}_2 \mathrm{SO}_4 \quad 2 \mathrm{NaOH}+\mathrm{H}_2 \mathrm{SO}_4 \rightarrow \mathrm{Na}_2 \mathrm{SO}_4+2 \mathrm{H}_2 \mathrm{O} \quad \mathrm{BaCl}_2+\mathrm{H}_2 \mathrm{SO}_4 \rightarrow \mathrm{BaSO}_4+2 \mathrm{HCl}$ $\mathrm{H}_2 \mathrm{SO}_4 \cdot \mathrm{nSO}_3{ }^{\mathrm{a}(\mathrm{mol})} \rightarrow\left|\begin{array}{l}\mathrm{a}(\mathrm{n}+1)=0,16 \\ (98+80 \mathrm{n}) \cdot \mathrm{a}=13,52\end{array} \rightarrow\right| \begin{aligned} & \mathrm{an}=0,12 \\ & \mathrm{a}=0,04\end{aligned} \rightarrow\left|\begin{array}{l}\mathrm{n}=3 \\ \mathrm{X}: \mathrm{H}_2 \mathrm{SO}_4 \cdot 3 \mathrm{SO}_3\end{array} \rightarrow \mathrm{Y}\right| \begin{aligned} & \mathrm{H}_2 \mathrm{SO}_4^{0,16(\mathrm{~mol})} \mathrm{m}_{\mathrm{Y}}=113,52\end{aligned}: 13,81 \%$
2. Trộn đều 62,3 gam hỗn hợp $\mathrm{X}$ gồm $\mathrm{BaO}, \mathrm{BaCO}_3, \mathrm{KHCO}_3$ rồi chia $\mathrm{X}$ thành hai phần bằng nhau: Phần 1: cho vào nước dư thu được 21,67 gam kết tủa.
Phần 2: nung ở nhiệt độ cao đến khối lượng không đổi thu được 27,09 gam chất rắn $Y$. Cho toàn bộ $Y$ vào 78,82 gam nước thu được $\mathrm{m}$ gam kết tủa và dung dịch $\mathrm{Z}$. Coi trong quá trình thí nghiệm nước bay hơi không đáng kể, các phản ứng đều xảy ra hoàn toàn.
a. Tìm $\mathrm{m}$ và tính nồng độ $\%$ mỗi chất tan trong $\mathrm{Z}$.
b. Hấp thụ hoàn toàn $\mathrm{V}$ lít $\mathrm{CO}_2$ (đktc) vào 50 gam dung dịch $\mathrm{Z}$ thu được 9,85 gam kết tủa. Tính $\mathrm{V}$.
Hướng dẫn
Đồng nhất dữ kiện bằng cách chia 62,3 gam cho 2 .
$$
\mathrm{BaO}+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{Ba}(\mathrm{OH})_2 \quad \mathrm{Ba}(\mathrm{OH})_2+\mathrm{KHCO}_3 \rightarrow \mathrm{BaCO}_3+\mathrm{KOH}+\mathrm{H}_2 \mathrm{O} \quad \mathrm{BaCO}_3 \rightarrow \mathrm{BaO}+\mathrm{CO}_2
$$
$2 \mathrm{KHCO}_3 \rightarrow \mathrm{K}_2 \mathrm{CO}_3+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O} \quad \mathrm{Ba}(\mathrm{OH})_2+\mathrm{K}_2 \mathrm{CO}_3 \rightarrow \mathrm{BaCO}_3+2 \mathrm{KOH}$
Nhận thấy: sục $\mathrm{CO}_2$ vào $\mathrm{Z}$ thu được kết tủa nên $\mathrm{Z}$ có: $\mathrm{Ba}(\mathrm{OH})_2, \mathrm{KOH}$
a. $\left|\begin{array}{l}\mathrm{BaO}^{\mathrm{a}} \\ \mathrm{BaCO}_3{ }^{\mathrm{b}} \rightarrow \mathrm{Y} \\ \mathrm{KHCO}_3{ }^{\mathrm{c}}\end{array}\right| \begin{aligned} & \mathrm{BaO}^{\mathrm{a}+\mathrm{b}} \\ & \mathrm{K}_2 \mathrm{CO}_3{ }^{0,5 \mathrm{c}}\end{aligned} \rightarrow\left|\begin{array}{l}153 \mathrm{a}+197 \mathrm{~b}+100 \mathrm{c}=31,15 \\ 153(\mathrm{a}+\mathrm{b})+138.0,5 \mathrm{c}=27,09 \\ \mathrm{n}_{\mathrm{BaCO}_3}=\mathrm{b}+\mathrm{c}=0,11\end{array} \rightarrow\right| \begin{aligned} & \mathrm{a}=0,1 \\ & \mathrm{~b}=0,05 \\ & \mathrm{c}=0,06\end{aligned} \rightarrow\left|\begin{array}{l}\mathrm{Z} \mid \begin{array}{l}\mathrm{Ba}(\mathrm{OH})_2{ }^{0,12} \\ \mathrm{KOH}^{0,06} \\ \mathrm{~m}_{\mathrm{Z}}=100\end{array}\end{array} \rightarrow\right| \begin{aligned} & \mathrm{m}=5,91 \\ & \% \mathrm{Ba}(\mathrm{OH})_2{ }^{16,36 \%} \\ & \% \mathrm{KOH}^{3,57 \%}\end{aligned}$
TH丨 1 : kết tủa $\mathrm{BaCO}_3$ chưa bị hòa tan $\mathrm{CO}_2+\mathrm{Ba}(\mathrm{OH})_2 \rightarrow \mathrm{BaCO}_3+\mathrm{H}_2 \mathrm{O}$
$$
0,05 \quad \leftarrow 0,05 \quad \rightarrow \mathrm{V}=1,12 \text { (lít) }
$$
$\mathrm{TH}_2$ : kết tủa $\mathrm{BaCO}_3$ bị hòa tan một phần
$$
\begin{aligned}
& \mathrm{CO}_2+\mathrm{Ba}(\mathrm{OH})_2 \rightarrow \mathrm{BaCO}_3+\mathrm{H}_2 \mathrm{O} \quad 2 \mathrm{CO}_2+\mathrm{Ba}(\mathrm{OH})_2 \rightarrow \mathrm{Ba}\left(\mathrm{HCO}_3\right)_2 \\
& 0,05 \quad 0,05 \leftarrow 0,05 \quad 0,02 \quad \leftarrow 0,01 \quad \rightarrow \mathrm{V}=1,568 \text { (lít) } \\
&
\end{aligned}
$$
Vậy có hai giá trị của $\mathrm{V}$ thỏa mãn là: 1,120 (lít) và 1,568 (lít).
Câu 4: (4,0 điểm)
1. Hỗn hợp $\mathrm{A}$ gồm $\mathrm{M}, \mathrm{MO}, \mathrm{Mg}$ (M là kim loại có hóa trị cao nhất là II, hidroxit của $\mathrm{M}$ không tan trong nước, không lưỡng tính). Chia 44,8 gam hỗn hợp A thành hai phần bằng nhau:
– Dẫn khí $\mathrm{CO}$ dư đi qua phần một nung nóng đến phản ứng hoàn toàn thu được hỗn hợp khí $\mathrm{B}$, chất rắn $\mathrm{C}$ gồm hai kim loại. Dẫn $\mathrm{B}$ qua dung dịch nước vôi trong thu được 6 gam kết tủa và dung dịch $\mathrm{D}$. Cho $20 \mathrm{ml}$ dung dịch $\mathrm{NaOH} 1 \mathrm{M}$ tác dụng vừa đủ với $\mathrm{D}$ thì thu được lượng kết tủa lớn nhất. Hòa tan chất $\mathrm{C}$ trong dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ loãng dư thấy còn lại 16 gam chất rắn không tan.
– Phần hai cho vào một lượng dung dịch $\mathrm{HCl}$, kết thúc phản ứng thu được dung dịch $\mathrm{E}$, khí $\mathrm{G}$ và chất rắn $\mathrm{F}$ gồm hai kim loại. Cho dung dịch $\mathrm{E}$ tác dụng với dung dịch $\mathrm{KOH}$ dư thu được 11,02 gam kết tủa duy nhất. Cho $\mathrm{F}$ tác dụng với dung dịch $\mathrm{AgNO}_3$ dư thu được 56,16 gam kết tủa. Xác định $\mathrm{M}$ và phần trăm khối lượng của $\mathrm{Mg}$ trong hỗn hợp $\mathrm{A}$.
Hướng dẫn
– Vì $\left(\mathrm{NH}_4\right)_2 \mathrm{CO}_3$ tạo ra nhiều hơn khí $\mathrm{NH}_3$ (mùi khai) tạo mùi khó chịu cho bánh.
$$
\mathrm{NH}_4 \mathrm{HCO}_3 \rightarrow \mathrm{NH}_3+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O} \quad\left(\mathrm{NH}_4\right)_2 \mathrm{CO}_3 \rightarrow 2 \mathrm{NH}_3+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O}
$$
– Khi trời rét đậm: ure tan trong nước thu nhiệt làm hạ nhiệt độ, cây không hấp thụ được chất dinh dưỡng.
Khi trờ nắng to thì xảy ra hiện tượng mất đạm: $\left(\mathrm{NH}_2\right)_2 \mathrm{CO}+\mathrm{H}_2 \mathrm{O} \stackrel{\mathrm{t}^{\circ}}{\longrightarrow} 2 \mathrm{NH}_3+\mathrm{CO}_2$
2. Hãy chọn hai cặp chất $(\mathrm{A}, \mathrm{B})$ phù hợp để điều chế hai khí $\mathrm{C}$ khác nhau thỏa mãn hình vẽ dưới đây. Nêu vai trò của bông tẩm xút khi điều chế khí $\mathrm{C}$.
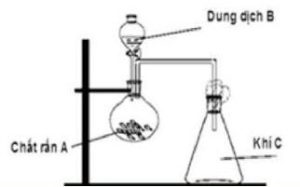
Hướng dẫn
$\mathrm{A}, \mathrm{B}, \mathrm{C}$ là: $\mathrm{H}_2 \mathrm{SO}_4, \mathrm{Na}_2 \mathrm{SO}_3, \mathrm{SO}_2$ và $\mathrm{HCl}, \mathrm{MnO}_2, \mathrm{Cl}_2$. Bông tẩm xút ngăn không cho khí độc thoát ra.
$\mathrm{Na}_2 \mathrm{SO}_3+\mathrm{H}_2 \mathrm{SO}_4 \rightarrow \mathrm{Na}_2 \mathrm{SO}_4+\mathrm{SO}_2+\mathrm{H}_2 \mathrm{O}$
$\mathrm{MnO}_2+4 \mathrm{HCl} \rightarrow \mathrm{MnCl}_2+\mathrm{Cl}_2+2 \mathrm{H}_2 \mathrm{O}$
$\mathrm{SO}_2+2 \mathrm{NaOH} \rightarrow \mathrm{Na}_2 \mathrm{SO}_3+\mathrm{H}_2 \mathrm{O}$
$\mathrm{Cl}_2+2 \mathrm{NaOH} \rightarrow \mathrm{NaCl}+\mathrm{NaClO}+\mathrm{H}_2 \mathrm{O}$