File word Đề thi HSG Hóa 9 – Phú Thọ – Năm học 2022 – 2023
File word Đề thi HSG Hóa 9 – Phú Thọ – Năm học 2022 – 2023
A. PHẦN TRẮC NGHIỆM KHÁCH QUAN. (10,0 điểm)
Câu 1: Cho các chất: $\mathrm{NaCl}, \mathrm{CaSO}_{4}, \mathrm{Ba}\left(\mathrm{HCO}_{3}\right)_{2}, \mathrm{Na}_{2} \mathrm{CO}_{3}, \mathrm{Ca}_{3}\left(\mathrm{PO}_{4}\right)_{2}$. Số muối tan tốt trong nước ở nhiệt độ phòng là:
A. 2.
B. 5 .
C. 4 .
D. 3 .
Câu 2: Thí nghiệm nào dưới đây thu được kết tủa sau khi kết thúc các phản ứng hóa học?
A. Sục khí $\mathrm{SO}_{2}$ vào dung dịch $\mathrm{NaOH}$ dư.
B. Sục khí $\mathrm{CO}_{2}$ vào dung dịch $\mathrm{BaCl}_{2}$ dư.
C. Sục khí $\mathrm{CO}_{2}$ dư vào dung dịch $\mathrm{Ba}(\mathrm{OH})_{2}$.
D. Cho dung dịch $\mathrm{AlCl}_{3}$ dư vào dung dịch $\mathrm{NaOH}$.
Câu 3: Biết:
– Khí X rất độc, không cháy, hoà tan trong nước, nặng hơn không khí và có tính tẩy màu.
– Khí Y rất độc, cháy trong không khí với ngọn lửa màu xanh sinh ra chất khí làm đục nước vôi trong.
– Khí Z không cháy, nặng hơn không khí, làm đục nước vôi trong.
$\mathrm{X}, \mathrm{Y}, \mathrm{Z}$ lần lượt là :
A. $\mathrm{Cl}_{2}, \mathrm{CO}, \mathrm{CO}_{2}$.
B. $\mathrm{Cl}_{2}, \mathrm{SO}_{2}, \mathrm{CO}_{2}$.
C. $\mathrm{SO}_{2}, \mathrm{H}_{2}, \mathrm{CO}_{2}$.
D. $\mathrm{H}_{2}, \mathrm{CO}, \mathrm{SO}_{2}$.
Câu 4: Cho một số nhận định về nguyên nhân gây ô nhiễm môi trường không khí như sau:
(a) Do hoạt động của núi lửa.
(b) Do khí thải công nghiệp, khí thải sinh hoạt.
(c) Do khí thải từ các phương tiện giao thông.
(d) Do khí sinh ra từ quá trình quang hợp của cây xanh.
(e) Do nồng độ cao các muối của kim loại chì, thủy ngân,.. trong các nguồn nước.
Những nhận định đúng là:
A. (a), (b), (c).
B. (b), (c), (e).
C. (a), (b), (d).
D. (b), (c), (d).
Câu 5: Cho 37,95 gam hỗn hợp gồm 2 muối $\mathrm{MgCO}_{3}$ và $\mathrm{RCO}_{3}$ vào $100 \mathrm{ml}$ dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ loãng, thu được dung dịch $\mathrm{X}$, chất rắn $\mathrm{Y}$ và 1,12 lít $\mathrm{CO}_{2}$ (đktc). Cô cạn dung dịch $\mathrm{X}$ thu được 4 gam muối khan. Nung chất rắn $\mathrm{Y}$ đến khối lượng không đổi thì thu được chất rắn $\mathrm{Z}$ và 4,48 lít $\mathrm{CO}_{2}$ (đktc). Khối lượng chất rắn $\mathrm{Z}$ là:
A. 26,95 gam.
B. 27,85 gam.
C. 29,15 gam.
D. 23,35 gam.
Hướng dẫn
Muối $\left|\begin{array}{l}\mathrm{m}=37,95 \mathrm{~g} \\ \mathrm{n}=\mathrm{n}_{\mathrm{CO}_{2}}=0,25\end{array} \rightarrow \mathrm{M}_{\text {Muối }}=151,8 \rightarrow\right| \begin{aligned} & \mathrm{MgCO}_{3}^{0,1} \\ & \mathrm{BaCO}_{3}^{0,15}\end{aligned} \stackrel{\text { BTKL }}{\longrightarrow} \mid \begin{aligned} & 37,95+\mathrm{m}_{\mathrm{H}_{2} \mathrm{SO}_{4}}=4+\mathrm{m}_{\mathrm{Z}}+44.0,25 \\ & \mathrm{~m}_{\mathrm{H}_{2} \mathrm{SO}_{4}}=98.0,05 \rightarrow \mathrm{m}_{\mathrm{Z}}=27,85 \rightarrow \mathrm{B}\end{aligned}$
Câu 6: Hòa tan hết 26,43 gam hỗn hợp bột gồm $\mathrm{Mg}, \mathrm{Al}_{1} \mathrm{Al}_{2} \mathrm{O}_{3}$ và $\mathrm{MgO}$ bằng $800 \mathrm{ml}$ dung dịch hỗn hợp gồm $\mathrm{HCl} 0,5 \mathrm{M}$ và $\mathrm{H}_{2} \mathrm{SO}_{4} 0,75 \mathrm{M}$ (vừa đủ). Sau phản ứng thu được dung dịch $\mathrm{X}$ và 4,368 lít khí $\mathrm{H}_{2}$ (đktc). Cô cạn dung dịch $\mathrm{X}$ thu được $\mathrm{m}$ gam muối khan. Giá trị của $\mathrm{m}$ là:
A. 98,98 .
B. 88,55 .
C. 100,52 .
D. 86,58 .
Hướng dẫn
Ta có $\mid \begin{aligned} & 0,5 \mathrm{n}_{\mathrm{HCl}}+\mathrm{n}_{\mathrm{H}_{2} \mathrm{SO}_{4}}=\mathrm{n}_{\mathrm{O}}+\mathrm{n}_{\mathrm{H}_{2}} \\ & \rightarrow \mathrm{n}_{\mathrm{O}}=0,605 \rightarrow \mathrm{m}_{(\mathrm{Mg}, \mathrm{Al})}=16,75\end{aligned} \rightarrow \mathrm{m}=88,55 \rightarrow \mathrm{B}$
Câu 7: Cho các sơ đồ phản ứng sau:
$$
\mathrm{X}_{1}+\mathrm{X}_{2} \rightarrow \mathrm{X}_{4}+\mathrm{H}_{2} \quad \mathrm{X}_{3}+\mathrm{X}_{4} \rightarrow \mathrm{CaCO}_{3}+\mathrm{NaOH} \quad \mathrm{X}_{3}+\mathrm{X}_{5}+\mathrm{X}_{2} \rightarrow \mathrm{Fe}(\mathrm{OH})_{3}+\mathrm{CO}_{2}+\mathrm{NaCl}
$$
Các chất thích hợp với $\mathrm{X}_{3}, \mathrm{X}_{4}$, $\mathrm{X}_{5}$ lần lượt là:
A. $\mathrm{Ca}(\mathrm{OH})_{2}, \mathrm{NaHCO}_{3}, \mathrm{FeCl}_{3}$.
B. $\mathrm{Na}_{2} \mathrm{CO}_{3}, \mathrm{Ca}(\mathrm{OH})_{2}, \mathrm{FeCl}_{2}$
C. $\mathrm{Na}_{2} \mathrm{CO}_{3}, \mathrm{Ca}(\mathrm{OH})_{2}, \mathrm{FeCl}_{3}$.
D. $\mathrm{Ca}(\mathrm{OH})_{2}, \mathrm{NaHCO}_{3}, \mathrm{FeCl}_{2}$.
Câu 8: Hòa tan hoàn toàn hai chất rắn $\mathrm{X}, \mathrm{Y}$ (có số mol bằng nhau) vào nước thu được dung dịch $\mathrm{Z}$.
Tiến hành các thí nghiệm sau: Thí nghiệm 1: Cho dung dịch $\mathrm{NaOH}$ dư vào $\mathrm{V} \mathrm{ml}$ dung dịch $\mathrm{Z}$, thu được $\mathrm{m}_{1}$ gam kết tủa.
Thí nghiệm 2: Cho dung dịch $\mathrm{K}_{2} \mathrm{CO}_{3}$ dư vào $\mathrm{V} \mathrm{ml}$ dung dịch $\mathrm{Z}$, thu được $\mathrm{m}_{2}$ gam kết tủa.
Thí nghiệm 3: Cho dung dịch $\mathrm{AgNO}_{3}$ dư vào $\mathrm{V} \mathrm{ml}$ dung dịch $\mathrm{Z}$, thu được $\mathrm{m}_{3}$ gam kết tủa. Biết các phản ứng xảy ra hoàn toàn và $\mathrm{m}_{1}<\mathrm{m}_{2}<\mathrm{m}_{3}$. Trong số các cặp chất $(\mathrm{X}, \mathrm{Y})$ sau:
(a) $\mathrm{NaCl}, \mathrm{FeCl}_{2}$
(b) $\mathrm{NaNO}_{3}, \mathrm{BaCl}_{2}$
(c) $\mathrm{KCl}, \mathrm{Ba}\left(\mathrm{HCO}_{3}\right)_{2}$
(d) $\mathrm{Ca}\left(\mathrm{HCO}_{3}\right)_{2}, \mathrm{CaCl}_{2}$
(e) $\mathrm{NaHCO}_{3}, \mathrm{CaCl}_{2}$
Số cặp chất thỏa mãn là:
A. 2.
B. 5 .
C. 4 .
D. 1 .
\section{Hướng dẫn}
Vì khối lượng kết tủa khi $\mathrm{Z}$ pứ với $\mathrm{K}_{2} \mathrm{CO}_{3}$ lớn hơn $\mathrm{NaOH}$ nên $\mathrm{Z}$ là: $\mathrm{NaCl}, \mathrm{FeCl}_{2}$. Giả sử mỗi chất trong $\mathrm{Z}$ có $1 \mathrm{~mol}$.
Thí nghiệm 1: $\mathrm{FeCl}_{2}+2 \mathrm{NaOH} \rightarrow 2 \mathrm{NaCl}+\mathrm{Fe}(\mathrm{OH})_{2}$ suy ra $\mathrm{m}_{1}=90$ gam
Thí nghiệm 2: $\mathrm{FeCl}_{2}+\mathrm{K}_{2} \mathrm{CO}_{3} \rightarrow \mathrm{FeCO}_{3}+2 \mathrm{KCl}$ suy ra $\mathrm{m}_{2}=116$ gam
Thí nghiệm 3: $\mathrm{NaCl}+\mathrm{AgNO}_{3} \rightarrow \mathrm{NaNO}_{3}+\mathrm{AgCl} \quad \mathrm{FeCl}_{2}+3 \mathrm{AgNO}_{3} \rightarrow \mathrm{Fe}\left(\mathrm{NO}_{3}\right)_{3}+2 \mathrm{AgCl}+\mathrm{Ag}$ nên m$m_{3}=538,5$ gam
Câu 9. Thực hiện các thí nghiệm sau:
(a) Cho hỗn hợp $\mathrm{Cu}$ và $\mathrm{Fe}_{3} \mathrm{O}_{4}$ (tỉ lệ mol tương ứng 2:1) vào dung dịch $\mathrm{HCl}$ (dư).
(b) Cho $0,2 \mathrm{~mol} \mathrm{Na}$ vào $100 \mathrm{ml}$ dung dịch chứa $0,2 \mathrm{~mol} \mathrm{CuSO}_{4}$.
(c) Cho hỗn hợp $\mathrm{Ba}$ và $\mathrm{NaHCO}_{3}$ (tỉ lệ mol 1:1) vào nước (dư).
(d) Đun nóng dung dịch chứa $\mathrm{NaHCO}_{3}, \mathrm{CaCl}_{2}$ (tỉ lệ mol 1:1).
(e) Cho dung dịch $\mathrm{BaCl}_{2}$ dư vào dung dịch $\mathrm{KHSO}_{4}$.
(f) Cho hỗn hợp gồm $0,15 \mathrm{~mol} \mathrm{Na}$ và $0,1 \mathrm{~mol} \mathrm{Al}$ vào nước dư.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được dung dịch chứa hai chất tan là:
A. 2.
B. 5 .
C. 4.
D. 3 .
\section{Hướng dẫn}
(a) Không. $\mathrm{Fe}_{3} \mathrm{O}_{4}+8 \mathrm{HCl} \rightarrow \mathrm{FeCl}_{2}+2 \mathrm{FeCl}_{3}+4 \mathrm{H}_{2} \mathrm{O} \quad \mathrm{Cu}+2 \mathrm{FeCl}_{3} \rightarrow \mathrm{CuCl}_{2}+2 \mathrm{FeCl}_{2}$ dd gồm: $\mathrm{FeCl}_{2}, \mathrm{CuCl}_{2}, \mathrm{HCl}$
(b) Đúng. $\mathrm{Na}+\mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{NaOH}+0,5 \mathrm{H}_{2} \quad 2 \mathrm{NaOH}+\mathrm{CuSO}_{4} \rightarrow \mathrm{Na}_{2} \mathrm{SO}_{4}+\mathrm{Cu}(\mathrm{OH})_{2}$ dd gồm: $\mathrm{Na}_{2} \mathrm{SO}_{4}, \mathrm{NaOH}$ dư
(c) Không. $\mathrm{Ba}+2 \mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{Ba}(\mathrm{OH})_{2}+\mathrm{H}_{2} \quad \mathrm{Ba}(\mathrm{OH})_{2}+\mathrm{NaHCO}_{3} \rightarrow \mathrm{BaCO}_{3}+\mathrm{NaOH}+\mathrm{H}_{2} \mathrm{O}$ dd chỉ có $\mathrm{NaOH}$
(d) Đúng. 2 $2 \mathrm{NaHCO}_{3} \rightarrow \mathrm{Na}_{2} \mathrm{CO}_{3}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O} \quad \mathrm{Na}_{2} \mathrm{CO}_{3}+\mathrm{CaCl}_{2} \rightarrow 2 \mathrm{NaCl}+\mathrm{CaCO}_{3}$ dd gồm NaCl, $\mathrm{CaCl}_{2}$ dư
(e) Không. $\mathrm{BaCl}_{2}+\mathrm{KHSO}_{4} \rightarrow \mathrm{BaSO}_{4}+\mathrm{KCl}+\mathrm{HCl}$ dd gồm $\mathrm{KCl}, \mathrm{HCl}, \mathrm{BaCl}_{2}$ dư
(f) Đúng. $\mathrm{Na}+\mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{NaOH}+0,5 \mathrm{H}_{2} \quad \mathrm{NaOH}+\mathrm{Al}+\mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{NaAlO}_{2}+1,5 \mathrm{H}_{2}$ dd gồm $\mathrm{NaAlO}_{2}, \mathrm{NaOH}$ dư
Câu 10: Tại một nhà máy hóa chất có sự cố, sau tiếng nổ lớn, một cột khí $X$ màu vàng lục bốc lên, ngay sau đó cột khí này từ từ rơi xuống và bao trùm lấy nhà máy. Trong một khoảng thời gian ngắn, cây cối quanh nhà máy khô héo và chuyển màu. Các công nhân cảm thấy ngạt thở, cuống họng khô rát, nhức đầu, chóng mặt, một số thì bị ói mửa và bất tỉnh. Người ta đã lấy mẫu $X$ nghiên cứu và cho các kết quả sau:
(a) Khi cho khí $X$ tác dụng hoàn toàn với 11,2 gam sắt thì thu được 25,4 gam muối.
(b) Khí $\mathrm{X}$ tan trong nước tạo thành dung dịch có khả năng tẩy màu.
(c) Nhỏ dung dịch bạc nitrat vào dung dịch $X$ thấy xuất hiện kết tủa trắng.
(d) Trong phòng thí nghiệm, có thể thu khí $\mathrm{X}$ bằng phương pháp đẩy nước.
(e) Khí $\mathrm{X}$ tác dụng với dung dịch $\mathrm{NaOH}$, đun nóng được dung dịch nước Gia-ven.
(f) Sục khí sunfurơ vào dung dịch $\mathrm{X}$ rồi nhỏ dung dịch bari clorua vào thấy có kết tủa trắng.
Số nhận định đúng là:
A. 2 .
B. 4 .
C. 3 .
D. 5
Hướng dẫn
Khí màu vàng lục là $\mathrm{Cl}_{2}$
(a) Sai. Vì $\left|\begin{array}{l}\mathrm{FeCl}_{2}{ }^{\mathrm{a}} \\ \mathrm{FeCl}_{3}{ }^{\mathrm{b}}\end{array} \rightarrow\right| \begin{aligned} & 127 \mathrm{a}+162,5 \mathrm{~b}=25,4 \\ & \mathrm{a}+\mathrm{b}=0,2\end{aligned} \rightarrow \mid \begin{aligned} & \mathrm{a}=0,2 \\ & \mathrm{~b}=0 \rightarrow \text { (không có muối } \mathrm{FeCl}_{3} \text { ) }\end{aligned} \rightarrow$ sai
(b) Đúng. Vì nước clo $\mathrm{Cl}_{2}+\mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{HCl}+\mathrm{HClO}(\mathrm{HClO}$ có tính oxi rất mạnh, phá vỡ cấu trúc sắc tố của màu sắc)
(c) Đúng. $\mathrm{AgNO}_{3}+\mathrm{HCl} \rightarrow \mathrm{AgCl}_{\downarrow \text { (rráng) }}+\mathrm{HNO}_{3}$
(d) Sai. Vì $\mathrm{Cl}_{2}$ tan tốt trong nước: $\mathrm{Cl}_{2}+\mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{HCl}+\mathrm{HClO}$
(e) Đúng. Vì $\mathrm{Cl}_{2}+2 \mathrm{NaOH} \rightarrow \mathrm{NaCl}+\mathrm{NaClO}+\mathrm{H}_{2} \mathrm{O}$ (Nước Javen: $\mathrm{NaCl}, \mathrm{NaClO}, \mathrm{H}_{2} \mathrm{O}$ )
(f) Đúng. $\mathrm{SO}_{2}+\mathrm{Cl}_{2}+2 \mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{H}_{2} \mathrm{SO}_{4}+2 \mathrm{HCl} \quad \mathrm{BaCl}_{2}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow 2 \mathrm{HCl}+\mathrm{BaSO}_{4} \downarrow$ (ráng) Câu 11. Hòa tan hoàn toàn 14,01 gam hỗn hợp gồm $\mathrm{Na}, \mathrm{Na}_{2} \mathrm{O}, \mathrm{Ba}$ và $\mathrm{BaO}$ vào nước thu được 3,36 lít khí $\mathrm{H}_{2}$ (đktc) và dung dịch $\mathrm{X}$. Sục $\mathrm{V}$ lít khí $\mathrm{CO}_{2}$ (đktc) vào $\mathrm{X}$, thu được 1,97 gam kết tủa và dung dịch $\mathrm{Y}$. Cho từ từ dung dịch $\mathrm{HCl} 1 \mathrm{M}$ vào Y, sự phụ thuộc thể tích khí $\mathrm{CO}_{2}$ (đktc) thoát ra và thể tích dung dịch $\mathrm{HCl} 1 \mathrm{M}$ được biểu diễn theo đồ thị sau:
Giá trị của $\mathrm{V}$ là:
A. 5,376 .
B. 4,480 .
C. 5,600 .
D. 4,256 .
Hướng dẫn
$$
\mathrm{TH}_{1}\left|\begin{array}{l}
\mathrm{NaOH}^{\mathrm{u}} \\
\mathrm{Na}_{2} \mathrm{CO}_{3}^{\mathrm{v}}
\end{array} \rightarrow\right| \begin{aligned}
& \mathrm{u}+\mathrm{v}=\mathrm{a} \\
& \mathrm{u}+2 \mathrm{v}=1,6 \mathrm{a}
\end{aligned} \rightarrow\left|\begin{array}{l}
\mathrm{u}=0,4 \mathrm{a} \\
\mathrm{v}=0,6 \mathrm{a}
\end{array} \rightarrow \mathrm{X}\right| \begin{aligned}
& \mathrm{NaOH}^{1,6 \mathrm{a}} \\
& \mathrm{Ba}(\mathrm{OH})_{2}^{0,01}
\end{aligned} \rightarrow \mathrm{X}\left|\begin{array}{l}
\mathrm{Na}^{1,6 \mathrm{a}} \\
\mathrm{Ba}^{0,01} \\
\mathrm{O}^{\mathrm{b}}
\end{array} \rightarrow\right| \begin{aligned}
& 23.1,6 \mathrm{a}+1,37+16 \mathrm{~b}=14,01 \\
& \stackrel{\mathrm{BT} \cdot \mathrm{e}}{\rightarrow}, 1,6 \mathrm{a}+0,02=2 \mathrm{~b}+2.0,15 \\
& \rightarrow \mathrm{a}=0,3 \mathrm{~b}=0,1 \rightarrow \mathrm{V}=4,256 \rightarrow \mathrm{D}
\end{aligned}
$$$$
\mathrm{TH}_{2}\left|\begin{array}{l}
\mathrm{NaHCO}_{3}^{\mathrm{u}} \\
\mathrm{Na}_{2} \mathrm{CO}_{3}^{\mathrm{v}}
\end{array} \rightarrow\right| \begin{aligned}
& \mathrm{v}=\mathrm{a} \\
& \mathrm{u}+2 \mathrm{v}=1,6 \mathrm{a}
\end{aligned} \rightarrow \mathrm{u}<0 \rightarrow \text { loại }
$$
Câu 12: Cho 8,654 gam hỗn hợp khí $\mathrm{Cl}_{2}$ và $\mathrm{O}_{2}$ tác dụng vừa đủ với $0,396 \mathrm{~mol}$ hỗn hợp $\mathrm{Y}$ gồm $\mathrm{Mg}, \mathrm{Zn}, \mathrm{Al}$ thì thu được 23,246 gam hỗn hợp $\mathrm{Z}$ gồm muối clorua và oxit của 3 kim loại. Cho $\mathrm{Z}$ phản ứng vừa đủ với $\mathrm{V} \mathrm{ml}$ dung dịch $\mathrm{HCl}$ $2 \mathrm{M}$ thì thu được dung dịch $\mathrm{T}$. Cho từ từ dung dịch $\mathrm{Ba}(\mathrm{OH})_{2} 2 \mathrm{M}$ vào $\mathrm{T}$ đến khi khối lượng kết tủa thu được lớn nhất thì cần vừa đủ $212 \mathrm{ml}$. Giá trị của $\mathrm{V}$ là:
A. 780 .
B. 864.
C. 390 .
D. 848 .
Hướng dẫn
$$
\left(\mathrm{Cl}_{2}, \mathrm{O}_{2}\right)^{8,654 \mathrm{~g}}+\left.(\mathrm{Mg}, \mathrm{Al}, \mathrm{Zn})^{0,396} \rightarrow \mathrm{Z}^{23,246 \mathrm{~g}}\right|_{-} \mathrm{Cl} \stackrel{+\mathrm{HCl}: 2 \mathrm{~V}}{\longrightarrow} \mathrm{ddT} \stackrel{+\mathrm{Ba}(\mathrm{OH})_{2}: 0,424(\mathrm{~mol})}{\longrightarrow} \downarrow_{\max }
$$
$\mathrm{BaCl}_{2}^{0,424} \rightarrow \mathrm{Cl}^{0,848} ;||_{\mathrm{O}_{2}{ }^{\mathrm{b}}}^{\mathrm{Cl}^{\mathrm{a}}} \rightarrow\left|\begin{array}{l}\mathrm{n}_{\mathrm{HCl}}=2 \mathrm{n}_{\mathrm{O}(\mathrm{Z})} \\ \rightarrow \mathrm{n}_{\mathrm{HCl}}=4 \mathrm{~b}\end{array} \rightarrow\right| \begin{aligned} & 71 \mathrm{a}+32 \mathrm{~b}=8,654 \\ & \stackrel{\mathrm{BT} . \mathrm{Cl}}{\rightarrow} 2 \mathrm{a}+4 \mathrm{~b}=0,848\end{aligned} \rightarrow \mid \begin{aligned} & \mathrm{a}=0,034 \\ & \mathrm{~b}=0,195\end{aligned} \rightarrow \mathrm{V}=0,39 \rightarrow \mathrm{C}$
Câu 13: Nung nóng $\mathrm{m}$ gam hỗn hợp $\mathrm{X}$ gồm $\mathrm{Zn}, \mathrm{Mg}, \mathrm{Al}$ và $\mathrm{Cu}$ trong $\mathrm{O}_{2}$ dư, thu được $(2 \mathrm{~m}-21,7)$ gam hỗn hợp $\mathrm{Y}$ gồm các oxit. Hòa tan hết $\mathrm{Y}$ bằng lượng vừa đủ dung dịch gồm $\mathrm{HCl}$ 2aM và $\mathrm{H}_{2} \mathrm{SO}_{4} \mathrm{aM}$, thu được dung dịch chứa 76,425 gam hỗn hợp muối trung hòa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của $\mathrm{m}$ là:
A. 44,8 .
B. 24,5 .
C. 30,5 .
D. 22,3 .
Hướng dẫn
$\mathrm{n}_{\mathrm{O}}=\frac{\mathrm{m}-21,7}{16} \rightarrow\left|\begin{array}{l}\mathrm{n}_{\mathrm{H}^{+}}=2 \mathrm{n}_{\mathrm{O}} \rightarrow 4 \mathrm{a}=(\mathrm{m}-21,7): 8 \\ \mathrm{~m}+35,5.2 \mathrm{a}+96 \mathrm{a}=76,425\end{array} \rightarrow\right| \begin{aligned} & \mathrm{a}=0,275 \\ & \mathrm{~m}=30,5 \rightarrow \mathrm{C}\end{aligned}$
Câu 14: Hòa tan hết 31,44 gam hỗn hợp $\mathrm{X}$ gồm $\mathrm{Fe}, \mathrm{FeO}, \mathrm{Fe}_{2} \mathrm{O}_{3}$ và $\mathrm{Fe}_{3} \mathrm{O}_{4}$ vào dung dịch $\mathrm{HCl}$ (dư), thu được $0,045 \mathrm{~mol}$ $\mathrm{H}_{2}$ và dung dịch chứa a gam hỗn hợp muối. Mặt khác, hòa tan hoàn toàn $\mathrm{m}$ gam $\mathrm{X}$ trong dung dịch chứa $0,6 \mathrm{~mol}$ $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc, đun nóng, thu được dung dịch $\mathrm{Y}$ và $0,14 \mathrm{~mol} \mathrm{SO}_{2}$ (sản phẩm khử duy nhất của $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc). Cho $250 \mathrm{ml}$ dung dịch hỗn hợp gồm $\mathrm{NaOH} 1 \mathrm{M}$ và $\mathrm{KOH} 1 \mathrm{M}$ vào $\mathrm{Y}$, sau khi phản ứng kết thúc thu được 16,05 gam kết tủa chỉ chứa 1 chất. Giá trị của a gần nhất với:
A. $58,97$.
B. 39,32 .
C. 51,90 .
D. 31,19 .
Hướng dẫn
$$
\begin{aligned}
& \mathrm{X}\left|\begin{array}{l}
\mathrm{Fe} \\
\mathrm{O}
\end{array}-\right| \begin{array}{l}
31,44(\mathrm{~g}) \stackrel{+\mathrm{HCl}_{\mathrm{du}}}{\longrightarrow} \mathrm{H}_{2}^{0,045}+\mathrm{Muố}^{\mathrm{i}(\mathrm{g})} \\
\mathrm{m}(\mathrm{g}) \stackrel{+\mathrm{H}_{2} \mathrm{SO}_{4}{ }^{0,6}}{\longrightarrow} \mathrm{SO}_{2}^{0,14}+\mathrm{ddY} \stackrel{+\mathrm{NaOH}^{0,25} ; \mathrm{KOH}^{0,25}}{\longrightarrow} \mathrm{Fe}(\mathrm{OH})_{3}^{0,15}
\end{array} \\
& \left.\left|\begin{array}{l}
\mathrm{H}_{2} \mathrm{SO}_{4}^{0,6} \\
\mathrm{SO}_{2}{ }^{0,14}
\end{array} \rightarrow \mathrm{G}\right| \begin{array}{l}
(\mathrm{Na}, \mathrm{K})_{2} \mathrm{SO}_{4}^{0,25} \\
\mathrm{Fe}_{2}\left(\mathrm{SO}_{4}\right)_{3}^{0,07}
\end{array} \rightarrow \mathrm{X}\right|_{\mathrm{O}^{\mathrm{b}}} ^{\mathrm{Fe}^{0,29}} \rightarrow\left|\begin{array}{l}
3 \mathrm{n}_{\mathrm{Fe}}=2 \mathrm{n}_{\mathrm{O}}+2 \mathrm{n}_{\mathrm{SO}_{2}} \\
\rightarrow \mathrm{b}=0,295 \stackrel{31,44 \mathrm{~g}}{\longrightarrow} \mathrm{k}=1,5
\end{array} \rightarrow \mathrm{X}\right| \begin{array}{l}
\mathrm{Fe}^{0,435} \\
\mathrm{O}^{0,4425}
\end{array} \rightarrow\left|\begin{array}{l}
\mathrm{Fe}^{0,435} \\
\mathrm{Cl}^{0,975}
\end{array} \rightarrow\right| \begin{array}{l}
\mathrm{m}=58,9725 \\
\rightarrow \mathrm{A}
\end{array}
\end{aligned}
$$
Câu 15: Cho sơ đồ phản ứng sau:
(1) $(\mathrm{X})+\mathrm{HCl} \rightarrow\left(\mathrm{X}_{1}\right)+\left(\mathrm{X}_{2}\right)+\mathrm{H}_{2} \mathrm{O}$
(5) $\left(\mathrm{X}_{2}\right)+\mathrm{Ca}(\mathrm{OH})_{2} \rightarrow\left(\mathrm{X}_{7}\right)$
(2) $\left(\mathrm{X}_{1}\right)+\mathrm{NaOH} \rightarrow\left(\mathrm{X}_{3}\right)+\left(\mathrm{X}_{4}\right)$
(6) $\left(\mathrm{X}_{7}\right)+\mathrm{NaOH} \rightarrow\left(\mathrm{X}_{8}\right)+\left(\mathrm{X}_{9}\right)+\ldots$
(3) $\left(\mathrm{X}_{1}\right)+\mathrm{Cl}_{2} \quad \rightarrow\left(\mathrm{X}_{5}\right)$
(7) $\left(\mathrm{X}_{8}\right)+\mathrm{HCl} \rightarrow\left(\mathrm{X}_{2}\right)+\ldots$
(4) $\left(X_{3}\right)+\mathrm{H}_{2} \mathrm{O}+\mathrm{O}_{2} \rightarrow\left(\mathrm{X}_{6}\right)$
(8) $\left(\mathrm{X}_{5}\right)+\left(\mathrm{X}_{9}\right)+\mathrm{H}_{2} \mathrm{O} \rightarrow\left(\mathrm{X}_{4}\right)+\ldots$
Biết $\mathrm{X}_{5}$ có màu nâu đỏ, cho các nhận định sau:
(a) $\mathrm{X}_{7}$ có khả năng tác dụng với dung dịch $\mathrm{HCl}$.
(b) $X_{3}$ không tan trong nước, màu nâu đỏ.
(c) Đốt cháy dây sắt trong oxi tạo ra $X$.
(d) $\mathrm{X}_{8}$ không tan trong nước, tan trong nước bão hòa $\mathrm{CO}_{2}$.
(e) $\mathrm{X}_{2}$ là sản phẩm của phản ứng khi đốt nóng sắt trong khí clo.
Số nhận định đúng là:
A. 2.
B. 5 .
C. 4 .
D. 3 .
Hướng dẫn
$$
\left|\begin{array}{l}
\mathrm{X}_{5}: \mathrm{FeCl}_{3} \\
\mathrm{X}_{1}: \mathrm{FeCl}_{2}
\end{array} ; \begin{array}{l}
\mathrm{X}: \mathrm{FeCO}_{3} \\
\mathrm{X}_{2}: \mathrm{CO}_{2}
\end{array} ;\right| \begin{aligned}
& \mathrm{X}_{7}: \mathrm{Ca}\left(\mathrm{HCO}_{3}\right)_{2} \\
& \mathrm{X}_{8}: \mathrm{CaCO}_{3}
\end{aligned} ; \mid \begin{aligned}
& \mathrm{X}_{9}: \mathrm{Na}_{2} \mathrm{CO}_{3} \\
& \mathrm{X}_{4}: \mathrm{NaCl}
\end{aligned} ; \begin{aligned}
& \mathrm{X}_{3}: \mathrm{Fe}(\mathrm{OH})_{2} \\
& \mathrm{X}_{6}: \mathrm{Fe}(\mathrm{OH})_{3}
\end{aligned} \stackrel{\text { Đúng }}{\longrightarrow} \mathrm{a}, \mathrm{d} \rightarrow \mathrm{A}
$$
Câu 16: Đặt hai cốc $\mathrm{A}$ và $\mathrm{B}$ chứa dung dịch $\mathrm{HCl}$ loãng (dùng dư) trên hai đĩa cân, cân ở trạng thái cân bằng. Thực hiện các thí nghiệm sau:
(b) Cho $1 \mathrm{~mol} \mathrm{Fe}$ vào cốc $\mathrm{A}$ và $1 \mathrm{~mol} \mathrm{CaO}$ vào cốc $\mathrm{B}$.
(c) $\mathrm{Cho} 1 \mathrm{~mol} \mathrm{FeO}$ vào cốc $\mathrm{A}$ và $1 \mathrm{~mol} \mathrm{FeCO}_{3}$ vào cốc $\mathrm{B}$.
(d) Cho $1 \mathrm{~mol} \mathrm{Na}_{2} \mathrm{~S}$ vào cốc $\mathrm{A}$ và $1 \mathrm{~mol} \mathrm{Al}(\mathrm{OH})_{3}$ vào cốc $\mathrm{B}$.
(e) Cho $1 \mathrm{~mol} \mathrm{FeS}$ vào cốc $\mathrm{A}$ và $1 \mathrm{~mol} \mathrm{Fe}$ vào cốc $\mathrm{B}$.
(g) Cho $1 \mathrm{~mol} \mathrm{NaOH}$ vào cốc $\mathrm{A}$ và $1 \mathrm{~mol} \mathrm{MgCO}_{3}$ vào cốc $\mathrm{B}$.
Giả sử nước bay hơi không đáng kể, sau khi các phản ứng xảy ra hoàn toàn, số trường hợp cân trở lại cân bằng là:
A. 2 .
B. 4 .
C. 5.
D. 3 .
\section{Hướng dẫn}
Ta xét khối lượng tăng của mỗi cốc:
(a) Được. $\mathrm{CaCO}_{3}+2 \mathrm{HCl} \rightarrow \mathrm{CaCl}_{2}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O}$
$\mathrm{KHCO}_{3}+\mathrm{HCl} \rightarrow \mathrm{KCl}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O}$
Ta có: $\mathrm{m}($ cốc $\mathrm{A})=\mathrm{mCaCO}_{3}-\mathrm{mCO}_{2}=56$ gam.
$\mathrm{m}($ cốc $\mathrm{B})=\mathrm{mKHCO}_{3}-\mathrm{mCO}_{2}=56$ gam.
(b) Không. $\mathrm{Fe}+2 \mathrm{HCl} \rightarrow \mathrm{FeCl}_{2}+\mathrm{H}_{2}$ suy ra $\mathrm{m}$ (cốc $\left.\mathrm{A}\right)=\mathrm{mFe}-\mathrm{mH}_{2}=54<\mathrm{m}$ (cốc B) $=56$
(c) Được. $\mathrm{FeCO}_{3}+2 \mathrm{HCl} \rightarrow \mathrm{FeCl}_{2}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O}$ suy ra m(cốc B) $=\mathrm{mFeCO}_{3}-\mathrm{mCO}_{2}=72=\mathrm{m}($ cốc $\mathrm{A}$ )
(d) Không. $\mathrm{Na}_{2} \mathrm{~S}+2 \mathrm{HCl} \rightarrow 2 \mathrm{NaCl}+\mathrm{H}_{2} \mathrm{~S} \quad \mathrm{Al}(\mathrm{OH})_{3}+3 \mathrm{HCl} \rightarrow \mathrm{AlCl}_{3}+3 \mathrm{H}_{2} \mathrm{O}$
Suy $\operatorname{ra} \mathrm{m}($ cốc $\mathrm{A})=\mathrm{mNa}_{2} \mathrm{~S}-\mathrm{mH}_{2} \mathrm{~S}=44<\mathrm{m}($ cốc B) $=78$
(e) Được. $\mathrm{FeS}+2 \mathrm{HCl} \rightarrow \mathrm{FeCl}_{2}+\mathrm{H}_{2} \mathrm{~S} \quad \mathrm{Fe}+2 \mathrm{HCl} \rightarrow \mathrm{FeCl}_{2}+\mathrm{H}_{2}$
Suy ra $\mathrm{m}\left(\right.$ cốc A) $=\mathrm{mFeS}-\mathrm{mH}_{2} \mathrm{~S}=54$ gam $\mathrm{m}($ cốc B $)=\mathrm{mFe}-\mathrm{mH}_{2}=54$ gam
(g) Được. $\mathrm{MgCO}_{3}+2 \mathrm{HCl} \rightarrow \mathrm{MgCl}_{2}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O}$ suy ra $\mathrm{m}$ (cốc $\left.\mathrm{B}\right)=\mathrm{mMgCO}_{3}-\mathrm{mCO}_{2}=40=\mathrm{m}($ cốc A)
Câu 17: Cho a gam một muối halogenua của một kim loại kiềm tác dụng với $125 \mathrm{ml}$ dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc, nóng vừa đủ. Sau khi phản ứng xảy ra hoàn toàn, để nguội, thu được hỗn hợp sản phẩm $\mathrm{X}$ trong đó có một khí $\mathrm{Y}$ (mùi trứng thối). Cho toàn bộ khí $\mathrm{Y}$ tác dụng với dung dịch $\mathrm{Cu}\left(\mathrm{NO}_{3}\right)_{2}$ dư thu được 14,4 gam kết tủa màu đen. Phần sản phẩm còn lại, làm khô thu được 237,6 gam chất rắn T. Nung T đến khối lượng không đổi thu được 85,2 gam muối duy nhất. Biết các phản ứng xảy ra hoàn toàn. Giá trị của $\mathrm{a}$ là:
A. 256 .
B. 180 .
C. 190 .
D. 204 .
Hướng dẫn
$$
\begin{aligned}
& \mathrm{nI}_{2}=\frac{237,6-85,2}{254}=0,6 \rightarrow \mid \begin{array}{l}
\mathrm{MI}^{1,2} \\
\mathrm{M}_{2} \mathrm{SO}_{4}{ }^{85,2 \mathrm{~g}}
\end{array} \rightarrow \mathrm{M}=23 \rightarrow \mathrm{NaI} \rightarrow \mathrm{B}
\end{aligned}
$$
Câu 18: Hỗn hợp $X(\mathrm{Na}, \mathrm{K}, \mathrm{Ba})$ trong $X$ có số mol của $B a$ bằng một nửa số mol của hỗn hợp. Cho $\mathrm{m}$ gam hỗn hợp $X$ tan hết trong $\mathrm{H}_{2} \mathrm{O}$, thu được dung dịch $\mathrm{Y}$ và khí $\mathrm{H}_{2}$. Cho toàn bộ khí $\mathrm{H}_{2}$ tạo ra đi qua một ống chứa $0,3 \mathrm{~mol} \mathrm{CuO}$ và 0,2 mol $\mathrm{FeO}$ nung nóng, sau phản ứng thu được 33,6 gam chất rắn trong ống. Đem toàn bộ dung dịch $\mathrm{Y}$ cho vào một dung dịch chứa $0,3 \mathrm{~mol} \mathrm{HCl}, 0,02 \mathrm{~mol} \mathrm{AlCl}_{3}$ và $0,05 \mathrm{~mol} \mathrm{Al}_{2}\left(\mathrm{SO}_{4}\right)_{3}$ thu được y gam kết tủa. Biết các phản ứng hoàn toàn. Giá trị của y là:
A. 41,19 .
B. 52,30 .
C. 37,58 .
D. 42,75 .
Hướng dẫn
Ta có: $\mathrm{m}($ rắn giảm $)=\mathrm{m}(\mathrm{CuO}, \mathrm{FeO})_{\text {(ban đảuu) }}-\mathrm{m}($ rắn sau pứ $)=4,8 \rightarrow \mathrm{nO}_{\text {(bị mát di) }}=\mathrm{nH}_{2 \text { (púr) }}=0,3 \cdot \mathrm{H}_{2} \mathrm{O}+2 \mathrm{e} \rightarrow 2 \mathrm{OH}^{-}+\mathrm{H}_{2}$
Câu 19: Đốt cháy hoàn toàn 5 gam hỗn hợp $\mathrm{C}$ và $\mathrm{S}$ trong $\mathrm{O}_{2}$ vừa đủ thu được hỗn hợp $\mathrm{X}$ gồm $\mathrm{CO}_{2}$ và $\mathrm{SO}_{2}$. Dẫn $\mathrm{X}$ từ từ qua 100 $\mathrm{ml}$ dung dịch $\mathrm{Y}$ chứa $\mathrm{NaOH}$ và $\mathrm{KOH}$ đến phản ứng hoàn toàn thu được $\mathrm{V}_{1} \mathrm{ml}$ dung dịch $\mathrm{Z}$ chỉ chứa $\mathrm{m}_{1}$ gam muối. Cho dung dịch nước vôi trong dư vào dung dịch $\mathrm{Z}$ thì thấy xuất hiện 27 gam kết tủa. Nếu dẫn $\mathrm{X}$ từ từ qua $150 \mathrm{ml}$ dung dịch $\mathrm{Y}$ đến phản ứng hoàn toàn thì thu được $\mathrm{V}_{2} \mathrm{ml}$ dung dịch $\mathrm{T}$, cô cạn $\mathrm{T}$ thu được $\mathrm{m}_{2}$ gam rắn khan. Biết $\mathrm{m}_{2}-\mathrm{m}_{1}=8,645$ gam và khi trộn $2,5 \mathrm{~V}_{1} \mathrm{ml}$ dung dịch $\mathrm{Z}$ với $\mathrm{V}_{2} \mathrm{ml}$ dung dịch $\mathrm{T}$ thì dung dịch sau phản ứng chỉ chứa các muối trung hòa. Giá trị $\left(\mathrm{m}_{1}+\mathrm{m}_{2}\right)$ gần nhất với:
A. 67.
B. 64
C. 57.
D. 54 .
Hướng dẫn
$\mathrm{ddZ}^{2,5 \mathrm{~V}_{1}(\mathrm{ml})}+\mathrm{ddT}^{\mathrm{V}_{2}(\mathrm{ml})} \rightarrow$ muối trung hòa
$\left|\begin{array}{l}\mathrm{C}^{\mathrm{x}} \\ \mathrm{S}^{\mathrm{y}}\end{array} \rightarrow\right| \begin{aligned} & \mathrm{CaCO}_{3}{ }^{\mathrm{x}} \\ & \mathrm{CaSO}_{3}{ }^{\mathrm{y}}\end{aligned} \rightarrow\left|\begin{array}{l}12 \mathrm{x}+32 \mathrm{y}=5 \\ 100 \mathrm{x}+120 \mathrm{y}=27\end{array} \rightarrow\right| \begin{aligned} & \mathrm{x}=0,15 \\ & \mathrm{y}=0,1\end{aligned} \rightarrow \mathrm{AO}_{2}\left|\begin{array}{l}\mathrm{n}=0,25 \\ \mathrm{~A}=20\end{array} \rightarrow \mathrm{Z}\right| \begin{aligned} & \mathrm{Na}_{2} \mathrm{AO}_{3}: \mathrm{a} \\ & \mathrm{NaHAO}_{3}: 0,25-\mathrm{a}\end{aligned} \rightarrow \mathrm{T} \mid \begin{aligned} & \mathrm{Na}_{2} \mathrm{AO}_{3}: 0,25 \\ & \mathrm{NaOH}_{\mathrm{du}}: 1,5 \mathrm{a}-0,125\end{aligned}$
$\mid \begin{aligned} & \mathrm{m}_{1}=114 \mathrm{a}+92(0,25-\mathrm{a}) \\ & \mathrm{m}_{2}=114.0,25+40(1,5 \mathrm{a}-0,125)\end{aligned} \stackrel{8,645 \mathrm{~g}}{\longrightarrow} \mathrm{a}=\frac{1629}{7600} \rightarrow\left(\mathrm{m}_{1}+\mathrm{m}_{2}\right)=64,076 \rightarrow \mathrm{B}$
Câu 20: Nung nóng $\mathrm{m}$ gam hỗn hợp gồm $\mathrm{Cu}$ và $\mathrm{Fe}$ (tỷ lệ mol 3:4) rồi cho một luồng khí $\mathrm{O}_{2}$ đi qua sau một thời gian thu được $(\mathrm{m}+0,64)$ gam hỗn hợp rắn $\mathrm{X}$. Hòa tan hoàn toàn lượng $\mathrm{X}$ trên vào dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc, nóng, dư thu được dung dịch $\mathrm{Y}$ và $\mathrm{V}$ lít khí $\mathrm{SO}_{2}$ (đktc, sản phẩm khử duy nhất). Cho dung dịch $\mathrm{Ba}(\mathrm{OH})_{2}$ dư vào $\mathrm{Y}$ thấy xuất hiện 75,02 gam kết tủa $Z$. Lấy toàn bộ lượng $Z$ trên nung tới khối lượng không đổi thu được 71,78 gam chất rắn $T$.
Cho các phát biểu sau:
(a) Giá trị của m là 8,23 .
(b) Giá trị của V là 3,136 .
(c) Số $\mathrm{mol} \mathrm{H}_{2} \mathrm{SO}_{4}$ đã dùng ban đầu là $0,4 \mathrm{~mol}$.
(d) Số $\mathrm{mol} \mathrm{H}_{2} \mathrm{SO}_{4}$ trong dung dịch $\mathrm{Y}$ là 0,06 mol.
(e) $\%$ khối lượng của $\mathrm{O}$ trong $\mathrm{Z}$ là $29,86 \%$.
Số phát biểu đúng là :
A. 5 .
B. 2 .
C. 3 .
D. 4 .
Hướng dẫn
B. PHẦN TƯ’ LUẬN. (10,0 điểm)
Câu I (1,5 điểm).
1. Cho sơ đồ thí nghiệm sau:
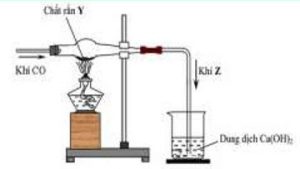
Viết các phương trình phản ứng xảy ra. Biết chất rắn $\mathrm{Y}$ gồm: $\mathrm{CuO}, \mathrm{Al}_2 \mathrm{O}_3, \mathrm{MgO}, \mathrm{Fe}_3 \mathrm{O}_4, \mathrm{PbO}$.
2. Xác định các chất $\mathrm{A}, \mathrm{B}, \mathrm{D}, . . \mathrm{M}$ trong sơ đồ các phản ứng sau và viết phương trình hóa học để hoàn thành các phản ứng đó: (Biết $\mathrm{A}$ là hợp chất của $\mathrm{Na}$ )
a. $(\mathrm{A})+(\mathrm{B}) \longrightarrow(\mathrm{D})+\mathrm{H}_2 \mathrm{O}$
b. (A) $+(\mathrm{E}) \longrightarrow(\mathrm{F})+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O}$
c. $(\mathrm{A})+(\mathrm{G}) \longrightarrow(\mathrm{H})+(\mathrm{B})+\mathrm{H}_2 \mathrm{O}$
d. $(\mathrm{A})+(\mathrm{I}) \longrightarrow(\mathrm{D})+(\mathrm{J})+\mathrm{H}_2 \mathrm{O}$
e. $(\mathrm{A}) \longrightarrow(\mathrm{D})+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O}$
f. $(\mathrm{A})+(\mathrm{K}) \longrightarrow(\mathrm{L})+(\mathrm{M})+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O}$
Hướng dẫn
1. $\mathrm{CO}+\mathrm{CuO} \rightarrow \mathrm{Cu}+\mathrm{CO}_2 \quad 3 \mathrm{CO}+\mathrm{Fe}_3 \mathrm{O}_4 \rightarrow 3 \mathrm{Fe}+4 \mathrm{CO}_2$
$\mathrm{CO}+\mathrm{PbO} \rightarrow \mathrm{Pb}+\mathrm{CO}_2 \mathrm{CO}_2+\mathrm{Ca}(\mathrm{OH})_2 \rightarrow \mathrm{CaCO}_3+\mathrm{H}_2 \mathrm{O}$
2. $\left|\begin{array}{l}\mathrm{A}: \mathrm{NaHCO}_3 \\ \mathrm{D}: \mathrm{Na}_2 \mathrm{CO}_3\end{array} ;\right| \begin{aligned} & \mathrm{B}: \mathrm{NaOH} \\ & \mathrm{G}: \mathrm{Ba}(\mathrm{OH})_2\end{aligned} ;\left|\begin{array}{l}\mathrm{H}: \mathrm{BaCO}_3 \\ \mathrm{I}: \mathrm{Ca}(\mathrm{OH})_2\end{array} ;\right| \begin{aligned} & \mathrm{J}: \mathrm{CaCO}_3 \\ & \mathrm{E}: \mathrm{HCl}\end{aligned} ;\left|\begin{array}{l}\mathrm{F}: \mathrm{NaCl} \\ \mathrm{K}: \mathrm{KHSO}_4\end{array} ;\right| \begin{aligned} & \mathrm{L}: \mathrm{Na}_2 \mathrm{SO}_4 \\ & \mathrm{M}: \mathrm{K}_2 \mathrm{SO}_4\end{aligned}$
$$
\begin{array}{ll}
\mathrm{NaHCO}_3+\mathrm{NaOH} \rightarrow \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{H}_2 \mathrm{O} & \mathrm{NaHCO}_3+\mathrm{HCl} \rightarrow \mathrm{NaCl}+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O} \\
\mathrm{NaHCO}_3+\mathrm{Ba}(\mathrm{OH})_2 \rightarrow \mathrm{BaCO}_3+\mathrm{NaOH}+\mathrm{H}_2 \mathrm{O} & 2 \mathrm{NaHCO}_3+\mathrm{Ca}(\mathrm{OH})_2 \rightarrow \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{CaCO}_3+2 \mathrm{H}_2 \mathrm{O} \\
2 \mathrm{NaHCO}_3 \rightarrow \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O} & 2 \mathrm{NaHCO}_3+2 \mathrm{KHSO}_4 \rightarrow \mathrm{Na}_2 \mathrm{SO}_4+\mathrm{K}_2 \mathrm{SO}_4+2 \mathrm{CO}_2+2 \mathrm{H}_2 \mathrm{O}
\end{array}
$$
Câu II (1,5 điểm).
1. Chất rắn $\mathrm{A}$ có sẵn trong tự nhiên dưới dạng nhiều loại khoáng khác nhau. Nung nóng $\mathrm{A}$ ở $1100^{\circ} \mathrm{C}$ là phương pháp để sản xuất lượng lớn chất $\mathrm{B}$. Cho $\mathrm{B}$ phản ứng với nước sẽ được chất $\mathrm{D}$ và tỏa nhiều nhiệt. Trong phòng thí nghiệm, dung dịch nước của $\mathrm{D}$ được dùng để phát hiện khí $\mathrm{E}$. Khí $\mathrm{E}$ được sử dụng trong rất nhiều loại nước giải khát.
a. Viết các phương trình phản ứng thể hiện các biến đổi hóa học ở trên.
b. Khí $\mathrm{E}$ ở trên có nhiều ứng dụng trong công nghiệp, một trong số đó là điều chế muối $\mathrm{F}$ (không bền) theo phương pháp Solvay: cho một lượng bằng nhau về số mol của $\mathrm{NH}_3$ và khí $\mathrm{E}$ sục qua dung dịch natri clorua (nước biển) ở nhiệt độ thấp. Sản phẩm tạo thành ngoài muối $\mathrm{F}$ còn có muối amoni clorua $\mathrm{NH}_4 \mathrm{Cl}$. Do ít tan ở nhiệt độ thấp nên muối $\mathrm{F}$ sẽ kết tủa. Viết phản ứng điều chế muối $\mathrm{F}$ theo phương pháp Solvay.
Hướng dẫn
a. Khí $\mathrm{E}$ được sử dụng trong nước giải khát nên $\mathrm{E}$ là $\mathrm{CO}_2$
$\mathrm{B}$ pứ với nước tạo $\mathrm{D}$, pứ tỏa nhiều nhiệt, $\mathrm{D}$ dùng để phát hiện $\mathrm{CO}_2$ nên $\mathrm{B}: \mathrm{CaO} ; \mathrm{D}: \mathrm{Ca}(\mathrm{OH})_2 ; \mathrm{A}: \mathrm{CaCO}_3$
$$
\mathrm{CaCO}_3 \rightarrow \mathrm{CaO}+\mathrm{CO}_2 \quad \mathrm{CaO}+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{Ca}(\mathrm{OH})_2 \quad \mathrm{CO}_2+\mathrm{Ca}(\mathrm{OH})_2 \rightarrow \mathrm{CaCO}_3+\mathrm{H}_2 \mathrm{O}
$$
b. $\mathrm{NH}_3+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{NH}_4 \mathrm{HCO}_3 \quad \mathrm{NH}_4 \mathrm{HCO}_3+\mathrm{NaCl} \rightarrow \mathrm{NH}_4 \mathrm{Cl}+\mathrm{NaHCO}_3(\mathrm{~F})$
2. Cho các chất $X, Y, Z, T$ (đều bị phân hủy ở nhiệt độ cao) thỏa mãn các tính chất sau:
– X dùng làm bột nở, tác dụng với dung dịch $\mathrm{HCl}$ hoặc dung dịch $\mathrm{NaOH}$ dư, đun nóng đều sủi bọt khí.
– $\mathrm{Y}$ có trong thành phần thuốc chữa đau dạ dày, tạo sản phẩm khí khi tác dụng với dung dịch $\mathrm{HCl}$ và tạo kết tủa trắng với dung dịch $\mathrm{Ca}(\mathrm{OH})_2$.
– $\mathrm{Z}$ thường được dùng để điều chế oxi trong phòng thí nghiệm.
– Nung $\mathrm{T}$ thu được chất rắn $\mathrm{M}$ dùng để khử trùng chuồng trại chăn nuôi, điều chế vôi sữa,..
Biết tổng khối lượng mol phân tử của $X, Y, Z, T$ là 421. Xác định các chất $X, Y, Z, T$, giải thích và viết các phương trình phản ứng minh họa.
Hướng dẫn
– $\mathrm{X}$ là: $\mathrm{NH}_4 \mathrm{HCO}_3+\mathrm{HCl} \rightarrow \mathrm{NH}_4 \mathrm{Cl}+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O}$
$\mathrm{NH}_4 \mathrm{HCO}_3+2 \mathrm{NaOH} \rightarrow \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{NH}_3+2 \mathrm{H}_2 \mathrm{O}$
– $\mathrm{Y}$ là: $\mathrm{NaHCO}_3+\mathrm{HCl} \rightarrow \mathrm{NaCl}+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O}$
$\mathrm{NaHCO}_3+\mathrm{Ca}(\mathrm{OH})_2 \rightarrow \mathrm{CaCO}_3+\mathrm{NaOH}+\mathrm{H}_2 \mathrm{O}$
$2 \mathrm{NaHCO}_3+\mathrm{Ca}(\mathrm{OH})_2 \rightarrow \mathrm{CaCO}_3+\mathrm{Na}_2 \mathrm{CO}_3+2 \mathrm{H}_2 \mathrm{O}$
$-\mathrm{Z}$ là: $2 \mathrm{KMnO}_4 \rightarrow \mathrm{K}_2 \mathrm{MnO}_4+\mathrm{MnO}_2+\mathrm{O}_2$
– T là: $\mathrm{CaCO}_3 \rightarrow \mathrm{CaO}+\mathrm{CO}_2$ thu được vôi bột $\mathrm{CaO}: \quad \mathrm{CaO}+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{Ca}(\mathrm{OH})_2$ (vôi sũa)
Câu III (3,0 điểm).
1. Hòa tan hoàn toàn 21,24 gam hỗn hợp $\mathrm{A}$ gồm muối hiđrocacbonat $\mathrm{X}$ và muối cacbonat $\mathrm{Y}$ vào nước thu được $200 \mathrm{ml}$ dung dịch $\mathrm{Z}$. Cho từ từ $200 \mathrm{ml}$ dung dịch $\mathrm{KHSO}_4 0,3 \mathrm{M}$ và $\mathrm{HCl} 0,45 \mathrm{M}$ vào $200 \mathrm{ml}$ dung dịch $\mathrm{Z}$ thu được 1,344 lít khí $\mathrm{CO}_2$ (đktc) và dung dịch $\mathrm{T}$. Cho dung dịch $\mathrm{Ba}(\mathrm{OH})_2$ dư vào $\mathrm{T}$, thu được 49,44 gam kết tủa. Biết $\mathrm{X}$ là muối của kim loại kiềm. Xác định công thức phân tử của $\mathrm{X}, \mathrm{Y}$ và tính phần trăm khối lượng mỗi muối trong $\mathrm{A}$.
Hướng dẫn
$\mathrm{X}, \mathrm{Y}$ đều tan trong nước nên 49,44 gam kết tủa không có hidroxit không tan. Vậy kết tủa gồm: $\mathrm{BaSO}_4, \mathrm{BaCO}_3$
Vậy hai muối là $\mathrm{NaHCO}_3: 59,32 \%$ và $\left(\mathrm{NH}_4\right)_2 \mathrm{CO}_3: 40,68 \%$
2. $X$ là một muối nhôm khan, $\mathrm{Y}$ là một muối vô cơ khan. Hòa tan a gam hỗn hợp $\mathrm{X}$ và $\mathrm{Y}(\mathrm{X}, \mathrm{Y}$ có cùng số mol) vào $200 \mathrm{ml}$ nước được dung dịch $\mathrm{A}$. Cho dung dịch $\mathrm{Ba}(\mathrm{OH})_2$ dư vào dung dịch $\mathrm{A}$ thu được dung dịch $\mathrm{B}$, khí $\mathrm{D}$ và 7,689 gam kết tủa $\mathrm{E}$ ( $\mathrm{E}$ không tan trong axit mạnh). Trung hòa $\mathrm{B}$ bằng dung dịch $\mathrm{HNO}_3$ dư, sau đó thêm $\mathrm{AgNO}_3$ vào thì thấy xuất hiện kết tủa màu trắng bị đen dần khi để ngoài ánh sáng. Mặt khác, khi thêm $\mathrm{Ba}(\mathrm{OH})_2$ vào $\mathrm{A}$ cho đến khi đạt lượng kết tủa lớn nhất (kết tủa $\mathrm{F}$ ) thì dừng lại. Nung $\mathrm{F}$ tới khối lượng không đổi thu được 9,372 gam chất rắn.
a. Xác định công thức của các muối $X, Y$.
b. Tính a và nồng độ $\mathrm{mol} / \mathrm{l}$ của các chất trong dung dịch $\mathrm{A}$.
Hướng dẫn
Nhận thấy: – $\mathrm{X}, \mathrm{Y}$ pứ với $\mathrm{Ba}(\mathrm{OH})_2$ cho khí $\mathrm{NH}_3$ nên có gốc $\mathrm{NH}_4^{+}$, thu được $\mathrm{BaSO}_4$ nên có muối $\mathrm{SO}_4{ }^{2-}$, khi cho $\mathrm{AgNO}_3$ vào có kết tủa trắng sau hóa đen thì có gốc muối $\mathrm{Cl}^{-}$.
– $\mathrm{A}$ pứ với $\mathrm{Ba}(\mathrm{OH})_2$ đến khi đạt kết tủa max thì $\mathrm{mBaSO}_4=7,689 \rightarrow \mathrm{mAl}_2 \mathrm{O}_3=1,683 \rightarrow \mathrm{nAl}_2 \mathrm{O}_3=0,0165$.
$$
\begin{aligned}
& \text { – } \mid \begin{array}{l}
\mathrm{Al}_2 \mathrm{O}_3^{0,0165} \rightarrow \mathrm{Al}^{0,033} \\
\mathrm{BaSO}_4^{0,033} \rightarrow \mathrm{SO}_4^{0,033}
\end{array} \rightarrow \text { không có } \mathrm{Al}_2\left(\mathrm{SO}_4\right)_3 \rightarrow \mathrm{TH}_1\left|\begin{array}{l}
\mathrm{AlCl}_3 \\
\left(\mathrm{NH}_4\right)_2 \mathrm{SO}_4
\end{array} ; \mathrm{TH}_2\right| \begin{array}{l}
\mathrm{AlCl}_3 \\
\mathrm{NH}_4 \mathrm{HSO}_4
\end{array} \\
& \mathbf{T H}_1: \mathrm{A} \mid \begin{array}{l}
\mathrm{AlCl}_3^{0,033} \rightarrow 0,165 \mathrm{M} \\
\left(\mathrm{NH}_4\right)_2 \mathrm{SO}_4^{0,033} \rightarrow 0,165 \mathrm{M}
\end{array} \text { và } \mathrm{a}=8,7615 \quad \mathbf{T H}_2: \mathrm{A} \mid \begin{array}{l}
\mathrm{AlCl}_3^{0,033} \rightarrow 0,165 \mathrm{M} \\
\mathrm{NH}_4 \mathrm{HSO}_4^{0,033} \rightarrow 0,165 \mathrm{M}
\end{array} \text { và } \mathrm{a}=8,2005 \\
&
\end{aligned}
$$
Câu IV (2,0 điểm).
1. Cho 1,2 gam hỗn hợp $\mathrm{X}$ gồm $\mathrm{Fe}$ và $\mathrm{Cu}$ tác dụng với $100 \mathrm{ml}$ dung dịch $\mathrm{AgNO}_3 \times \mathrm{mol} / \mathrm{l}$. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch $\mathrm{Y}$ và 3,94 gam chất rắn $\mathrm{Z}$. Cho $\mathrm{Y}$ tác dụng với dung dịch $\mathrm{NaOH}$ dư, lọc kết tủa, nung trong không khí đến khối lượng không đổi thu được 1,4 gam chất rắn $\mathrm{T}$.
a. Tính phần trăm khối lượng các kim loại trong hỗn hợp X.
b. Tính $x$.
Hướng dẫn
$$
\begin{aligned}
& \mathrm{Fe}+2 \mathrm{AgNO}_3 \rightarrow \mathrm{Fe}\left(\mathrm{NO}_3\right)_2+2 \mathrm{Ag} \quad \mathrm{Cu}+2 \mathrm{AgNO}_3 \rightarrow \mathrm{Cu}\left(\mathrm{NO}_3\right)_2+2 \mathrm{Ag} \quad \mathrm{Fe}\left(\mathrm{NO}_3\right)_2+2 \mathrm{NaOH} \rightarrow \mathrm{Fe}(\mathrm{OH})_2+2 \mathrm{NaNO}_3 \\
& \mathrm{Cu}\left(\mathrm{NO}_3\right)_2+2 \mathrm{NaOH} \rightarrow \mathrm{Cu}(\mathrm{OH})_2+2 \mathrm{NaNO}_3 \quad \mathrm{Cu}(\mathrm{OH})_2 \rightarrow \mathrm{CuO}+\mathrm{H}_2 \mathrm{O} \quad 2 \mathrm{Fe}(\mathrm{OH})_2+0,5 \mathrm{O}_2 \rightarrow \mathrm{Fe}_2 \mathrm{O}_3+2 \mathrm{H}_2 \mathrm{O} \\
& \text { Nếu } \mathrm{Z} \text { có Fe dư thì } \mathrm{X}\left|\begin{array}{l}
\mathrm{Fe}^{\mathrm{a}} \\
\mathrm{Cu}^{\mathrm{b}}
\end{array} \rightarrow \mathrm{Z}\right| \begin{array}{l}
\mathrm{Fe}^{\mathrm{c}} \\
\mathrm{Cu}^{\mathrm{b}}, \mathrm{Ag}^{2(\mathrm{a}-\mathrm{c})}
\end{array} ;\left|\begin{array}{l}
\mathrm{Y}: \mathrm{Fe}\left(\mathrm{NO}_3\right)_2{ }^{\mathrm{a}-\mathrm{c}} \\
\mathrm{T}: \mathrm{Fe}_2 \mathrm{O}_3{ }^{0,5(\mathrm{a}-\mathrm{c})}
\end{array} \rightarrow\right| \begin{array}{l}
56 \mathrm{a}+64 \mathrm{~b}=1,2 \\
56 \mathrm{c}+64 \mathrm{~b}+216(\mathrm{a}-\mathrm{c})=3,94 \rightarrow \mathrm{c}<0 \rightarrow \text { loại } \\
80(\mathrm{a}-\mathrm{c})=1,4
\end{array} \\
&
\end{aligned}
$$
Vậy Fe pứ hết, $\mathrm{Cu}$ pứ một phần, $\mathrm{AgNO}_3$ pứ hết. Gọi số mol hai kim loại trong hỗn hợp ban đầu là:
$$
\left|\begin{array}{l}
\mathrm{Fe}^{\mathrm{a}} \\
\mathrm{Cu}^{\mathrm{b}}
\end{array} \rightarrow \mathrm{Z}\right| \begin{aligned}
& \mathrm{Ag}^{2 \mathrm{a}+2(\mathrm{~b}-\mathrm{c})} \\
& \mathrm{Cu}^{\mathrm{c}}
\end{aligned} \rightarrow \mathrm{Y}\left|\begin{array}{l}
\mathrm{Fe}\left(\mathrm{NO}_3\right)_2{ }^{\mathrm{a}} \\
\mathrm{Cu}\left(\mathrm{NO}_3\right)_2{ }^{\mathrm{b}-\mathrm{c}}
\end{array} \rightarrow \mathrm{T}\right| \begin{aligned}
& \mathrm{Fe}_2 \mathrm{O}_3^{0,5 \mathrm{a}} \\
& \mathrm{CuO}^{\mathrm{b}-\mathrm{c}}
\end{aligned} \rightarrow\left|\begin{array}{l}
56 \mathrm{a}+64 \mathrm{~b}=1,2 \\
108(2 \mathrm{a}+2 \mathrm{~b}-2 \mathrm{c})+64 \mathrm{c}=3,94 \\
80 \mathrm{a}+80(\mathrm{~b}-\mathrm{c})=1,4
\end{array} \rightarrow\right| \begin{aligned}
& \mathrm{a}=0,01 \\
& \mathrm{~b}=0,01 \\
& \mathrm{c}=0,0025
\end{aligned} \rightarrow \mid \begin{aligned}
& \mathrm{x}=0,35 \mathrm{M} \\
& \mathrm{Fe}^{46,67 \%} \\
& \mathrm{Cu}^{53,33 \%}
\end{aligned}
$$
2. Hạt mắc-ca (macadamia) rất nổi tiếng vì giá trị dinh dưỡng và sự thơm ngon của nó. Để cây phát triển tốt thì giai đoạn bón thúc cần dùng phân bón thích hợp là NPK 4.12.7 (kí hiệu này cho biết tỉ lệ khối lượng các thành phần của N, $\mathrm{P}_2 \mathrm{O}_5, \mathrm{~K}_2 \mathrm{O}$ trong phân bón).
a. Có ba mẫu phân bón amoni sunfat, canxi đihiđrophotphat và kali clorua. Để có loại phân bón NPK 4.12.7 phải trộn ba mẫu phân bón theo tỉ lệ khối lượng nào?
b. Nêu cách nhận biết ba mẫu phân bón trên đựng trong các lọ riêng biệt bằng một hóa chất duy nhất. Viết phương trình phản ứng minh họa.
Hướng dẫn
Giả sử khối lượng phân là 100 gam. Chỉ số 4.12 .7 tương ứng là \% khối lượng của $\mathrm{N}, \mathrm{P}_2 \mathrm{O}_5, \mathrm{~K}_2 \mathrm{O}$ trong phân.
$$
\mathrm{m}\left|\begin{array}{l}
\mathrm{N}: 4 \mathrm{~g} \\
\mathrm{P}_2 \mathrm{O}_5: 12 \mathrm{~g} \rightarrow \mathrm{m} \\
\mathrm{K}_2 \mathrm{O}: 7 \mathrm{~g}
\end{array}\right| \begin{aligned}
& \left(\mathrm{NH}_4\right)_2 \mathrm{SO}_4:(4: 14: 2.132)=18,86(\mathrm{~g}) \\
& \mathrm{Ca}\left(\mathrm{H}_2 \mathrm{PO}_4\right)_2:(12: 142.234)=19,77(\mathrm{~g}) \\
& \mathrm{KCl}:(7: 94.2 .74,5)=11,10(\mathrm{~g})
\end{aligned} \rightarrow \mid \begin{aligned}
& \mathrm{m}_{\left(\mathrm{NH}_4\right)_2 \mathrm{SO}_4}: \mathrm{m}_{\mathrm{Ca}\left(\mathrm{H}_2 \mathrm{PO}_4\right)_2}: \mathrm{m}_{\mathrm{KCl}} \\
& 18,86: 19,77: 11,1=1,7: 1,78: 1
\end{aligned}
$$
Câu V (2,0 điểm).
Hỗn hợp $\mathrm{X}$ gồm: $\mathrm{MCO}_3, \mathrm{Fe}_{\mathrm{x}} \mathrm{O}_{\mathrm{y}}, \mathrm{FeCO}_3$ (với $\mathrm{M}$ là kim loại hóa trị II). Hòa tan $\mathrm{m}$ gam $\mathrm{X}$ cần dùng vừa đủ $480 \mathrm{ml}$ dung dịch $\mathrm{HCl} 1 \mathrm{M}$. Mặt khác, hòa tan $\mathrm{m}$ gam $\mathrm{X}$ trong dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ đặc, nóng, dư thu được dung dịch $\mathrm{Y}$ và 3,696 lít hỗn hợp khí Z (đktc). Cho $\mathrm{Y}$ tác dụng với dung dịch $\mathrm{KOH}$ dư thu được 19,53 gam kết tủa. Nung kết tủa này ngoài không khí đến khối lượng không đổi thu được 14,4 gam chất rắn $\mathrm{E}$ gồm 2 oxit kim loại. Dẫn từ từ 8,96 lít khí $\mathrm{CO}$ (đktc) qua 14,4 gam $\mathrm{E}$, nung nóng thu được hỗn hợp khí $\mathrm{T}$ có tỷ khối so với $\mathrm{H}_2$ là 18,5 . Biết các phản ứng xảy ra hoàn toàn và $\mathrm{SO}_2$ là sản phẩm khử duy nhất của $\mathrm{H}_2 \mathrm{SO}_4$ đặc.
a. Viết các phương trình phản ứng xảy ra.
b. Xác định công thức phân tử của $\mathrm{MCO}_3, \mathrm{Fe}_{\mathrm{x}} \mathrm{O}_{\mathrm{y}}$ và tính $\mathrm{m}$.
Hướng dẫn
HÉT
Trang $8 / 5$