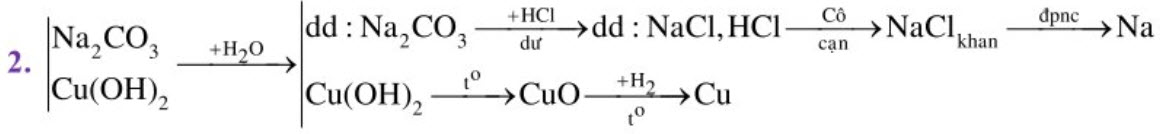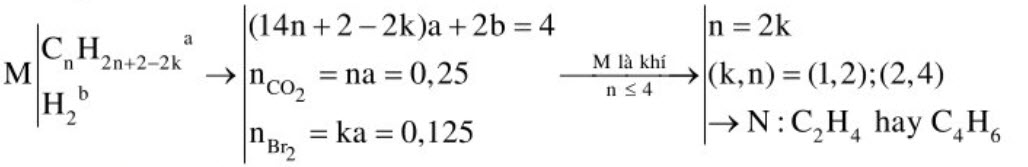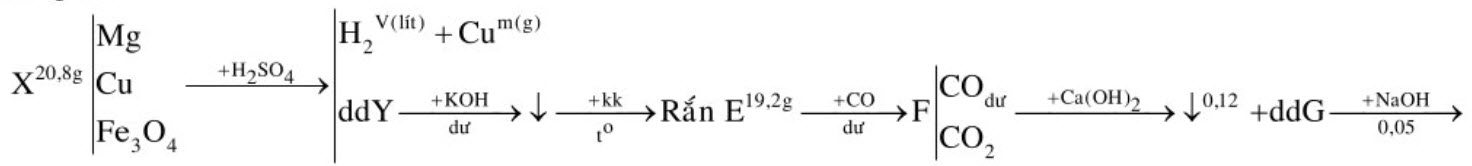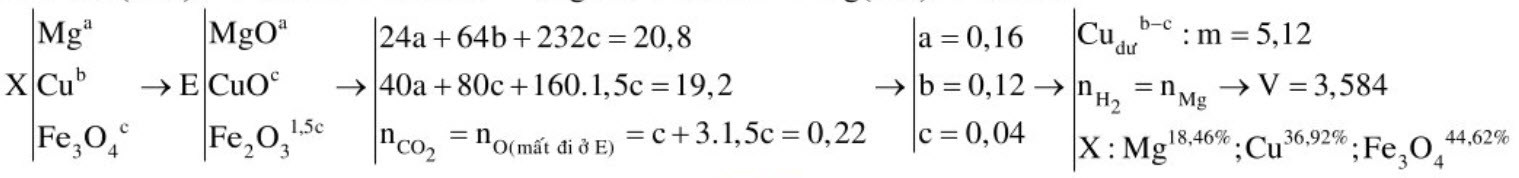File word Đề thi vào 10 Môn Hóa Chuyên Đại học khoa học Huế 2023
File word Đề thi vào 10 Môn Hóa Chuyên Đại học khoa học Huế 2023
Câu 1: (2,0 điểm)
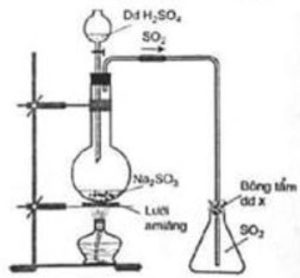
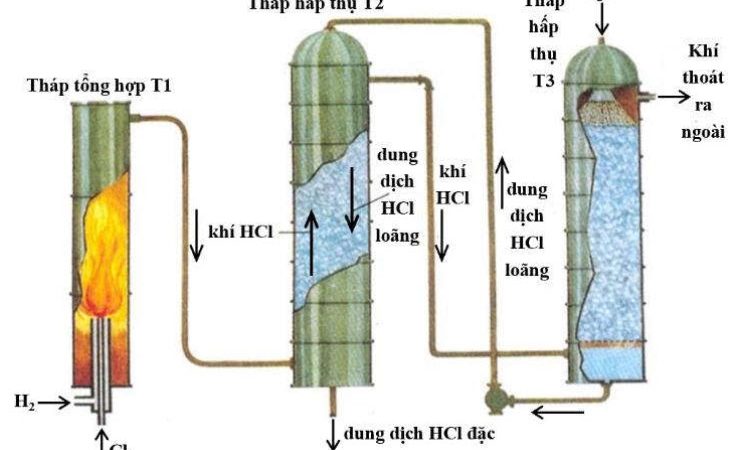
1. Hình vẽ bên minh họa phương pháp điều chế khí sunfuro trong phòng thí nghiệm:
– Khí sunfuro được điều chế bằng phương pháp nào? Viết PTHH xảy ra.
– Dung dịch $\mathrm{X}$ là một hóa chất rất dễ kiếm, rẻ tiền, được tẩm vào bông dùng để loại bỏ lượng nhỏ khí sunfuro thoát ra ngoài. Công thức hóa học của $\mathrm{X}$ và tên thường gọi của dung dịch $\mathrm{X}$ là gì? Viết $\mathrm{PTHH}$ xảy ra.
2. Trình bày phương pháp hóa học để điều chế từng kim loại từ hỗn hợp rắn A gồm natri cacbonat và đồng (II) hidroxit.
Hướng dẫn
1. Khí $\mathrm{SO}_{2}$ được điều chế bằng phương pháp đẩy khí. $\mathrm{Na}_{2} \mathrm{SO}_{3}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{Na}_{2} \mathrm{SO}_{4}+\mathrm{SO}_{2}+\mathrm{H}_{2} \mathrm{O}$
Dung dịch $\mathrm{X}$ là $\mathrm{NaOH}$, tên thường gọi là dung dịch xút. $\mathrm{SO}_{2}+2 \mathrm{NaOH} \rightarrow \mathrm{Na}_{2} \mathrm{SO}_{3}+\mathrm{H}_{2} \mathrm{O}$
$\mathrm{Na}_{2} \mathrm{CO}_{3}+2 \mathrm{HCl} \rightarrow 2 \mathrm{NaCl}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O} \quad 2 \mathrm{NaCl} \stackrel{\text { apnc }}{\longrightarrow} \mathrm{Na}+\mathrm{Cl}_{2}$
$\mathrm{Cu}(\mathrm{OH})_{2} \stackrel{\mathrm{t}^{\circ}}{\longrightarrow} \mathrm{CuO}+\mathrm{H}_{2} \mathrm{O} \quad \mathrm{CuO}+\mathrm{H}_{2} \stackrel{\mathrm{t}^{\circ}}{\longrightarrow} \mathrm{Cu}+\mathrm{H}_{2} \mathrm{O}$
Câu 2: (2,0 điểm)
1. Nêu hiện tượng chính xác xảy ra và viết PTHH (ghi rõ điều kiện nếu có) của các phản ứng khi tiến hành các thí nghiệm sau:
Thí nghiệm 1: sục khí axetilen đến dư vào dung dịch brom Thí nghiệm 2: nhỏ $5 \mathrm{ml}$ giấm ăn vào 1 gam đá vôi Thí nghiệm 3: đốt cháy hoàn toàn $10 \mathrm{ml}$ ancol etylic Thí nghiệm 4: nhỏ $2 \mathrm{ml}$ bari axetat vào $2 \mathrm{ml}$ kali sunfat 2. Trình bày phương pháp tinh chế metan từ hỗn hợp khí gồm: $\mathrm{CH}_{4}, \mathrm{C}_{2} \mathrm{H}_{2}, \mathrm{CO}_{2}$ và $\mathrm{C}_{2} \mathrm{H}_{4}$.
Hướng dẫn
1. $\mathrm{TN}_{1}$ : sục khí $\mathrm{C}_{2} \mathrm{H}_{2}$ đến dư vào nước brom, nước brom bị mất màu: $\mathrm{CH} \equiv \mathrm{CH}+2 \mathrm{Br}_{2} \rightarrow \mathrm{CH}\left(\mathrm{Br}_{2}\right)-\mathrm{CH}\left(\mathrm{Br}_{2}\right)$
$\mathrm{TN}_{2}$ : nhỏ $5 \mathrm{ml}$ giấm ăn vào 1 gam đá vôi ta thấy đá vôi bị tan dần, có bọt khí không màu không mùi thoát ra:
$\mathrm{CH}_{3} \mathrm{COOH}+\mathrm{CaCO}_{3} \rightarrow\left(\mathrm{CH}_{3} \mathrm{COO}\right)_{2} \mathrm{Ca}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O}$
$\mathrm{TN}_{3}$ : đốt cháy ancol etylic ta thấy có ngọn lửa lam nhạt, bề mặt vật chứa rượu etylic khô nhanh chóng:
$
\mathrm{C}_{2} \mathrm{H}_{5} \mathrm{OH}+\mathrm{O}_{2} \stackrel{\mathrm{t}^{\circ}}{\longrightarrow} 2 \mathrm{CO}_{2}+3 \mathrm{H}_{2} \mathrm{O}
$
$\mathrm{TN}_{4}$ : nhỏ $2 \mathrm{ml}$ bari axetat vào $2 \mathrm{ml}$ kali sunfat ta thấy có kết tủa trắng xuất hiện, khối lượng kết tủa tăng dần đến tối đa rồi không đổi: $\left(\mathrm{CH}_{3} \mathrm{COO}\right)_{2} \mathrm{Ba}+\mathrm{K}_{2} \mathrm{SO}_{4} \rightarrow 2 \mathrm{CH}_{3} \mathrm{COOK}+\mathrm{BaSO}_{4}$
$\mathrm{CH} \equiv \mathrm{CH}+2 \mathrm{Br}_{2} \rightarrow \mathrm{CH}\left(\mathrm{Br}_{2}\right)-\mathrm{CH}\left(\mathrm{Br}_{2}\right) \quad \mathrm{CH}_{2}=\mathrm{CH}_{2}+\mathrm{Br}_{2} \rightarrow \mathrm{CH}_{2}(\mathrm{Br})-\mathrm{CH}_{2}(\mathrm{Br}) \quad \mathrm{CO}_{2}+\mathrm{Ca}(\mathrm{OH})_{2} \rightarrow \mathrm{CaCO}_{3}+\mathrm{H}_{2} \mathrm{O}$
Câu 3: (2,0 điểm)
1. Cho 14,86 gam hỗn hợp $\mathrm{A}$ gồm $\mathrm{Na}, \mathrm{Cu}, \mathrm{Fe}$ và $\mathrm{MgCO}_{3}$ vào bình chứa nước dư, thu được $224 \mathrm{ml}_{2}$. Thêm tiếp vào bình $\mathrm{V} \mathrm{ml}$ dung dịch $\mathrm{HCl} 1 \mathrm{M}$ thì thu được dung dịch $\mathrm{B}$ chỉ chứa muối clorua, hỗn hợp khí $\mathrm{C}$ có tỉ khối hơi so với $\mathrm{H}_{2}$ là 13 và phần không tan $\mathrm{D}$. Cho toàn bộ $\mathrm{C}$ vào dung dịch nước vôi trong dư thì thu được 8 gam kết tủa. Lọc lấy toàn bộ phần không tan $\mathrm{D}$ rồi cho vào dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc nóng dư thì thu được dung dịch $\mathrm{E}$ và khí sinh ra chỉ có $\mathrm{SO}_{2}$ (sản phẩm khử duy nhất) với thể tích 1,792 lít. Cho toàn bộ $\mathrm{E}$ tác dụng với dung dịch $\mathrm{NaOH}$ dư, lọc lấy kết tủa rồi nung trong không khí đến khối lượng không đổi thì thu được $\mathrm{m}$ gam chất rắn. Biết các phản ứng xảy ra hoàn toàn, các thể tích khí đều đơ ở đktc. Tính khối lượng mỗi chất trong $\mathrm{A}$ và giá trị $\mathrm{V}, \mathrm{m}$.
Hướng dẫn
Giả sử mol trong $\mathrm{A}$ của $\mathrm{Cu}: \mathrm{a}(\mathrm{mol})$; Fe: $\mathrm{b}(\mathrm{mol})$ $\mathrm{CaCO}_{3}{ }^{0,08} \rightarrow \mathrm{C}\left|\begin{array}{l}\mathrm{H}_{2}^{0,06} \\ \mathrm{CO}_{2}{ }^{0,08}\end{array} \rightarrow\right| \begin{aligned} & \mathrm{n}_{\mathrm{HCl}}=2 \mathrm{n}_{\left(\mathrm{H}_{2}, \mathrm{CO}_{2}\right)}+\mathrm{n}_{\mathrm{NaOH}} \\ & \mathrm{n}_{\mathrm{HCl}}=0,3 \rightarrow \mathrm{V}=0,3\end{aligned} \rightarrow \mathrm{D}\left|\begin{array}{l}\mathrm{Cu}^{\mathrm{a}} \\ \mathrm{Fe}^{\mathrm{b}-0,06}\end{array} \rightarrow\right| \begin{aligned} & \stackrel{\mathrm{BT} . \mathrm{e}}{\longrightarrow} 2 \mathrm{a}+3(\mathrm{~b}-0,06)=2.0,08 \\ & 0,46+64 \mathrm{a}+56 \mathrm{~b}+84.0,08=14,86\end{aligned} \rightarrow \mid \begin{aligned} & \mathrm{a}=0,05 \\ & \mathrm{~b}=0,08\end{aligned}$ $\operatorname{Răn}\left|\begin{array}{l}\mathrm{CuO}^{0,05} \\ \mathrm{Fe}_{2} \mathrm{O}_{3}^{0,01}\end{array} \rightarrow \mathrm{m}=5,6 \rightarrow \mathrm{A}\right| \begin{aligned} & \mathrm{Na}^{0,46 \mathrm{~g}} \mid \mathrm{Cu}^{3,2 \mathrm{~g}} \\ & \mathrm{Fe}^{4,48 \mathrm{~g}} \mid \mathrm{MgCO}_{3}^{6,72 \mathrm{~g}}\end{aligned}$
2. Hỗn hợp khí $\mathrm{M}$ (ở điều kiện thường) gồm một hidrocacbon mạch hở $\mathrm{N}$ và $\mathrm{H}_{2}$. Đốt cháy hoàn toàn $2 \mathrm{gam} \mathrm{M}$ thu được 2,8 lít khí $\mathrm{CO}_{2}$ (đktc). Mặt khác 4 gam $\mathrm{M}$ tác dụng vừa đủ với $125 \mathrm{ml}$ dung dịch $\mathrm{Br}_{2} 1 \mathrm{M}$. Xác định CTPT của $\mathrm{N}$.
Hướng dẫn
Câu 4: (2,0 điểm)
Đốt cháy hoàn toàn $\mathrm{m}$ gam hỗn hợp $\mathrm{X}$ gồm hai hợp chất hữu cơ đơn chức cần vừa đủ 10,64 lít $\mathrm{O}_{2}$ (đktc) tạo ra $\mathrm{CO}_{2}$ và $\mathrm{H}_{2} \mathrm{O}$. Dẫn toàn bộ sản phẩm cháy vào 200 gam dung dịch $\mathrm{Ba}(\mathrm{OH})_{2} 25,65 \%$ thì thu được 39,4 gam kết tủa. Lọc bỏ kết tủa thu được 185,4 gam dung dịch Z. Nếu đun nóng dung dịch $\mathrm{Z}$ thì thấy xuất hiện kết tủa. Mặt khác, nếu cho $\mathrm{m}$ gam $\mathrm{X}$ tác dụng với $50 \mathrm{gam}$ dung dịch $\mathrm{NaOH} 16 \%$ thì thu được dung dịch $\mathrm{Y}$ có chứa một rượu, hai muối của hai axit cacboxylic là đồng đẳng kế tiếp. Cô cạn dung dịch $\mathrm{Y}$ thu được 13,95 gam chất rắn khan. Biết rằng: các phản ứng xảy ra hoàn toàn. $\mathbf{a}$. Tính $\mathrm{m}$. b. Xác định $\mathrm{CTCT}$ của mỗi chất trong $\mathrm{X}$.
Hướng dẫn
a. Đun $\mathrm{Z}$ lại thấy xuất hiện kết tủa nên $\mathrm{Z}$ chứa: $\mathrm{Ba}\left(\mathrm{HCO}_{3}\right)_{2}$
$
\mathrm{CO}_{2}+\mathrm{Ba}(\mathrm{OH})_{2} \rightarrow \mathrm{BaCO}_{3}+\mathrm{H}_{2} \mathrm{O} \quad 2 \mathrm{CO}_{2}+\mathrm{Ba}(\mathrm{OH})_{2} \rightarrow \mathrm{Ba}\left(\mathrm{HCO}_{3}\right)_{2}
$
$
0,2 \quad 0,2 \leftarrow 0,2 \quad 0,2 \leftarrow 0,1
$
Suy ra: $\mathrm{nCO}_{2}=0,4 ; \mathrm{m}_{\mathrm{Z}}=\mathrm{m}\left(\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O}\right)+\mathrm{m}_{\mathrm{dd}} \mathrm{Ba}(\mathrm{OH})_{2}-\mathrm{m} \downarrow \rightarrow \mathrm{nH}_{2} \mathrm{O}=0,4$. BTKL: $\mathrm{m}=9,6$ gam.
b. Nhận thấy: $\mathrm{nCO}_{2}=\mathrm{nH}_{2} \mathrm{O}$ nên $\mathrm{X}$ chứa axit no đơn chức hoặc este no đơn chức.
$\stackrel{\text { BKL }}{\longrightarrow}\left|\begin{array}{l}\mathrm{m}_{\mathrm{X}}=12 \mathrm{n}_{\mathrm{CO}_{2}}+2 \mathrm{n}_{\mathrm{H}_{2} \mathrm{O}}+16 \mathrm{n}_{\mathrm{O}} \\ \mathrm{O}_{(\mathrm{X})}^{0,25} \rightarrow \mathrm{X}^{0,125} \rightarrow \mathrm{NaOH}_{\mathrm{puŕ}}^{0,125}\end{array} \rightarrow \mathrm{Rắn}\right| \begin{aligned} & \mathrm{NaOH}_{\mathrm{dur}}^{0,075} \\ & \mathrm{RCOONa}^{0,125}\end{aligned} \rightarrow \mathrm{R}=87,6 \rightarrow \mid \begin{aligned} & \mathrm{CH}_{3} \mathrm{COONa}^{0,075} \\ & \mathrm{C}_{2} \mathrm{H}_{5} \mathrm{COONa}^{0,05}\end{aligned} \rightarrow \begin{aligned} & \mathrm{CH}_{3} \mathrm{COOR}_{1}^{0,075} \\ & \mathrm{C}_{2} \mathrm{H}_{5} \mathrm{COOR}_{2}^{0,05}\end{aligned}$ $\stackrel{9,6 \mathrm{~g}}{\longrightarrow}\left|\begin{array}{l}3 \mathrm{R}_{1}+2 \mathrm{R}_{2}=61 \\ \mathrm{R}_{1}=1 ; \mathrm{R}_{2}=29\end{array} \rightarrow \mathrm{X}\right| \begin{aligned} & \mathrm{CH}_{3} \mathrm{COOH} \\ & \mathrm{C}_{2} \mathrm{H}_{5} \mathrm{COOC}_{2} \mathrm{H}_{5}\end{aligned}$
Câu 5: (2,0 điểm)
Cho 20,8 gam hỗn hợp $\mathrm{X}$ gồm $\mathrm{Cu}, \mathrm{Mg}$ và $\mathrm{Fe}_{3} \mathrm{O}_{4}$ tác dụng với lượng dư axit sunfuric loãng thu được dung dịch $\mathrm{Y}, \mathrm{V}$ lít khí (đktc) và $\mathrm{m}$ gam chất rắn không tan. Cho Y tác dụng với dung dịch $\mathrm{KOH}$ dư thu được kết tủa, lọc kết tủa rồi nung trong không khí đến khối lượng không đổi thu được 19,2 gam rắn E. Dùng khí cacbon oxit dư để khử 19,2 gam rắn $\mathrm{E}$ thì thu được hỗn hợp khí $\mathrm{F}$. Cho $\mathrm{F}$ qua dung dịch nước vôi trong, sau phản ứng tạo ra 12 gam kết tủa và dung dịch $\mathrm{G}$. Lấy dung dịch $\mathrm{NaOH} 1 \mathrm{M}$ tác dụng hết với dung dịch $\mathrm{G}$ thì cần dùng tối thiểu $50 \mathrm{ml}$ để tạo ra lượng kết tủa lớn nhất. Biết các phản ứng xảy ra hoàn toàn. Tính $\mathrm{m}, \mathrm{V}$ và thành phần $\%$ theo khối lượng mỗi chất trong hỗn hợp $\mathrm{X}$.
Hướng dẫn
$
\begin{aligned}
& \text { Dung dịch G có: } \mathrm{Ca}\left(\mathrm{HCO}_{3}\right)_{2}+\mathrm{NaOH} \rightarrow \mathrm{CaCO}_{3}+\mathrm{NaHCO}_{3}+\mathrm{H}_{2} \mathrm{O} \\
& \mathrm{CO}_{2}+\mathrm{Ca}(\mathrm{OH})_{2} \rightarrow \mathrm{CaCO}_{3}+\mathrm{H}_{2} \mathrm{O} \quad 2 \mathrm{CO}_{2}+\mathrm{Ca}(\mathrm{OH})_{2} \rightarrow \mathrm{Ca}\left(\mathrm{HCO}_{3}\right)_{2} \\
& 0,12 \leftarrow 4,12 \quad 0,1 \quad \leftarrow 0,05 \text { Suy ra: } \mathrm{nCO}_{2}=0,22 \\
& \mathrm{Mg}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{MgSO}_{4}+\mathrm{H}_{2} \quad \mathrm{Fe}_{3} \mathrm{O}_{4}+4 \mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{FeSO}_{4}+\mathrm{Fe}_{2}\left(\mathrm{SO}_{4}\right)_{3}+4 \mathrm{H}_{2} \mathrm{O} \\
& \mathrm{Cu}+\mathrm{Fe}_{2}\left(\mathrm{SO}_{4}\right)_{3} \rightarrow \mathrm{CuSO}_{4}+2 \mathrm{FeSO}_{4} \quad \mathrm{MgSO}_{4}+2 \mathrm{KOH} \rightarrow \mathrm{Mg}(\mathrm{OH})_{2}+\mathrm{K}_{2} \mathrm{SO}_{4}
\end{aligned}
$