Đề thi HSG Hóa 9 Tỉnh Đồng Tháp – Năm học 2021 – 2022
Đề thi HSG Hóa 9 Tỉnh Đồng Tháp – Năm học 2021 – 2022
Cho nguyên tử khối: $\mathrm{H}=1 ; \mathrm{C}=12 ; \mathrm{N}=14 ; \mathrm{O}=16 ; \mathrm{S}=32 ; \mathrm{Na}=23 ; \mathrm{K}=39 ; \mathrm{Mg}=24 ; \mathrm{Ca}=40 ; \mathrm{Ba}=137 ; \mathrm{Pb}=207$;
$\mathrm{Al}=27 ; \mathrm{Br}=80 ; \mathrm{Fe}=56 ; \mathrm{Cl}=35,5 ; \mathrm{P}=31 ; \mathrm{Ag}=108 ; \mathrm{Cu}=64$.
Câu 1. (2,0 điểm)
1. Nguyên tử của nguyên tố $\mathbf{X}$ có tổng số hạt proton, nơtron, electron là 58 hạt, biết số hạt mang điện trong hạt nhân ít hơn số hạt không mang điện 1 hạt.
a) Tìm tên của nguyên tố trên.
b) Cho 2,34 gam nguyên tố $\mathbf{X}$ vào $100 \mathrm{ml} \mathrm{H}_{2} \mathrm{O}$ thu được dung dịch $\mathbf{Y}$, xác định nồng độ mol của dung dịch $\mathbf{Y}$ (coi thể tích dung dịch thay đổi không đáng kể).
2. Viết công thức cấu tạo dạng mạch hở của $\mathrm{C}_{3} \mathrm{H}_{6}$ và $\mathrm{C}_{3} \mathrm{H}_{8}, \mathrm{C}_{2} \mathrm{H}_{6} \mathrm{O}$.
Câu 2. (3,0 điểm)
1. Hòa tan hoàn toàn kim loại $\mathrm{M}$ bằng dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ loãng vừa đủ, sau phản ứng thu được dung dịch $\mathbf{X}$ có nồng độ 26,8\% và 5,6 lít một chất khí (đo ở đktc). Làm lạnh dung dịch $\mathbf{X}$ xuống nhiệt độ t ${ }^{\circ} \mathrm{C}$ thì thu được 27,8 gam tinh thể $\mathrm{MSO}_{4} \cdot \mathrm{nH}_{2} \mathrm{O}$ và còn lại 114 gam dung dịch bão hòa $\mathbf{Y}$ có nồng độ $20 \%$. Tìm công thức của tinh thể $\mathrm{MSO}_{4} \cdot \mathrm{nH}_{2} \mathrm{O}$.
2. Cho $\mathrm{V}_{1}$ lít dung dịch $\mathrm{KOH} 0,25 \mathrm{M}$ vào $\mathrm{V}_{2}$ lít dung dịch $\mathrm{HCl} 0,2 \mathrm{M}$ thu được 1,5 lít dung dịch $\mathrm{A}$. Toàn bộ dung dịch $\mathbf{A}$ ở trên hòa tan vừa hết 3,06 gam $\mathrm{Al}_{2} \mathrm{O}_{3}$. Tính $\mathrm{V}_{1}$ và $\mathrm{V}_{2}$.
Câu 3. (3,0 điểm)
1. Cho $\mathrm{Fe}_{3} \mathrm{O}_{4}$ tác dụng với dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ loãng dư thu được dung dịch $\mathbf{X}$. Cho lần lượt các chất $\mathrm{NaOH}, \mathrm{BaCl}_{2}, \mathrm{Cl}_{2}$ vào dung dịch $\mathbf{X}$. Viết các phương trình phản ứng xảy ra (nếu có).
2. Cho các chất rắn dạng bột $\mathrm{Mg}, \mathrm{Ba}(\mathrm{OH})_{2}, \mathrm{Al}_{2} \mathrm{O}_{3}, \mathrm{Al}$ chứa trong các lọ riêng biệt, bị mất nhãn được dùng một thuốc thử duy nhất, hãy trình bày phương pháp hóa học để phân biệt các lọ bị mất nhãn trện. Viết các phương trình phản ứng xảy ra.
3. Cho các dung dịch: $\mathrm{KHSO}_{4}, \mathrm{Ba}\left(\mathrm{HCO}_{3}\right)_{2}, \mathrm{Na}_{2} \mathrm{CO}_{3}, \mathrm{Mg}\left(\mathrm{NO}_{3}\right)_{2}$ được đặt tên không theo thứ tự $\mathbf{X}$, Y, $\mathbf{Z}, \mathbf{T}$. Tiến hành thí nghiệm với $\mathbf{X}, \mathbf{Y}, \mathbf{Z}, \mathbf{T}$ thu được kết quả như sau:
| Thuốc thử | X | Y | Z | T |
| NaOH | Kết tủa trắng | Không hiện tượng | Kết tủa | Không hiện tượng |
| NaHSO4 | Kết tủa, khí thoát ra | Khí thoát ra | Không hiện tượng | Không hiện tượng |
Hãy xác định $\mathbf{X}, \mathbf{Y}, \mathbf{Z}, \mathbf{T}$, viết các phương trình phản ứng hóa học xảy ra.
Câu 4. (3,0 điểm)
1. Chất hữu cơ $\mathbf{X}$ được sử dụng nhiều trong các loại mỹ phẩm có tác dụng giữ ẩm như: kem dưỡng da, sữa tắm, dầu gội, kem đánh răng, nước rửa tay sát khuẩn…Khi phân tích chất $\mathbf{X}$ thu được kết quả như sau: $\% \mathrm{C}=39,130 \% ; \% \mathrm{H}=8,696 \% ; \% \mathrm{O}=52,174 \%$.
a) Xác định công thức đơn giản nhất của $\mathbf{X}$.
b) Xác định công thức phân tử của $\mathbf{X}$ biết rằng tỉ khối hơi của $\mathbf{X}$ so với $\mathrm{NO}_{2}$ là 2 .
2. Viết hai phương trình hóa học để giải thích hiện tượng xâm thực của nước mưa đối với đá vôi trong tự nhiên và quá trình tạo thạch nhũ trong các hang động.
3. Cho các chất sau: $\mathrm{NH}_{4} \mathrm{NO}_{3}, \mathrm{Ca}\left(\mathrm{H}_{2} \mathrm{PO}_{4}\right)_{2}, \mathrm{~K}_{2} \mathrm{CO}_{3},\left(\mathrm{NH}_{2}\right)_{2} \mathrm{CO}$. Chất nào là phân đạm, phân lân, phân kali. Gọi tên của các chất đó.
4. Một mẫu nước chứa $\mathrm{Pb}\left(\mathrm{NO}_{3}\right)_{2}$. Để xác định hàm lượng chì người ta hòa tan một lượng dư $\mathrm{Na}_{2} \mathrm{~S}$ vào $500,0 \mathrm{ml}$ nước đó, làm khô kết tủa sau phản ứng thu được 4,618.10-3 gam $\mathrm{PbS}$. Hỏi nước này có bị nhiễm độc chì không, biết rằng nồng độ chì tối đa cho phép trong nước sinh hoạt là $0,10 \mathrm{mg} / 1$.
Câu 5. (1,0 điểm)
1. Trình bày hiện tượng xảy ra khi cho kim loại $\mathrm{Na}$ vào dung dịch $\mathrm{CuSO}_{4}$. Viết phương trình hóa học xảy ra.
2. Cho thí nghiệm như hình vẽ (Hình 1)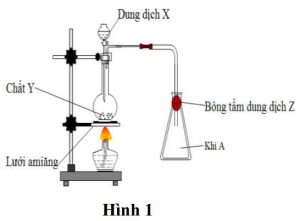
Biết khí $\mathbf{A}$ làm đục nước vôi trong và làm mất màu dung dịch brom, Y là muối trung hòa.
– Hãy xác định khí $\mathbf{A}$, dung dịch $\mathbf{X}$, chất rắn $\mathbf{Y}$, dung dịch $\mathbf{Z}$.
– Cho biết vai trò của dung dịch $\mathbf{Z}$ trong thí nghiệm trên? (Không cần viết phương trình phản ứng)
Câu 6. (4,0 điểm)
1. Nhiệt nhôm hoàn toàn 9,66 gam hỗn hợp $\mathbf{X}$ gồm $\mathrm{Fe}_{\mathrm{x}} \mathrm{O}_{\mathrm{y}}$ và $\mathrm{Al}$ trong điều kiện không có không khí (giả sử chỉ xảy ra phản ứng nhiệt nhôm tạo thành $\mathrm{Fe}$ và $\mathrm{Al}_{2} \mathrm{O}_{3}$ ) thu được hỗn hợp chất rắn $\mathbf{Y}$. Trộn đều $\mathbf{Y}$ rồi chia hỗn hợp thành hai phần:
– Hòa tan hết phần thứ nhất trong $125 \mathrm{ml}$ dung dịch $\mathrm{NaOH} 0,2 \mathrm{M}$ vừa đủ, sau khi phản ứng kết thúc thấy thoát ra $168 \mathrm{ml}$ khí (đo ở đktc).
– Cho toàn bộ phần thứ hai vào dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ loãng dư đến khi phản ứng hoàn toàn thấy thoát ra 2,016 lít khí (đo ở đktc).
a) Viết các phương trình phản ứng xảy ra.
b) Tìm công thức phân tử của $\mathrm{Fe}_{\mathrm{x}} \mathrm{O}_{\mathrm{y}}$.
c) Cho 4,83 gam hỗn hợp $\mathbf{X}$ vào dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc nóng, dư thì thu được $\mathrm{V}$ lít khí $\mathrm{SO}_{2}$ (đo ở đktc, sản phẩm khử duy nhất). Tính giá trị của $\mathrm{V}$.
2. Cho 0,784 lít khí $\mathrm{CO}_{2}$ (đo ở đktc) hấp thụ hết vào $200 \mathrm{ml}$ dung dịch $\mathbf{X}$ chứa $\mathrm{NaOH}$ và $\mathrm{Na}_{2} \mathrm{CO}_{3}$ thì thu được $200 \mathrm{ml}$ dung dịch $\mathbf{Y}$ (giả sử thể tích dung dịch không đổi):
– Nếu cho dung dịch $\mathrm{BaCl}_{2}$ dư vào $200 \mathrm{ml}$ dung dịch $\mathbf{Y}$ thì thấy xuất hiện 4,925 gam kết tủa.
– Nếu cho dung dịch $\mathrm{Ca}(\mathrm{OH})_{2}$ dư vào $100 \mathrm{ml}$ dung dịch $\mathbf{Y}$ thấy xuất hiện 2,25 gam kết tủa.
a) Viết các phương trình phản ứng xảy ra.
b) Tính nồng độ $\mathrm{mol} /$ lít các chất có trong $200 \mathrm{ml}$ dung dịch $\mathbf{X}$ ban đầu.
Câu 7. (4,0 điểm)
1. Đốt cháy hoàn toàn 1,344 lít hỗn hợp khí $\mathbf{X}$ gồm một anken và một ankin cần vừa đủ 4,48 lít khí oxi (các khí đo ở đktc) thu được 6,16 gam $\mathrm{CO}_{2}$.
a) Tìm công thức phân tử của anken và ankin.
b) Dẫn toàn bộ hỗn hợp $\mathbf{X}$ ở trên qua dung dịch $\mathrm{AgNO}_{3} / \mathrm{NH}_{3}$ dư, sau khi kết thúc phản ứng thì thu được bao nhiêu gam kết tủa?
2. Hỗn hợp $\mathbf{X}$ chứa $0,02 \mathrm{~mol} \mathrm{C}_{2} \mathrm{H}_{2}, 0,02 \mathrm{~mol} \mathrm{C}_{2} \mathrm{H}_{4}$ và 0,04 mol $\mathrm{H}_{2}$. Nung nóng hỗn hợp $\mathbf{X}$ (bột $\mathrm{Ni}$ xúc tác) một thời gian thu được hỗn hợp khí $\mathbf{Y}$. Tỉ khối của $\mathbf{Y}$ so với khí $\mathrm{H}_{2}$ là 11,6. Dẫn toàn bộ hỗn hợp $\mathbf{Y}$ qua dung dịch $\mathrm{Br}_{2}$ dư thấy có $\mathbf{m}$ gam $\mathrm{Br}_{2}$ tham gia phản ứng.
a) Viết các phương trình phản ứng xảy ra.
b) Tính thể tích khí oxi (đo ở đktc) cần dùng để đốt cháy hết hỗn hợp $\mathbf{Y}$.
c) Tìm giá trị của $\mathbf{m}$.