Đề thi HSG Hóa 9 Tỉnh Quảng Trị – Năm học 2021 – 2022
Đề thi HSG Hóa 9 Tỉnh Quảng Trị – Năm học 2021 – 2022
Câu 1. (4,5 điểm)
1. Nguyên tử của một nguyên tố $\mathrm{R}$ có tổng số hạt cơ bản (proton, notron, electron) là 115 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt. Tìm số hạt $\mathrm{p}, \mathrm{n}$, e và cho biết tên của $\mathrm{R}$.
2. $\mathrm{X}$ là oxit của kim loại $\mathrm{M}$, trong đó $\mathrm{M}$ chiếm $72,414 \%$ về khối lượng. Hãy xác định công thức hóa học của $\mathbf{X}$ và hoàn thành các phương trình phản ứng sau:
$$
\begin{aligned}
& \mathrm{X}+\mathrm{A}_{1} \rightarrow \mathrm{A}_{2}+\mathrm{A}_{3}+\mathrm{A}_{4}(1) ; \quad \mathrm{A}_{2}+\mathrm{A}_{5} \rightarrow \mathrm{A}_{6}+\mathrm{A}_{7} \text { (2); } \\
& \mathrm{A}_{2}+\mathrm{M} \rightarrow \mathrm{A}_{3} \quad \text { (3); } \quad \mathrm{A}_{3}+\mathrm{A}_{5} \rightarrow \mathrm{A}_{8}+\mathrm{A}_{7} \text { (4); } \quad \mathrm{A}_{8}+\mathrm{A}_{4}+\mathrm{A}_{9} \rightarrow \mathrm{A}_{6} \text { (5). }
\end{aligned}
$$
(Cho biết tỉ lệ số $m o l$ của $\mathrm{A}_{2}$ và $\mathrm{A}_{3}$ ở (1) là $1: 1$ và khi hơ $\mathrm{A}_{7}$ trên đèn cồn thì ngọn lửa có màu vàng tươi).
3. Hấp thụ hoàn toàn $\mathrm{m}$ gam $\mathrm{SO}_{3}$ vào 180 gam dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4} 98 \%$, thu được oleum có công thức $\mathrm{H}_{2} \mathrm{SO}_{4} \cdot 3 \mathrm{SO}_{3}$. Xác định giá trị của $\mathrm{m}$.
4. Làm lạnh 200,0 gam dung dịch $\mathrm{NaCl}$ bảo hoà ở $100^{\circ} \mathrm{C}$ xuống $20^{\circ} \mathrm{C}$ thấy có 26,1 gam $\mathrm{NaCl}^{2} \cdot \mathrm{xH}_{2} \mathrm{O}$ kết tinh. Xác định công thức của muối kết tinh. (Độ tan của $\mathrm{NaCl}$ ở $100^{\circ} \mathrm{C}$ là 39,1 gam và ở $20^{\circ} \mathrm{C}$ là $35,9 \mathrm{gam}$ ).
Câu 2. (5,0 điểm)
1. Nêu hiện tượng và viết phương trình phản ứng xảy ra trong các thí nghiệm sau:
Thí nghiệm 1: Đốt cháy dây Fe trong bình thủy tinh đựng khí oxi.
Thí nghiệm 2: Sục khí $\mathrm{Cl}_{2}$ vào dung dịch $\mathrm{KI}$ có chứa hồ tinh bột.
Thí nghiệm 3: Cho vài giọt phenophtalein vào ống nghiệm chứa dung dịch có hòa tan 1 gam $\mathrm{NaOH}$, sau đó thêm tiếp vào ống nghiệm trên dung dịch có chứa $1 \mathrm{gam} \mathrm{HCl}$ đến hết.
2. Trình bày phương pháp hóa học để phân biệt các chất trong các trường hợp sau:
a) Hai dung dịch mất nhãn gồm $\mathrm{Na}_{2} \mathrm{CO}_{3}$ và $\mathrm{HCl}$, không dùng thêm thuốc thử.
b) Các bình chứa bột rắn riêng biệt: $\mathrm{Al}, \mathrm{FeO}, \mathrm{BaO}, \mathrm{Al}_{4} \mathrm{C}_{3}$, chỉ dùng thêm một thuốc thử.
3. Cho 6,4 gam hỗn hợp $\mathbf{X}$ gồm $\mathrm{MgO}$ và $\mathrm{Fe}_{2} \mathrm{O}_{3}$ vào $300 \mathrm{ml}$ dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4} 0,3 \mathrm{M}$, sau phản ứrg̣ cô cạn dung dịch thu được $\mathrm{m}$ gam muối khan. Xác định giá trị $\mathrm{m}$.
4. Trộn dung dịch muối $\mathbf{A}$ vào dung dịch muối $\mathbf{B}$ (lấy cùng số mol muối), thu được 1,25 gam kết tủa $\mathbf{X}$ ( $\mathbf{X}$ là muối của kim loại $\mathrm{M}$ có hóa trị II) và dung dịch $\mathbf{Y}$. Tách kết tủa $\mathbf{X}$ đem nung đến khối lượng không đổi thu được oxit $\mathbf{Z}$ (khí) và 0,7 gam oxit $\mathrm{MO}$ (biết số $\mathrm{mol} \mathbf{Z}$ bằng số mol $\mathrm{MO}$ ). Cô cạn cẩn thận dung dịch $\mathbf{Y}$ thu được 2,0 gam muối khan, đem nung nóng ở nhiệt độ cao thu được 0,025 mol oxit $\mathbf{T}_{\text {(khí) và } 0,05 \mathrm{~mol}}$ $\mathrm{H}_{2} \mathrm{O}$. Xác định công thức phân tử của muối $\mathbf{A}$ và muối $\mathbf{B}$, viết các phương trình phản ứng xảy ra.
Câu 3. (4,5 điểm)
1. Viết phương trình hóa học khi tiến hành các thí nghiệm sau:
a) Cho dung dịch $\mathrm{KOH}$ tác dụng với dung dịch $\mathrm{Ca}\left(\mathrm{HCO}_{3}\right)_{2}$.
b) Cho bột Fe tác dụng với dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$.
c) Cho muối $\mathbf{X}$ vào dung dịch $\mathrm{HCl}$ hoặc dung dịch $\mathrm{NaOH}$ đều sinh ra khí.
2. Hình vẽ mô tả thí nghiệm điều chế khí Z. (hình bên)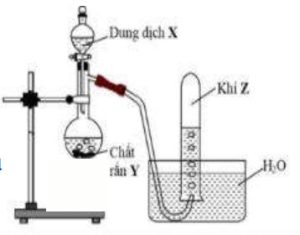
Hãy lựa chọn các cặp hóa chất $\mathbf{X}, \mathbf{Y}$ thích hợp để điều chế 4 khí $\mathbf{Z}$ khác nhau (là chất vô cơ). Viết các phương trình phản ứng xảy ra.
3. Hòa tan hoàn toàn 8,4 gam $\mathrm{Fe}$ trong dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc, nóng, thu được khí $\mathrm{SO}_{2}$ là sản phẩm khử duy nhất và dung dịch $\mathbf{X}$. Cô cạn $\mathbf{X}$ thu được 26,4 gam muối khan. Tính khối lượng $\mathrm{H}_{2} \mathrm{SO}_{4}$ đã phản ứng.
4. Cho kim loại $\mathrm{M}$ có hóa trị II tác dụng với dung dịch $\mathrm{CuSO}_{4}$, lọc tách dung dịch sau phản ứng thu được chất rắn $\mathbf{A}$. Lấy 1,93 gam $\mathbf{A}$ tác dụng với dung dịch axit $\mathrm{HCl}$ dư, thấy thoát ra 0,01 mol khí. Mặt khác lấy 5,79 gam $\mathbf{A}$ tác dụng với dung dịch $\mathrm{AgNO}_{3}$ dư thu được 19,44 gam chất rắn. Xác định kim loại $\mathrm{M}$.
Câu 4. (6,0 điểm)
1. Từ metan và các hóa chất vô cơ, điều kiện, thiết bị cần thiết có đủ. Hãy viết phương trình hóa học điều chế cao su buna, poli(vinyl axetat), etyl axetat.
2. a) Hiđrocacbon $\mathbf{A}$ (mạch hở) có công thức phân tử là $\mathrm{C}_{\mathrm{x}+1} \mathrm{H}_{3 \mathrm{x}}$, biết tỉ khối hơi của $\mathbf{A}$ so với $\mathrm{H}_{2}$ nhỏ hơn 36,5. Xác định công thức phân tử và viết các công thức cấu tạo có thể có của $\mathbf{A}$.
b) Một bình kín chứa hỗn hợp $\mathbf{X}$ gồm hiđrocacbon $\mathbf{A}$ (là chất khí ở điều kiện thường) và $0,06 \mathrm{~mol}_{2}$, bật tia lửa điện để đốt cháy hỗn hợp $\mathbf{X}$. Toàn bộ sản phẩm cháy sau phản ứng cho qua 3,5 lít dung dịch $\mathrm{Ca}(\mathrm{OH})_{2} 0,01 \mathrm{M}$ thì thu được 3 gam kết tủa và có 0,01 mol khí duy nhất thoát ra khỏi bình. Xác định công thức phân tử có thể có của $\mathbf{A}$. (Các phản ứng xảy ra hoàn toàn, nước bị ngưng tụ khi cho qua dung dịch).
3. Tiến hành lên men giấm $200 \mathrm{ml}$ dung dịch ancol etylic $5,75^{\circ}$ thu được $200 \mathrm{ml}$ dung dịch $\mathbf{Y}$. Lấy $100 \mathrm{ml}$ dung dịch $\mathbf{Y}$ cho tác dụng với $\mathrm{Na}$ dư thì thu được 60,648lít $\mathrm{H}_{2}$ (đktc). Tính hiệu suất của phản ứng lên men giấm. (Biết khối lượng riêng của ancol etylic là $0,8 \mathrm{gam} / \mathrm{ml}$; khối lượng riêng của nước là 1,0gam/ml).
4. Chất hữu cơ $\mathbf{X}$ có nguồn gốc từ thực vật $(\mathbf{X}$ có chứa $\mathrm{C}, \mathrm{H}, \mathrm{O}$; trong phân tử $\mathbf{X}$ có số nguyên tử oxi nhỏ hơn 8). Cho a mol $\mathbf{X}$ tác dụng hết với $\mathrm{NaHCO}_{3}$ thu được $\mathrm{V}_{1}$ lít khí $\mathrm{CO}_{2}$. Mặt khác nếu cho a mol $\mathbf{X}$ phản ứng hết với $\mathrm{Na}$ thì thu được $\mathrm{V}_{2}$ lít khí $\mathrm{H}_{2}$ (các thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất).
a) Xác định công thức phân tử của $\mathbf{X}$. (Biết khối lượng phân tử của $\mathbf{X}$ bằng 192 và $4 \mathrm{~V}_{1}=3 \mathrm{~V}_{2}$ ).
b) Viết phương trình phản ứng xảy ra.
c) Viết công thức cấu tạo của $\mathbf{X}$. (Biết $\mathbf{X}$ có cấu tạo đối xứng, không bị oxi hóa bởi $\mathrm{CuO}$ đun nóng).
Cho biết: $\mathrm{H}=1 ; \mathrm{C}=12 ; \mathrm{N}=14 ; \mathrm{O}=16 ; \mathrm{Na}=23 ; \mathrm{Mg}=24 ; \mathrm{Al}=27 ; \mathrm{S}=32 ; \mathrm{Cl}=35,5 ; \mathrm{Ca}=40 ; \mathrm{Fe}=56 ; \mathrm{Cu}=64; \mathrm{Zn}=65 ; \mathrm{Br}=80 ; \mathrm{Ag}=108$;