Đề thi HSG Hoá 9 Tỉnh Hưng Yên – Năm học 2022 – 2023
Đề thi HSG Hoá 9 Tỉnh Hưng Yên – Năm học 2022 – 2023


SỞ GIÁO DỤC VẢ ĐẢO TÅO KỲ THI CHỌN HỌC SINH GIỎI CÂP TỈNH THCS HU’NG YÊN
Năm học 2022 – 2023
Môn thi: HÓA. HQ̣C
ĐÈ CHINNH THƯC Thời gian làm bài: 150 phút, không kể thời gian giao đè
(Đề thi gồm 02 trang)
Câu I. (3,5 điểm)
1. Cho các chất sau: $\left.\mathrm{Al}_2 \mathrm{O}_3, \mathrm{Al}^{\mathrm{NO}}\right)_3, \mathrm{NaAlO}_2, \mathrm{Al}_2\left(\mathrm{SO}_4\right)_3, \mathrm{Al}(\mathrm{OH})_3, \mathrm{AlCl}_3, \mathrm{Al}$. Hãy lựa chọn chất thicch hợp sắp xếp thành một dãy chuyển hoá và viết phương trình phản ứng minh họa (ghi rõ điều kiện nếu có).
2. Chi dùng một thuốc thử hãy phân biệt các dung dịch không màu chứa trong các lọ riêng biệt mất nhãn sau: $\mathrm{Na}_2 \mathrm{SO}_4, \mathrm{Na}_2 \mathrm{SO}_3, \mathrm{Na}_2 \mathrm{CO}_3, \mathrm{Ba}\left(\mathrm{HCO}_3\right)_2, \mathrm{Ba}\left(\mathrm{HSO}_3\right)_2$. Viết phương trình hóa học của các phản ứng xảy ra (nếu có).
Câu II. (3,5 điểm)
1. Nêu hiện tượng và viết phương trình hóa học của các phản ưng xảy ra trong mổi thí nghiệm sau:
a. Sục từ từ khi $\mathrm{CO}_2$ đến dư vào dung dịch $\mathrm{Ca}(\mathrm{OH})_2$.
b. Cho một mẫu nhỏ kim loại $\mathrm{Na}$ vào dung dịch $\mathrm{FeCl}_3$.
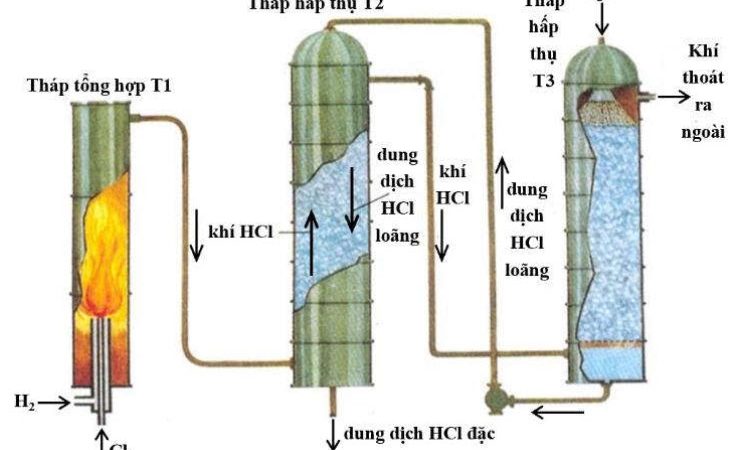
2. Trong công nghiępp, $\mathrm{NaOH}$ và khí $\mathrm{Cl}_2$ được sản xuất bằng phương pháp điện phân dung dich $\mathrm{NaCl}$ bão hòa có màng ngăn xốp (hình bên).
a. Viết phương trình hóa học của phản ứng xảy ra.
b. Cho biết vai trò của màng ngăn xốp.
c. Viết phương trình hóa học của phản ứng xảy ra khi không có màng ngăn xốp. Dung dịch tạo thành sau phản úng có tên là gi? Nêu ứng $\mathrm{dd} \mathrm{NaOH}$ dụng của dung dịch đó trong thực tế.
3. Có 4 kim loại $\mathrm{A}, \mathrm{B}, \mathrm{C}, \mathrm{D}$ đứng sau Mg trong dãy hoạt động hóa học của kim loại. Biết rằng: A và $\mathrm{B}$ tác dụng với dung dịch $\mathrm{HCl}$ giải phóng hiđro. $\mathrm{C}$ và $\mathrm{D}$ không phản ứng với dung dịch $\mathrm{HCl}$. $\mathrm{B}$ tác dụng với dung dịch muối của $\mathrm{A}$ và giải phóng $\mathrm{A}$. $\mathrm{D}$ tác dụng với dung dịch muối của $\mathrm{C}$ và giải phóng $\mathrm{C}$. Hãy sắp xếp thứ tự theo chiều hoạt động hóa học giảm dần của 4 kim loại $\mathrm{A}$, $B, C, D$ và viết các phương trình phản úng xảy ra.
Câu III. (4,5 điểm)
1. Đốt cháy hoàn toàn $\mathrm{m}$ gam hợp chất hữu cơ $\mathrm{X}$ cần dùng 1,176 lit $\mathrm{O}_2$ (ở đktc) chỉ thu được khí $\mathrm{CO}_2$ và hơi $\mathrm{H}_2 \mathrm{O}$. Dẫn toàn bộ sản phẩm cháy vào bình đựng nước vôi trong dư, sau khi phản úng kết thúc thì trong bình có 4,5 gam kết tủa và khối lượng dung dịch giảm 1,71 gam so với dung dịch ban đầu. Biết ti khối hơi của $\mathrm{X}$ so với $\mathrm{H}_2$ bằng 37 .
a. Tinh giá trí của $m$.
b. Xác định công thức phân tử của hợp chất hữu cơ $\mathrm{X}$.
2. Hòa tan hoàn toàn hỗn hợp gồm $\mathrm{Na}$ và $\mathrm{Ba}$ (có số mol bằng nhau) vào nước thu được dung dịch $A$ và 6,72 lit khí (ở đktc).
a. Cần dùng bao nhiêu $\mathrm{ml}$ dung dịch $\mathrm{HCl} 0,1 \mathrm{M}$ để trung hòa $\frac{1}{10}$ dung dịch $\mathrm{A}$ ?
b. Thêm $\mathrm{m}$ gam $\mathrm{NaOH}$ vào $\frac{1}{10}$ dung dịch $\mathrm{A}$ ta đươc dung dịch $\mathrm{B}$. Cho dung dịch $\mathrm{B}$ tác dụng với $100 \mathrm{ml}$ dung dịch $\mathrm{Al}_2\left(\mathrm{SO}_4\right)_3 0,2 \mathrm{M}$ thu được kết tủa $\mathrm{C}$. Tìm $\mathrm{m}$ để cho khối lượng kết tủa $\mathrm{C}$ là lớn nhất, bé nhất và tính khối lượng kết tủa lớn nhất, bé nhất.
Câu IV. $(4,0$ điểm)
1. Cho hỗn hợp $\mathrm{A}$ gồm $\mathrm{Mg}, \mathrm{Fe}_2 \mathrm{O}_3$ và $\mathrm{Al}_2 \mathrm{O}_3$ tác dụng với lượng dư dung dịch $\mathrm{CuSO}_4$ đến khi phản ưng xảy ra hoàn toàn thì thu được dung dịch $\mathrm{B}$ và chất rắn $\mathrm{C}$. Cho toàn bộ $\mathrm{C}$ tác dụng với lượng dư dung dịch $\mathrm{HCl}$ thì thu được dung dịch $\mathrm{D}$ và phần không $\tan \mathrm{E}$. Hòa $\tan$ hoàn toàn $\mathrm{E}$ bằng dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ đặc nóng thì thu được khí $\mathrm{F}$. Hấp thụ hoàn toàn khi $\mathrm{F}$ vào dung dịch $\mathrm{Ba}(\mathrm{OH})_2$ thì thu được kết tủa $\mathrm{G}$ và dung dịch $\mathrm{H}$. Cho lượng dư dung dịch $\mathrm{KOH}$ vào dung dịch $\mathrm{H}$ thì lại thấy xuất hiện kết tủa $\mathrm{G}$.
Xác định thành phần của $\mathrm{B}, \mathrm{C}, \mathrm{D}, \mathrm{E}, \mathrm{F}, \mathrm{G}, \mathrm{H}$ và viết phương trình của phản ứng hóa học xảy $\mathrm{ra}$.
2. Hỗn hơp $\mathrm{X}$ gồm $\mathrm{Na}_2 \mathrm{SO}_4, \mathrm{Na}_2 \mathrm{CO}_3, \mathrm{NaHCO}_3$ đã được trộn đều. Chia 48,48 gam $\mathrm{X}$ làm 3 phần:
– Cho phần 1 tác dụng với lượng dư dung dịch $\mathrm{NaOH}$ thì thấy có 1,2 gam $\mathrm{NaOH}$ phản ứng.
– Cho phần 2 (có khối lượng gấp đôi phần 1) tác dụng với dung địch $\mathrm{HCl}$ dư thấy thoát ra 2,24 lit khi (ở đktc).
– Cho phần 3 tác dụng với lượng dư dung dịch $\mathrm{Ba}(\mathrm{OH})_2$ thì thấy có 51,3 gam $\mathrm{Ba}(\mathrm{OH})_2$ phản úng. Biết các phản ưng đều xảy ra hoàn toàn.
Tính khối lượng mỗi chất trong 48,48 gam hỗn hợp $X$.
Câu V. (4,5 điểm)
1. Dung dịch $\mathrm{X}$ và $\mathrm{Y}$ chứa $\mathrm{HCl}$ với nồng độ mol tương ưng là $\mathrm{C}_1, \mathrm{C}_2(\mathrm{M})$, trong đó $\mathrm{C}_1>\mathrm{C}_2$. Trộn $150 \mathrm{ml}$ dung dịch $\mathrm{X}$ với $500 \mathrm{ml}$ dung dịch $\mathrm{Y}$ được dung dịch $\mathrm{Z}$. Đẻ̉ trung hòa $\frac{1}{10}$ dung dịch $\mathrm{Z}$ cần $10 \mathrm{ml}$ dung dịch hỗn hơp $\mathrm{KOH} 1 \mathrm{M}$ và $\mathrm{Ba}(\mathrm{OH})_2 0,25 \mathrm{M}$. Mặt khác lấy $\mathrm{V}_1$ lít dung dịch $\mathrm{X}$ chứa $0,05 \mathrm{~mol} \mathrm{HCl}$ trộn với $\mathrm{V}_2$ lít dung dịch $\mathrm{Y}$ chứa $0,15 \mathrm{~mol} \mathrm{HCl}$ thì được 1,1 lit dung dịch. Hãy xác định $\mathrm{C}_1, \mathrm{C}_2, \mathrm{~V}_1, \mathrm{~V}_2$.
2. Cho 8 gam hỗn hợp $\mathrm{X}$ chứa $\mathrm{Mg}$ và kim loại $\mathrm{M}$ vào dung dịch $\mathrm{HCl}$ dư, sau khi phản ưng kết thúc thu được 4,48 lít $\mathrm{H}_2$ (ở dktc). Cũng 8 gam hỗn hợp trên tan hoàn toàn trong dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ đặc nóng dư thì thu được dung dịch $\mathrm{Y}$ và 5,6 lit $\mathrm{SO}_2$ duy nhất (ờ đktc). Viết phương trình hóa học xảy ra và xác định kim loại $M$.
Cho:
$
\begin{aligned}
& H=1 ; C=12 ; N=14 ; O=16 ; \mathrm{Na}=23 ; \mathrm{Li}=7 ; \mathrm{Ag}=108 ; \mathrm{Al}=27 ; S=32 ; \mathrm{Mg}=24 \\
& B r=80 ; \mathrm{Cl}=35,5 ; \mathrm{K}=39 ; \mathrm{Ba}=137 ; \mathrm{Fe}=56 ; \mathrm{Cu}=64 ; \mathrm{Zn}=65 ; \mathrm{Ca}=40 .
\end{aligned}
$
bản Word thô còn nhiều lỗi quá, khi nào hoàn thiện mình chia sẻ file Word