File word đề thi HSG Hóa 9 Sơn La – năm học 2022 – 2023
Chi sẻ cùng các bạn đề thi HSG Hóa 9 Sơn La – năm học 2022 – 2023 cùng hướng dẫn chấm chi tiết
File gốc đề thi HSG Hóa 9 Sơn La – năm học 2022 – 2023


Đáp án đề thi HSG Hóa 9 Sơn La – năm học 2022 – 2023
Câu 1: (5,0 điểm)
1. Viết các phương trình phản ứng thực hiện dãy chuyển hóa sau (ghi rõ điều kiện, nếu có).
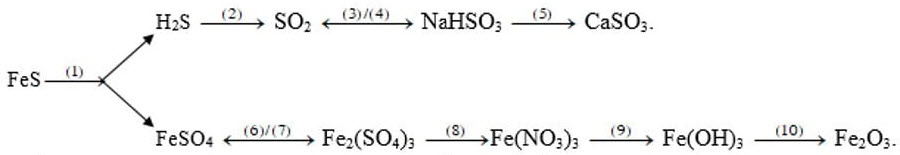
2. Có 5 chất khí riêng biệt đựng trong 5 bình mất nhãn gồm: $\mathrm{H}_2 \mathrm{~S}, \mathrm{H}_2, \mathrm{CO}, \mathrm{CO}_2, \mathrm{SO}_2$. Trình bày phương pháp hóa học nhận biết các chất khí trên (không được ngửi) và viết phương trình hóa học xảy ra.
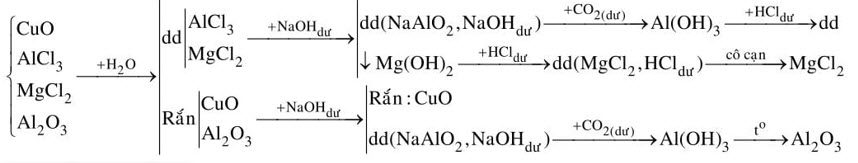
3. Hãy tách riêng tửng chất ra khỏi hỗn hợp chất rắn gồm: $\mathrm{CuO}, \mathrm{AlCl}_3, \mathrm{MgCl}_2$ và $\mathrm{Al}_2 \mathrm{O}_3$, sao cho khối lượng mỗi chất không đổi. Viết các phương trình phản ứng xảy ra.
Hướng dẫn
1. (1) $\mathrm{FeS}+\mathrm{H}_2 \mathrm{SO}_4 \rightarrow \mathrm{FeSO}_4+\mathrm{H}_2 \mathrm{~S}$
(2) $2 \mathrm{H}_2 \mathrm{~S}+3 \mathrm{O}_2 \rightarrow 2 \mathrm{SO}_2+2 \mathrm{H}_2 \mathrm{O}$
(3) $\mathrm{SO}_2+\mathrm{NaOH} \rightarrow \mathrm{NaHSO}_3$
(10) $2 \mathrm{Fe}(\mathrm{OH})_2 \stackrel{\mathrm{t}^{\mathrm{o}}}{\longrightarrow} \mathrm{Fe}_2 \mathrm{O}_3+3 \mathrm{H}_2 \mathrm{O}$
(4) $\mathrm{NaHSO}_3+\mathrm{HCl} \rightarrow \mathrm{NaCl}+\mathrm{SO}_2+\mathrm{H}_2 \mathrm{O}$
(5) $\mathrm{NaHSO}_3+\mathrm{Ca}(\mathrm{OH})_2 \rightarrow \mathrm{NaOH}+\mathrm{CaSO}_3$
(6) $\mathrm{FeSO}_4+\mathrm{Cl}_2 \rightarrow \mathrm{Fe}_2\left(\mathrm{SO}_4\right)_3+\mathrm{FeCl}_3$
(7) $\mathrm{Fe}_2\left(\mathrm{SO}_4\right)_3+\mathrm{Fe} \rightarrow 3 \mathrm{FeSO}_4$
(8) $\mathrm{Fe}_2\left(\mathrm{SO}_4\right)_3+3 \mathrm{Ba}\left(\mathrm{NO}_3\right)_2 \rightarrow 3 \mathrm{BaSO}_4+2 \mathrm{Fe}\left(\mathrm{NO}_3\right)_2$
(9) $\mathrm{Fe}\left(\mathrm{NO}_3\right)_3+3 \mathrm{NaOH} \rightarrow 3 \mathrm{NaNO}_3+\mathrm{Fe}(\mathrm{OH})_3$
2. Lây mẫu từng lọ khí, đánh số thử tự để thuận tiện đối chiếu kết quả thực nghiệm
– Cho từng mẫu khí đi qua từng lọ nước brom, quan sát hiện tượng, mẫu nào làm nhạt màu nước brom là $\mathrm{H}_2 \mathrm{~S}$ và $\mathrm{SO}_2: \mathrm{H}_2 \mathrm{~S}+4 \mathrm{Br}_2+4 \mathrm{H}_2 \mathrm{O} \rightarrow 8 \mathrm{HBr}+\mathrm{H}_2 \mathrm{SO}_4 \quad \mathrm{SO}_2+\mathrm{Br}_2+2 \mathrm{H}_2 \mathrm{O} \rightarrow 2 \mathrm{HBr}+\mathrm{H}_2 \mathrm{SO}_4$
Dẫn hai mẫu khi $\mathrm{H}_2 \mathrm{~S}, \mathrm{SO}_2$ đi qua hai dung dịch nước vôi trong, quan sát hiện tượng, mẫu nào thấy có kết tủa màu trắng làm vẩn đục dung dịch là $\mathrm{SO}_2: \mathrm{SO}_2+\mathrm{Ca}(\mathrm{OH})_2 \rightarrow \mathrm{CaSO}_3+\mathrm{H}_2 \mathrm{O}$
– Dẫn ba mẫu khí còn lại qua từng dung dịch nước vôi trong, quan sát hiện tượng, mẫu nào cho kết tủa màu trắng làm vẩn đục dung dịch là $\mathrm{CO}_2: \mathrm{CO}_2+\mathrm{Ca}(\mathrm{OH})_2 \rightarrow \mathrm{CaCO}_3+\mathrm{H}_2 \mathrm{O}$
– Đốt cháy hoàn toàn hai mẫu khí: $\mathrm{CO}+1 / 2 \mathrm{O}_2 \stackrel{\mathrm{t}^0}{\longrightarrow} \mathrm{CO}_2 \quad \mathrm{H}_2+1 / 2 \mathrm{O}_2 \stackrel{\mathrm{t}^0}{\longrightarrow} \mathrm{H}_2 \mathrm{O}$ ống nghiệm nào quan sát thấy có hơi nước ngưng tụ là mẫu $\mathrm{H}_2$, mẫu còn lại là $\mathrm{CO}$.
3.
Câu 2: (5,0 điểm)
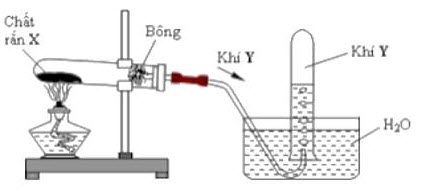
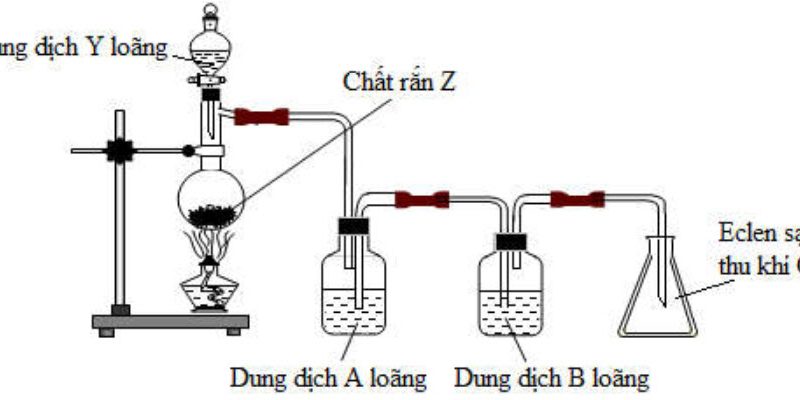
1. Để điều chế một số khí trong phòng thí nghiệm, người ta đã thực hiện thí nghiệm như hình vẽ bên.
a. Trong số các khí sau: $\mathrm{O}_2, \mathrm{NH}_3, \mathrm{CH}_4$, thí nghiệm như hình bên có thể thu được khí nào, tại sao?
b. Với chất khí không thu được bằng phương pháp trên, hãy đề xuất một cách khác để thu được khí đó. c. Khi lắp ống nghiệm lên giá sắt, vì sao phải lắp miệng ống nghiệm hơi chúc xuống?
d. Hãy viết 2 phương trình phản ứng điều chế $\mathrm{O}_2$ và 1 phương trình phản ứng điều chế $\mathrm{CH}_4$.
2. Viết 5 phương trình phản ứng khác nhau tạo thành $\mathrm{CuSO}_4$.
Hướng dẫn
a. Thí nghiệm sử dụng thu khí bằng đẩy nước nên yêu cầu khí cần điều chế không tan hoặc rất ít tan trong nước nên có thể điều chế khí $\mathrm{O}_2$ và $\mathrm{CH}_4$.
b. Khí $\mathrm{NH}_3$ có thể thu khí bằng phương pháp đẩy khí, khi đó miệng ống nghiệm hướng xuống dưới, vì khí $\mathrm{NH}_3$ nhẹ hơn không khí $\left(\mathrm{M}_{\mathrm{NH}_3}=17<\mathrm{M}_{\mathrm{kk}}=29\right)$
c. Phải lắp ống nghiệm hơi chúc xuống để tránh trường hợp hơi nước sinh ra trong quá trình nhiệt phân $\mathrm{KMnO}_4$ có thể chảy ngược lại phần đáy ống nghiệm đang đốt nóng $\mathrm{KMnO}_4$ gây vỡ ống.
d. $2 \mathrm{KMnO}_4 \stackrel{\mathrm{t}^{\mathrm{o}}}{\longrightarrow} \mathrm{K}_2 \mathrm{MnO}_4+\mathrm{MnO}_2+\mathrm{O}_2$
$$
\mathrm{KClO}_3 \stackrel{\mathrm{t}^{\circ}}{\longrightarrow} \mathrm{KCl}+1,5 \mathrm{O}_2
$$
$$
\begin{array}{ll}
\mathrm{CH}_3 \mathrm{COONa}+\mathrm{NaOH} \underset{\mathrm{CaO}, \mathrm{t}^{\circ}}{\rightarrow} \mathrm{CH}_4+\mathrm{Na}_2 \mathrm{CO}_3 \\
\text { 2. } \mathrm{Cu}+2 \mathrm{H}_2 \mathrm{SO}_4 \rightarrow \mathrm{CuSO} \mathrm{CuO}_4+\mathrm{SO}_2+2 \mathrm{H}_2 \mathrm{O} & \mathrm{CuO}+\mathrm{H}_2 \mathrm{SO}_4 \rightarrow \mathrm{CuSO}_4+\mathrm{H}_2 \mathrm{O} \\
\mathrm{Cu}(\mathrm{OH})_2+\mathrm{H}_2 \mathrm{SO}_4 \rightarrow \mathrm{CuSO}_4+2 \mathrm{H}_2 \mathrm{O} & \mathrm{CuCO}_3+\mathrm{H}_2 \mathrm{SO}_4 \rightarrow \mathrm{CuSO}_4+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O} \\
\mathrm{CuS}+4 \mathrm{H}_2 \mathrm{SO}_4 \rightarrow \mathrm{CuSO}_4+4 \mathrm{SO}_2+4 \mathrm{H}_2 \mathrm{O} &
\end{array}
$$
3. Viết các phương trình phản ứng thực hiện dãy chuyển hóa sau (ghi rõ điều kiện, nếu có):

Hướng dẫn
$$
\begin{aligned}
& \mathrm{CH} \equiv \mathrm{CH}+\mathrm{HCl} \stackrel{\mathrm{CuCl}_2, \mathrm{PdCl}_2, \mathrm{t}^{\mathrm{o}}}{\longrightarrow} \mathrm{CH}_2=\mathrm{CHCl} \\
& \mathrm{nCH}_2=\mathrm{CHCl} \stackrel{\mathrm{p}, \mathrm{xtdb}, \mathrm{t}^{\mathrm{o}}}{\longrightarrow}-\left[\mathrm{CH}_2 \mathrm{CH}(\mathrm{Cl})\right]_{\mathrm{n}}-(\mathrm{PVC}) \\
& \mathrm{CH} \equiv \mathrm{CH}+\mathrm{H}_2 \stackrel{\mathrm{PbCO}_3, \mathrm{Pd}, \mathrm{t}^{\circ}}{\longrightarrow} \mathrm{CH}_2=\mathrm{CH}_2 \\
& \mathrm{nCH}_2=\mathrm{CH}_2 \stackrel{\mathrm{p}, \mathrm{xtdb}, \mathrm{t}^{\mathrm{o}}}{\longrightarrow}-\left(\mathrm{CH}_2 \mathrm{CH}_2\right)_{\mathrm{n}}-(\mathrm{PE}) \\
& \mathrm{CH}_2=\mathrm{CH}_2+\mathrm{H}_2 \mathrm{O} \stackrel{\mathrm{H}_2 \mathrm{SO}_{4(1)}, \mathrm{t}^{\mathrm{o}}}{\longrightarrow} \mathrm{CH}_3 \mathrm{CH}_2 \mathrm{OH} \\
& \mathrm{C}_2 \mathrm{H}_5 \mathrm{OH}+\mathrm{O}_2 \stackrel{\text { men giấm }}{\longrightarrow} \mathrm{CH}_3 \mathrm{COOH}+\mathrm{H}_2 \mathrm{O} \\
& \mathrm{CH}_3 \mathrm{COOH}+\mathrm{Na} \longrightarrow \mathrm{CH}_3 \mathrm{COONa}+1 / 2 \mathrm{H}_2 \\
& \mathrm{CH}_3 \mathrm{COOH}+\mathrm{C}_2 \mathrm{H}_5 \mathrm{OH} \stackrel{\mathrm{H}_2 \mathrm{SO}_{4(\mathrm{~d})}, \mathrm{t}^{\mathrm{o}}}{\longrightarrow} \mathrm{CH}_3 \mathrm{COOC}_2 \mathrm{H}_5 \\
& \mathrm{CH}_3 \mathrm{COONa}+\mathrm{NaOH} \stackrel{\mathrm{CaO}, \mathrm{t}^{\circ}}{\longrightarrow} \mathrm{CH}_4+\mathrm{Na}_2 \mathrm{CO}_3 \\
&
\end{aligned}
$$
Câu 3: (3,0 điểm)
1. Hỗn hợp $\mathrm{X}$ gồm $\mathrm{BaO}, \mathrm{Al}_2 \mathrm{O}_3$ và $\mathrm{Fe}_{\mathrm{x}} \mathrm{O}_{\mathrm{y}}$. Cho $\mathrm{X}$ vào nước dư, thu được dung dịch $\mathrm{A}$ và phần không tan $\mathrm{B}$. Tách phần không tan $\mathrm{B}$, sục khí $\mathrm{CO}_2$ dư vào dung dịch $\mathrm{A}$, thu được kết tủa $\mathrm{D}$. Cho khí $\mathrm{CO}$ dư qua $\mathrm{B}$ nung nóng, thu được chất rắn $\mathrm{E}$. Cho $\mathrm{E}$ tác dụng với dung dịch $\mathrm{H}_2 \mathrm{SO}_4$ loãng, rồi cho dung dịch thu được tác dụng với dung dịch $\mathrm{KMnO}_4$. Viết các phương trình phản ứng xảy ra, biết các phản ứng xảy ra hoàn toàn.
Hướng dẫn
Nhận thấy: chưa có tương quan mol $\mathrm{BaO}$ và $\mathrm{Al}_2 \mathrm{O}_3$ nên rắn $\mathrm{B}$ có thể là: $\mathrm{Fe}_2 \mathrm{O}_{\mathrm{n}}$ hoặc $\left(\mathrm{Al}_2 \mathrm{O}_3\right.$ dư, $\left.\mathrm{Fe}_2 \mathrm{O}_{\mathrm{n}}\right)$
$$
\begin{aligned}
& \mathrm{BaO}+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{Ba}(\mathrm{OH})_2 \quad \mathrm{Ba}(\mathrm{OH})_2+\mathrm{Al}_2 \mathrm{O}_3 \rightarrow \mathrm{Ba}\left(\mathrm{AlO}_2\right)_2+\mathrm{H}_2 \mathrm{O} \quad \mathrm{nCO}+\mathrm{Fe}_2 \mathrm{O}_{\mathrm{n}} \rightarrow 2 \mathrm{Fe}+\mathrm{nCO}_2 \\
& \mathrm{Al}_2 \mathrm{O}_3+3 \mathrm{H}_2 \mathrm{SO}_4 \rightarrow \mathrm{Al}_2\left(\mathrm{SO}_4\right)_3+3 \mathrm{H}_2 \mathrm{O} \quad \mathrm{Fe}+\mathrm{H}_2 \mathrm{SO}_4 \rightarrow \mathrm{FeSO}_4+\mathrm{H}_2 \\
& 10 \mathrm{FeSO}_4+2 \mathrm{KMnO}_4+8 \mathrm{H}_2 \mathrm{SO}_4 \rightarrow 5 \mathrm{Fe}_2\left(\mathrm{SO}_4\right)_3+\mathrm{K}_2 \mathrm{SO}_4+2 \mathrm{MnSO}_4+8 \mathrm{H}_2 \mathrm{O} \\
& \mathrm{Ba}\left(\mathrm{AlO}_2\right)_2+2 \mathrm{CO}_2+4 \mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{Ba}\left(\mathrm{HCO}_3\right)_2+2 \mathrm{Al}(\mathrm{OH})_3 \quad 2 \mathrm{CO}_2+\mathrm{Ba}(\mathrm{OH})_2 \rightarrow \mathrm{Ba}\left(\mathrm{HCO}_3\right)_2 \\
&
\end{aligned}
$$
2. Hòa tan hoàn toàn 25,9 gam hỗn hợp $\mathrm{X}$ gồm $\mathrm{Al}$ và $\mathrm{FeCO}_3$ trong $400 \mathrm{ml}$ dung dịch $\mathrm{HCl} 2 \mathrm{M}$, thu được dung dịch $Y$ và 7,84 lít hỗn hợp khí Z (đktc).
a. Tính phần trăm khối lượng các chất trong hỗn hợp X.
b. Dẫn toàn bộ khí $\mathrm{Z}$ vào $200 \mathrm{ml}$ dung dịch hỗn hợp gồm $\mathrm{NaOH} 0,4 \mathrm{M}$ và $\mathrm{Ba}(\mathrm{OH})_2 0,5 \mathrm{M}$, thu được $\mathrm{m}$ gam kết tủa. Tính m.
c. Cho từ từ đến hết $\mathrm{V} \mathrm{ml}$ dung dịch $\mathrm{NaOH} 1 \mathrm{M}$ vào toàn bộ dung dịch $\mathrm{Y}$, lọc kết tủa, nung kết tủa trong không khí đến khối lượng không đổi được 19,06 gam chất rắn. Tính $\mathrm{V}$.
(Biết các phản ứng xảy ra hoàn toàn).
Hướng dẫn
a. $\left\{\begin{array}{l}\mathrm{Al}: \mathrm{a} \\ \mathrm{FeCO}_3: \mathrm{b}\end{array} \rightarrow\left\{\begin{array}{l}\mathrm{H}_2: 1,5 \mathrm{a} \\ \mathrm{CO}_2: \mathrm{b}\end{array} \rightarrow\left\{\begin{array}{l}27 \mathrm{a}+116 \mathrm{~b}=25,9 \\ 1,5 \mathrm{a}+\mathrm{b}=0,35\end{array} \rightarrow\left\{\begin{array}{l}\mathrm{a}=0,1 \\ \mathrm{~b}=0,2\end{array} \rightarrow \% \mathrm{~m}_{\mathrm{X}}\left\{\begin{array}{l}\mathrm{Al}: 10,42 \% \\ \mathrm{FeCO}_3: 89,58 \%\end{array}\right.\right.\right.\right.\right.$
b. $\mathrm{CO}_2^{0,2}+\left\{\begin{array}{l}\mathrm{NaOH}^{0,08} \\ \mathrm{Ba}(\mathrm{OH})_2^{0,1}\end{array} \rightarrow 1<\frac{\mathrm{n}_{\mathrm{OH}}}{\mathrm{n}_{\mathrm{CO}_2}}=\frac{0,28}{0,2}<2 \rightarrow\right.$ kết tủa $\mathrm{BaCO}_3$ bị hòa tan một phần
$\mathrm{CO}_2+\mathrm{Ba}(\mathrm{OH})_2 \rightarrow \mathrm{BaCO}_3+\mathrm{H}_2 \mathrm{O} \quad \mathrm{CO}_2+\mathrm{NaOH} \rightarrow \mathrm{NaHCO}_3 \quad \mathrm{CO}_2+\mathrm{BaCO}_3+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{Ba}_{(}\left(\mathrm{HCO}_3\right)_2$
$0,1 \leftarrow 0,1 \rightarrow \quad 0,1 \quad 0,08 \leftarrow 0,08 \rightarrow \quad 0,02 \rightarrow 0,02$
$\rightarrow \mathrm{nBaCO}_{3(\mathrm{du})}=0,08 \rightarrow \mathrm{m}=15,76$ gam.
TH1: kết tủa $\mathrm{Al}(\mathrm{OH})_3$ chưa bị hòa tan
$\mathrm{NaOH}+\mathrm{HCl} \rightarrow \mathrm{NaCl}+\mathrm{H}_2 \mathrm{O} \quad 2 \mathrm{NaOH}+\mathrm{FeCl}_2 \rightarrow 2 \mathrm{NaCl}+\mathrm{Fe}(\mathrm{OH})_2 \quad 3 \mathrm{NaOH}+\mathrm{AlCl}_3 \rightarrow \mathrm{Al}(\mathrm{OH})_3$
$\rightarrow \mathrm{nNaOH}=\mathrm{V}=0,68($ lít $)=680(\mathrm{ml})$
$\mathrm{TH}_2$ : kết tủa $\mathrm{Al}(\mathrm{OH})_3$ bị hòa tan một phần
$\mathrm{NaOH}+\mathrm{HCl} \rightarrow \mathrm{NaCl}+\mathrm{H}_2 \mathrm{O}$
$2 \mathrm{NaOH}+\mathrm{FeCl}_2 \rightarrow 2 \mathrm{NaCl}+\mathrm{Fe}(\mathrm{OH})_2$
$0,1 \leftarrow 0,1$
$0,4 \leftarrow 0,2 \rightarrow \quad 0,2$
$3 \mathrm{NaOH}+\mathrm{AlCl}_3 \rightarrow \mathrm{Al}(\mathrm{OH})_3+3 \mathrm{NaCl}$
$\mathrm{NaOH}+\mathrm{Al}(\mathrm{OH})_3 \rightarrow \mathrm{NaAlO}_2+2 \mathrm{H}_2 \mathrm{O}$
$0,3 \leftarrow \leftarrow, 1 \rightarrow \quad 0,1$
$0,04 \leftarrow 0,04$
$\rightarrow \mathrm{nNaOH}=\mathrm{V}=0,84$ (lít) $=840(\mathrm{ml})$.
Vậy V nhận hai giá trị thỏa mãn là: $680(\mathrm{ml})$ hoặc 840 (ml).
Câu 4: (3,0 điểm)
1. Viết công thức cấu tạo các chất từ $\mathrm{A}_1$ đến $\mathrm{A}_{10}$ trong các trường hợp sau (với chất có hơn 1 công thức cấu tạo thì chỉ cần lấy 1 ví dụ minh họa):
a. Ankan $\mathrm{A}_1$ tác dụng với $\mathrm{Cl}_2$ (ánh sáng, tỉ lệ mol $1: 1$ ) thu được 3 sản phẩm monoclo.
b. Anken $A_2$ không đối xứng.
c. Ankadien $\mathrm{A}_3$ có hai nối đôi không liền nhau.
d. Ankin $\mathrm{A}_4$ không tác dụng với $\mathrm{AgNO}_3 / \mathrm{NH}_3$ (hay $\mathrm{Ag}_2 \mathrm{O} / \mathrm{NH}_3$ ).
e. Rượu (ancol) no $\mathrm{A}_5$, đa chức, mạch hở có số nhóm chức khác nhau số nguyên tử cacbon.
g. Axit hữu cơ $\mathrm{A}_6$ mà muối của nó khi thực hiện phản ứng vôi tôi xút thu được etilen.
h. Este $A_7$ có số nguyên tử cacbon ít nhất.
i. Hidrocacbon $A_8$ có 6 nguyên tử cacbon mà 6 nguyên tử đó ở vị trí giống nhau.
k. Hidrocacbon mạch hở $A_9$ có 4 nguyên tử cacbon và 2 nguyên tử hidro.
1. Hợp chất hữu cơ $\mathrm{A}_{10}$ tạp chức, no, có công thức phân tử $\mathrm{C}_3 \mathrm{H}_6 \mathrm{O}_3$.
Hướng dẫn
a.
b. $\mathrm{CH}_2=\mathrm{CHCH}_3$
c. $\mathrm{CH}_2=\mathrm{CHCH}=\mathrm{CH}_2$
d. $\mathrm{CH}_3 \mathrm{C} \equiv \mathrm{CCH}_3$
e. $\mathrm{CH}_2(\mathrm{OH}) \mathrm{CH}_2 \mathrm{CH}_2(\mathrm{OH})$
g. $\mathrm{CH}_2=\mathrm{CHCOONa}$
h. $\mathrm{HCOOCH}_3$
i. Benzen $\mathrm{C}_6 \mathrm{H}_6$
k. $\mathrm{CH} \equiv \mathrm{C}-\mathrm{C} \equiv \mathrm{CH}$
I. $\mathrm{HOC}_2 \mathrm{H}_4 \mathrm{COOH}$
2. Chia hỗn hợp $\mathrm{X}$ gồm 2 rượu đơn chức là đồng đẳng kế tiếp thành hai phần bằng nhau:
– Đốt cháy hoàn toàn phần 1 , thu được 5,6 lít $\mathrm{CO}_2$ và 6,3 gam $\mathrm{H}_2 \mathrm{O}$. Xác định công thức phân tử hai rượu.
– Đun phần 2 với $\mathrm{H}_2 \mathrm{SO}_4$ đặc, sau thời gian thu được hỗn hợp $\mathrm{Y}$ gồm 2 anken và hỗn hợp chất hữu cơ $\mathrm{Z}$ gồm: 3 ete rượu dư. Dẫn $\mathrm{Y}$ vào dung dịch $\mathrm{Br}_2$ dư, thấy có 8 gam $\mathrm{Br}_2$ phản ứng và khối lượng bình tăng 1,68 gam. Để đốt cháy hoàn toàn $\mathrm{Z}$ cần bao nhiêu lít khí $\mathrm{O}_2$ ?
Hướng dẫn
Phần 1: $\left\{\begin{array}{l}\mathrm{CO}_2^{0,25} \\ \mathrm{H}_2 \mathrm{O}^{0,35}\end{array} \rightarrow\left\{\begin{array}{l}\text { ancol no } \\ \mathrm{n}_{\text {ancol }}=\mathrm{n}_{\mathrm{H}_2 \mathrm{O}}-\mathrm{n}_{\mathrm{CO}_2}=0,1\end{array} \rightarrow\left\{\begin{array}{l}\text { Số } \mathrm{C}_{\mathrm{X}}=0,25: 0,1=2,5 \\ \rightarrow \mathrm{C}_2 \mathrm{H}_5 \mathrm{OH} ; \mathrm{C}_3 \mathrm{H}_7 \mathrm{OH}\end{array}\right.\right.\right.$
Phần 2:
$$
\mathrm{Y}\left\{\begin{array} { l }
{ \mathrm { C } _ { 2 } \mathrm { H } _ { 4 } : \mathrm { u } } \\
{ \mathrm { C } _ { 3 } \mathrm { H } _ { 6 } : \mathrm { v } }
\end{array} \rightarrow \left\{\begin{array} { l }
{ \stackrel { \mathrm { n } _ { \text { anken } } = \mathrm { n } _ { \mathrm { Br } _ { 2 } } } { \longrightarrow } \mathrm { u } + \mathrm { v } = 0 , 0 5 } \\
{ \stackrel { 1 , 6 8 \mathrm { g } } { \longrightarrow } 2 8 \mathrm { u } + 4 2 \mathrm { v } = 1 , 6 8 }
\end{array} \rightarrow \left\{\begin{array} { l }
{ \mathrm { u } = 0 , 0 3 } \\
{ \mathrm { v } = 0 , 0 2 }
\end{array} \rightarrow \left\{\begin{array}{l}
\mathrm{n}_{\mathrm{O}_{2(\mathrm{Y})}}=3 \mathrm{n}_{\mathrm{C}_2 \mathrm{H}_4}+4,5 \mathrm{n}_{\mathrm{C}_3 \mathrm{H}_6}=0,18 \\
\mathrm{n}_{\mathrm{O}_{2(\mathrm{X})}}=2 \mathrm{n}_{\mathrm{CO}_2}+\mathrm{n}_{\mathrm{H}_2 \mathrm{O}}=0,85 \rightarrow \mathrm{n}_{\mathrm{O}_{2(\mathrm{Z})}}=0,67
\end{array}\right.\right.\right.\right.
$$
Vậy để đốt cháy $\mathrm{Z}$ cần $0,67 \mathrm{~mol}$ khí $\mathrm{O}_2$.
3. Đốt cháy hoàn toàn 0,3 mol hỗn hợp $\mathrm{A}$ gồm 1 anken $\mathrm{X}$ và 1 ankin $\mathrm{Y}$ thu được 15,68 lít $\mathrm{CO}_2$ và 9 gam $\mathrm{H}_2 \mathrm{O}$.
a. Xác định công thức cấu tạo của $X$ và $Y$.
b. Trong một bình kín chứa 0,3 mol hỗn hợp $\mathrm{A}$ như trên, $0,6 \mathrm{~mol}_2$ và một ít bột $\mathrm{Ni}$. Nung nóng bình một thời gian, thu được hỗn hợp khí $\mathrm{B}$ có tỉ khối so với $\mathrm{H}_2$ bằng $53 / 6$. Sục $\mathrm{B}$ vào lượng dư dung dịch $\mathrm{AgNO}_3$ trong $\mathrm{NH}_3$ đến phản ứng hoàn toàn, thu được hỗn hợp khí $\mathrm{Z}$ và $\mathrm{m}$ gam kết tủa. Hỗn hợp khí $\mathrm{Z}$ phản ứng vừa đủ với $0,1 \mathrm{~mol} \mathrm{Br}_2$ trong dung dịch. Tính $\mathrm{m}$.
Hướng dẫn
a. Đốt cháy: (Anken) $\mathrm{nCO}_2=\mathrm{nH}_2 \mathrm{O}$ và $\mathrm{nAnkin}=\mathrm{nCO}_2-\mathrm{nH}_2 \mathrm{O}$ nên $\mathrm{nAnkin}=0,7-0,5=0,2$
[ĐỀ THI HSG SONN LA 2022]
Mol $\left\{\begin{array}{l}\mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}}: 0,1 \\ \mathrm{C}_{\mathrm{m}} \mathrm{H}_{2 \mathrm{~m}-2}: 0,2\end{array} \stackrel{\text { BT.C }}{\longrightarrow}\left\{\begin{array}{l}0,1 \mathrm{n}+0,2 \mathrm{~m}=0,7 \\ \rightarrow \mathrm{n}+2 \mathrm{~m}=7\end{array} \stackrel{\mathrm{n}, \mathrm{m} \in \mathrm{N}^*}{\longrightarrow}\left\{\begin{array}{l}\mathrm{n}=3 \rightarrow \mathrm{C}_3 \mathrm{H}_6 \\ \mathrm{n}=2 \rightarrow \mathrm{C}_2 \mathrm{H}_2\end{array}\right.\right.\right.$
Câu 5: (4,0 điểm )
1. Cho 0,1 mol một chất hữu cơ mạch hở $\mathrm{E}$ tác dụng vừa đủ với $100 \mathrm{ml}$ dung dịch $\mathrm{NaOH} 2 \mathrm{M}$, thu được hỗn hợp hai muối của hai axit hữu cơ mạch hở X, Y đều đơn chức và một rượu no $\mathrm{Z}$ (không còn sản phẩm nào khác). Khi đốt hoàn toàn $0,1 \mathrm{~mol}$ rượu $\mathrm{Z}$ cần 5,6 lít khí $\mathrm{O}_2$. Axit $\mathrm{X}$ no, khi đốt cháy hoàn toàn a mol $\mathrm{X}$ thì số mol sản phẩm vượt quá $2 \mathrm{a}$ mol. Axit $\mathrm{Y}$ không no, chỉ chứa một liên kết đôi $\mathrm{C}=\mathrm{C}$, có mạch cacbon phân nhánh. Đốt cháy hết hỗn hợp hai muối thu được ở trên tạo ra $\mathrm{Na}_2 \mathrm{CO}_3, \mathrm{CO}_2$ và $\mathrm{H}_2 \mathrm{O}$. Cho toàn bộ khí $\mathrm{CO}_2$ và hơi nước sinh ra hấp thụ vào bình đựng $500 \mathrm{ml}$ dung dịch $\mathrm{Ba}(\mathrm{OH})_2 0,9 \mathrm{M}$, thu được 78,8 gam kết tủa.
Xác định công thức cấu tạo của rượu $\mathrm{Z}$, của hai axit $\mathrm{X}$, $\mathrm{Y}$ và của chất hữu cơ $\mathrm{E}$.
Hướng dẫn
Ancol no, đa chức $\mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}+2} \mathrm{O}_{\mathrm{x}}\left(\mathrm{n}, \mathrm{x} \in \mathrm{N}^* ; \mathrm{n} \geq \mathrm{x}\right): \mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}+2} \mathrm{O}_{\mathrm{x}}+\frac{3 \mathrm{n}+1-\mathrm{x}}{2} \mathrm{O}_2 \rightarrow \mathrm{nCO}_2+(\mathrm{n}+1) \mathrm{H}_2 \mathrm{O}$
$$
\rightarrow 0,1 \frac{3 n+1-x}{2}=0,25 \rightarrow 3 n-x=4 \rightarrow\left\{\begin{array}{l}
x=2 \\
n=2
\end{array} \rightarrow \mathrm{C}_2 \mathrm{H}_4(\mathrm{OH})_2\right.
$$
Axit no, đơn chức: $\mathrm{C}_{\mathrm{m}} \mathrm{H}_{2 \mathrm{~m}} \mathrm{O}_2+\frac{3 \mathrm{~m}-2}{2} \mathrm{O}_2 \rightarrow \mathrm{mCO}_2+\mathrm{mH}_2 \mathrm{O}$
$\stackrel{\text { Giả sử } \mathrm{a}=1}{\longrightarrow} \mathrm{n}_{\text {Axit }}=1 \rightarrow \mathrm{n}_{\left(\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O}\right)}=2 \mathrm{~m}>2 \rightarrow \mathrm{m}>1$
Vì $\mathrm{nBa}(\mathrm{OH})_2=0,45>\mathrm{nBaCO}_3=0,4$ nên có hai trường hợp:
$\mathrm{TH}_1$ : kết tủa $\mathrm{BaCO}_3$ chưa bị hòa tan $\mathrm{CO}_2+\mathrm{Ba}(\mathrm{OH})_2 \rightarrow \mathrm{BaCO}_3+\mathrm{H}_2 \mathrm{O}$
$0,4 \quad \leftarrow 0,4$
Qui đổi muối $\left\{\begin{array}{l}\mathrm{CH}_3 \mathrm{COONa}: 0,1 \\ \mathrm{C}_3 \mathrm{H}_5 \mathrm{COONa}: 0,1 \\ \mathrm{CH}_2: \mathrm{p}\end{array} \rightarrow\left\{\begin{array}{l}\mathrm{Na}_2 \mathrm{CO}_3^{0,1} \\ \mathrm{CO}_2{ }^{0,6+\mathrm{p}}\end{array} \rightarrow\left\{\begin{array}{l}0,6+\mathrm{p}=0,4 \\ \rightarrow \mathrm{p}<0\end{array} \rightarrow\right.\right.\right.$ loại
$\mathrm{TH}_2$ : kết tủa $\mathrm{BaCO}_3$ bị hòa tan một phần Vậy chất hữu cơ $\mathrm{E}$ là: $\mathrm{CH}_2=\mathrm{C}\left(\mathrm{CH}_3\right) \mathrm{COOCH}_2 \mathrm{CH}_2 \mathrm{OOCCH}_3$.
2.
a. Hòa tan hoàn toàn oxit kim loại $\mathrm{MO}$ bằng một lượng vừa đủ dung dịch $\mathrm{H}_2 \mathrm{SO}_4 20 \%$ (loãng), thu được dung dịch muối trung hòa có nồng độ $27,05 \%$. Xác định oxit kim loại $\mathrm{MO}$.
b. Hòa tan hết $\mathrm{m}$ gam hỗn hợp $\mathrm{X}$ gồm $\mathrm{M}, \mathrm{MO}$ và $\mathrm{M}_{\mathrm{x}} \mathrm{O}_{\mathrm{y}}$ ( $\mathrm{M}$ là kim loại ở phần $2 \mathrm{a}$ ) vào dung dịch $\mathrm{HCl}$ dư, thu được a mol $\mathrm{H}_2$ và dung dịch chứa 31,19 gam hỗn hợp muối. Mặt khác, hòa tan hoàn toàn $\mathrm{m}$ gam $\mathrm{X}$ trong dung dịch chứa $0,55 \mathrm{~mol}_2 \mathrm{SO}_4$ đặc đun nóng thu được dung dịch $\mathrm{Y}$ và $0,14 \mathrm{~mol} \mathrm{SO}_2$
(không còn sản phẩm khử khác của lưu huỳnh). Cho từ từ $400 \mathrm{ml}$ dung dịch $\mathrm{NaOH} 1 \mathrm{M}$ vào $\mathrm{Y}$, sau khi phản ứng kết thúc thu được 10,7 gam một chât kết tủa. Tính $\mathrm{a}$.
Hướng dẫn
a. $\mathrm{Mol}: \mathrm{MO}^{1(\mathrm{~mol})} \rightarrow \mathrm{MSO}_4{ }^1 \stackrel{27,05 \%}{\rightarrow} \frac{\mathrm{M}+96}{\mathrm{M}+16+98: 20 \%}=0,2705 \rightarrow \mathrm{M}=56 \rightarrow \mathrm{FeO}$
$\left(\stackrel{\text { BT.S }}{\longrightarrow} \mathrm{n}_{\mathrm{H}_2 \mathrm{SO}_4}=\mathrm{n}_{\mathrm{SO}_2}+\mathrm{n}_{\mathrm{SO}_4} ; \stackrel{\text { BT.Fe }}{\longrightarrow} \mathrm{n}_{\mathrm{Fe}(\mathrm{X})}=2 \mathrm{n}_{\mathrm{Fe}_2\left(\mathrm{SO}_4\right)_3}+\mathrm{n}_{\mathrm{Fe}(\mathrm{OH})_3}\right)$
$\left\{\begin{array}{l}\mathrm{FeCl}_2: \mathrm{a} \\ \mathrm{FeCl}_3: b\end{array} \rightarrow\left\{\begin{array}{l}\stackrel{\mathrm{BT} \cdot \mathrm{Fe}}{\longrightarrow} \mathrm{a}+\mathrm{b}=0,24 \\ \stackrel{31,19 \mathrm{~g}}{\longrightarrow} 127 \mathrm{a}+162,5 \mathrm{~b}=31,19\end{array} \rightarrow\left\{\begin{array}{l}\mathrm{a}=0,22 \\ \mathrm{~b}=0,02\end{array} \rightarrow\left\{\begin{array}{l}\frac{\mathrm{BT.Cl}}{\longrightarrow} \mathrm{HCl}^{0,5} \\ \mathrm{n}_{\mathrm{HCl}}=2 \mathrm{n}_{\mathrm{O}(\mathrm{X})}+2 \mathrm{n}_{\mathrm{H}_2}\end{array} \rightarrow \mathrm{a}=0,03\right.\right.\right.\right.$
Vậy giá trị của $\mathrm{a}=0,03$