File word đề thi và đáp án HSG Hóa 9 Chu Văn An – Đề ôn thi số 2
File word đề thi và đáp án HSG Hóa 9 Chu Văn An – Đề ôn thi số 2
Câu 1: Một hỗn hợp chứa Fe, FeO, Fe2O3. Nếu hoà tan a gam hỗn hợp trên bằng dung dịch HCl dư thì khối lượng H2 thoát ra bằng 1,00% khối lượng hỗn hợp đem thí nghiệm. Nếu khử a gam hỗn hợp trên bằng H2 dư thì thu được khối lượng nước bằng 21,15% khối lượng hỗn hợp đem thí nghiệm. Xác định phần trăm về khối lượng mỗi chất có trong a gam hỗn hợp trên.
Câu 2: Cho 316,0 gam dung dịch một muối hiđrocacbonat (A) 6,25% vào dung dịch H2SO4 loãng vừa đủ, sau khi phản ứng xảy ra hoàn toàn thu được 16,5 gam muối sunfat trung hoà. Mặt khác cũng cho lượng dung dịch muối hiđrocacbonat (A) như trên vào dung dịch HNO3 vừa đủ, rồi cô cạn từ từ dung dịch sau phản ứng thì thu được 47,0 gam muối B. Xác định A, B.
Câu 3: Cho các hóa chất CaCO3, NaCl, H2O và các dụng cụ cần thiết để làm thí nghiệm, trình bày phương pháp để điều chế dung dịch gồm 2 muối Na2CO3 và NaHCO3 có tỉ lệ số mol là 1:1.
Câu 4: Viết phương trình phản ứng trong đó 0,75 mol H2SO4 tham gia phản ứng sinh ra
a/ 8,4 lít SO2 (đktc). b/ 16,8 lít SO2 (đktc).
c/ 25,2 lít SO2 (đktc). d/ 33,6 lít SO2 (đktc).
Câu 5: Dẫn luồng khí CO qua ống sứ có chứa m gam hỗn hợp chất rắn X gồm CuO và Fe2O3 nung nóng, sau một thời gian trong ống sứ còn lại n gam hỗn hợp chất rắn Y. Khí thoát ra được hấp thụ hết vào dung dịch Ca(OH)2 dư được p gam kết tủa. Viết các phương trình hóa học của phản ứng và thiết lập biểu thức liên hệ giữa n, m, p.
Câu 6: Hai cốc thủy tinh A, B đựng dung dịch HCl dư đặt trên hai đĩa cân, thấy cân ở trạng thái thăng bằng. Cho 5,00 gam CaCO3 vào cốc A và 4,79 gam M2CO3 (M là kim loại) vào cốc B. Sau khi các muối đã hòa tan hoàn toàn thấy cân trở lại vị trí thăng bằng. Hãy xác định M.
Câu 7: Trình bày các thí nghiệm để xác định thành phần định tính và định lượng của nước.
Câu 8: Nêu cách pha chế 500,0 ml dung dịch NaCl 0,9% (nước muối sinh lí) từ muối ăn nguyên chất và nước cất. Nêu tên các dụng cụ thí nghiệm cần thiết và mô phỏng cách tiến hành bằng hình vẽ.
Hướng dẫn
Câu 1:
Giả sử a = 100 gam. Gọi x, y, z lần lượt là số mol Fe, FeO, Fe2O3 trong a gam
Hoà tan a g hỗn hợp trên bằng dung dịch HCl dư
Fe + 2 HCl ® FeCl2 + H2
x 2x x x
FeO + 2 HCl ® FeCl2 + H2O
y 2y y y
Fe2O3+ 6HCl ® 2FeCl3 + 3H2O
z 6z 2z 3z
Ta có 2x = 1(*)
Khử a g hỗn hợp trên bằng H2 dư
FeO + H2 ® Fe + H2O
y y y y
Fe2O3 + 3 H2 ® 2Fe + 3 H2O
z 3z 2z 3z
Ta có 18y + 54z = 21,15(**)
Lại có 56x + 72y + 160z = 100(***)
Từ (*), (**), (***) có hệ phương trình:
2x = 1
18y + 54z = 21,15
56x + 72y + 160z = 100
Giải hệ PT ta có x = 0,5; y = 0,5; z = 0,225
%Fe = 28%; %FeO = 36%; %Fe2O3 = 36%
Câu 2:
Gọi công thức của muối A: R(HCO3)n
Có: mA = 316.6,25% = 19,75 gam
2R(HCO3)n + nH2SO4 ® R2(SO4)n + 2nCO2 + 2nH2O
19,75gam 16,5gam
=> 16,5.(2R + 2.61n) = 19,75.(2R + 96n)
suy ra: R= 18n
Ta có bảng sau:
| n | 1 | 2 | 3 |
| R | 18 | 36 | 54 |
| KL | NH4 | Không thoả mãn | Không thoả mãn |
muối A là: NH4HCO3
– Theo đề bài: nA = 19,75 : 79 = 0,25 mol
NH4HCO3 + HNO3 ® NH4NO3 + H2O + CO2
0,25 mol ® 0,25 mol
m(NH4NO3) = 80 × 0,25 = 20 gam®muối B là muối ngậm nước.
– Đặt CTPT của B là: NH4NO3.xH2O
m(H2O) = 47 – 20 = 27 gam ® n(H2O) = 27/18= 1,5 mol
® x = 6
Công thức của B: NH4NO3.6H2O
Câu 3:
- Tạo ra và thu lấy khí CO2: Nhiệt phân CaCO3
CaCO3 $\xrightarrow{{{t}^{o}}}$ CaO + CO2 ↑
- Tạo ra dung dịch NaOH: Điện phân dd NaCl bão hòa có màng ngăn 2NaCl + 2H2O $\xrightarrow[mnx]{pdd}$ 2NaOH + Cl2↑ + H2↑
- Viết các phương trình tạo muối
- CO2(dư) + NaOH → NaHCO3 (1)
2a → 2a (mol)
- NaHCO3 + NaOH → Na2CO3 + H2O (2)
a ← a → a (mol)
– Trình bày cách tiến hành thí nghiệm: lấy 2 thể tích dung dịch NaOH cho vào cốc A và cốc B sao cho VA = 2VB (dùng cốc chia độ)
Gọi số mol NaOH ở cốc A là 2a mol thì số mol NaOH ở cốc B là a mol
Sục CO2 dư vào cốc A, xảy ra phản ứng (1)
Sau đó đỏ cốc A vào cốc B: xảy ra phương trình (2)
Kết quả thu được dung dịch có số mol NaHCO3 là a mol và số mol Na2CO3 là a mol => tỉ lệ 1:1
Câu 4:
a) $\frac{{{n}_{S{{O}_{2}}}}}{{{n}_{{{H}_{2}}S{{O}_{4}}}}}=\frac{0,375}{0,75}=\frac{1}{2}$ Þ Cu + 2H2SO4 đặc $\xrightarrow{{{t}^{0}}}$ CuSO4 + SO2 + 2H2O
b) $\frac{{{n}_{S{{O}_{2}}}}}{{{n}_{{{H}_{2}}S{{O}_{4}}}}}=\frac{0,75}{0,75}=1$ Þ Na2SO3 + H2SO4 $\xrightarrow{^{{}}}$ Na2SO4 + SO2 + H2O
c) $\frac{{{n}_{S{{O}_{2}}}}}{{{n}_{{{H}_{2}}S{{O}_{4}}}}}=\frac{1,125}{0,75}=\frac{3}{2}$ Þ S + 2H2SO4 đặc $\xrightarrow{{{t}^{0}}}$ 3SO2 + 2H2O
d)$\frac{{{n}_{S{{O}_{2}}}}}{{{n}_{{{H}_{2}}S{{O}_{4}}}}}=\frac{1,5}{0,75}=2$Þ 2NaHSO3 + H2SO4 $\xrightarrow{^{{}}}$ Na2SO4 + 2SO2 + H2O
Chú ý: Học sinh chọn chất khác và viết phương trình hóa học đúng, cho điểm tối đa tương ứng.
Câu 5:
(1) 3Fe2O3 + CO 2Fe3O4 + CO2
(2) Fe2O3 + CO 2FeO + CO2
(3) Fe2O3 + 3 CO 2Fe + 3 CO2
(4) CuO + CO Cu + CO2
(5) Ca(OH)2 + CO2 CaCO3 + H2O
Áp dụng định luật bảo toàn khối lượng:
mx + mco = my + mCO2
→ m – n = mCO2 – mCO
→ m – n = 44.n CO2 – 28.nCO
Mà nCO = nCO2 = nCaCO3 =
→ m – n =
→ m = n + 0,16p
Câu 6:
CaCO3 + 2HCl → CaCl2 + H2O + CO2 (1)
M2CO3 + 2HCl → 2 MCl + H2O + CO2 (2)
Từ(1) ta có: Khối lượng cốc A tăng
Từ (2) Ta có: Khối lượng cốc B tăng
M = 23 vậy M là Na
Câu 7:
Sự phân hủy nước.
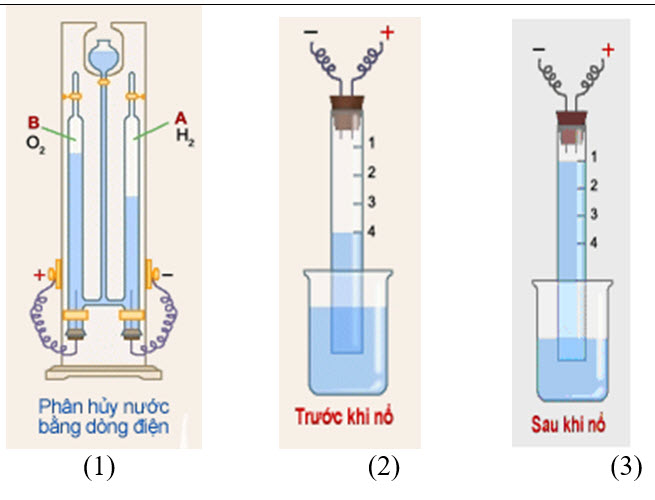
Lắp thiết bị phân hủy nước như hình (1). Khi cho dòng điện một chiều đi qua nước (đã có pha thêm một ít dung dịch axit sunfuric để làm tăng độ dẫn điện của nước), trên bề mặt hai điện cực (Pt) xuất hiện bọt khí. Các khí này tích tụ trong hai đầu ống nghiệm thu A và B. Đốt khí trong A, nó cháy kèm theo tiếng nổ nhỏ, đó là H2. Khí trong B làm cho tàn đóm đỏ bùng cháy, đó là khí oxi.
Sự tổng hợp nước:
Cho nước vào đầy ống thủy tinh hình trụ. Cho vào ống lần lượt 2 thể tích khí hiđro và 2 thể tích khí oxi. Mực nước trong ống ở vạch số 4 (hình (2)). Đốt bằng tia lửa điện hỗn hợp hi đro và oxi sẽ nổ. Mức nước trong ống dâng lên. Khi nhiệt độ trong ống bằng nhiệt độ bên ngoài thì mực nước dừng lại ở vạch chia số 1 (Hình (3)), khí còn lại làm tàn đóm bùng cháy đó là oxi.
Xác định thành phần định lượng của H2O
Từ các dữ kiện thí nghiệm trên ta có phương trình hóa học tạo thành H2O
2H2 + O2 ® 2H2O
Do tỉ lệ về thể tích bằng tỉ lệ về số mol nên ta có
nH2:nO2 = 2:1 ® mH2:mO2 = 4:32 = 1:8. Vậy phần trăm khối lượng mỗi nguyên tố trong nước là
%H = ® %O = 100%-%H = 88,9%
Câu 8:
Khối lượng NaCl cần dùng: 500.1,009.0,9% = 4,54 gam
– (1) Cân lấy 4,54g NaCl rồi cho vào cốc thủy tinh.
– (2) Cho từ từ nước cất (lượng nhỏ hơn 500 ml) vào và lắc đều
– (3) Dùng đũa thủy tinh khuấy đều cho muối tan hết
– (4) Đổ dung dịch vừa pha vào bình định mức 500 ml.
– (5) Cho tiếp nước cất vừa đến vạch 500ml.
– (6) Đậy nút nháp kín, lắc kĩ ta được 500 ml dung dịch nước muối sinh lí như yêu cầu.
Các dụng cụ thí nghiệm: cân điện tử, cốc thủy tinh, đũa thủy tinh, bình định mức 500 ml có nút nhám, ……
Link tải file word ở phần comment



Link tải file word: https://docs.google.com/document/d/1gtp_u8RR4iv1Bsv5NRgdZKVjU5piW17J/edit?usp=sharing&ouid=107764747704887369372&rtpof=true&sd=true