Đề thi HSG Hóa 9 – Tỉnh Hà Nam – Năm học 2021 – 2022
Đề thi HSG Hóa 9 – Tỉnh Hà Nam – Năm học 2021 – 2022
Câu 1: (3,0 điểm)
1. Bằng kiến thức hóa học, em hãy giải thích và viết phương trình hóa học xảy ra trong các trường hợp sau:
a) Không nên ủ bếp than trong phòng kín
b) Clo là một khí độc nhưng lại được sử dụng để khử trùng nước sinh hoạt
c) Trong quá trình sản xuất giấm ăn người ta thường sử dụng những thùng có miệng rộng, đáy nông và phải mở nắp
2. Chỉ dùng quỳ tím hãy nhận biết các dung dịch riêng biệt đựng trong các lọ mất nhãn sau:
$$
\mathrm{HCl}, \mathrm{NaHSO}_{4}, \mathrm{Na}_{2} \mathrm{CO}_{3}, \mathrm{BaCl}_{2}, \mathrm{NaCl}, \mathrm{NaOH}
$$
Câu 2: (2,5 điểm)
1. Cho sơ đồ thí nghiệm như hình vẽ
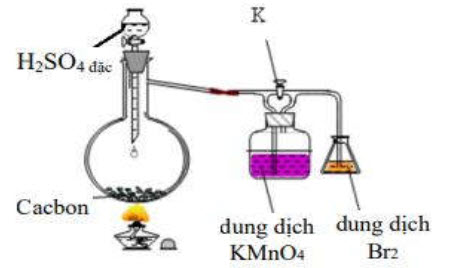
Hãy cho biết hiện tượng xảy ra trong thí nghiệm khi khóa K đóng, khóa K mở giải thích.
2. Nêu hiện tượng xảy ra trong mỗi trường hợp sau và giải thích bằng phương pháp hóa học.
a) Cho $\mathrm{Ba}$ vào dung dịch $\left(\mathrm{NH}_{4}\right)_{2} \mathrm{SO}_{4}$
b) Cho từ từ dung dịch $\mathrm{HCl}$ đến dư vào dung dịch chứa $\mathrm{NaAlO}_{2}$ và $\mathrm{NaOH}$.
Câu 3: (2,0 điểm)
Cho $\mathrm{m}$ gam bột Fe vào $200 \mathrm{ml}$ dung dịch chứa hai muối $\mathrm{AgNO}_{3}$ 0,2 $\mathrm{M}$ và $\mathrm{Cu}\left(\mathrm{NO}_{3}\right)_{2} 0,15 \mathrm{M}$, sau một thời gian thu được 4,4 gam hỗn hợp kim loại và dung dịch X. Cho 3,9 gam bột $\mathrm{Zn}$ vào dung dịch $\mathrm{X}$, sau khi phản ứng xảy ra hoàn toàn, thu được 5,29 gam hỗn hợp kim loại và dung dịch $Y$. Xác định giá trị của $\mathrm{m}$.
Câu 4: (2,0 điểm)
Đốt cháy hoàn 0,15 mol hợp chất hữu cơ $X$ mạch hở cần dùng vừa đủ 75,6 lít không khí (Coi oxi chiếm $20 \%$ thể tích không khí, còn lại là $\mathrm{N}_{2}$ ) Cho toàn bộ sản phẩm cháy hấp thụ vào bình đựng dung dịch $\mathrm{Ba}(\mathrm{OH})_{2}$ dư thấy khối lượng bình tăng lên 19,95 gam và có 59,1 gam kết tủa tạo thành. Khí thoát ra khỏi bình có thể tích 62,16 lít. Xác định công thức phân tử của X( Các phản ứng xảy ra hoàn toàn, các thể tích khí đo ở đktc)
Câu 5: (3,5 điểm)
1. Cho hỗn hợp gồm rượu etylic, axit axetic, nước. Trình bày phương pháp tách riêng rượu etylic nguyên chất và axit axetic (có thể lẫn nước) từ hỗn hợp trên. Viết phương trình
2. Hòa tan hoàn toàn $\mathrm{m}$ gam Nhôm vào dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ loãng chứa $0,35 \mathrm{~mol} \mathrm{H}_{2} \mathrm{SO}_{4}$, thu được khí $\mathrm{H}_{2}$ và dung dịch $\mathrm{X}$. Cho từ từ dung dịch $\mathrm{NaOH} 2 \mathrm{M}$ vào dung dịch $\mathrm{X}$ thu được kết quả như sau:
| Thể tích dung dịch $\text{NaOH}\left( \text{ml} \right)$ | 275 | 425 |
| Khối lượng kết tủa( gam) | $2\text{a}+3,9$ | $\text{a}$ |
Tính giá trị của $\mathrm{m}$ và $\mathrm{a}$
Câu 6: (2,0 điểm)
Từ các chất rắn $\mathrm{KMnO}_{4}, \mathrm{NH}_{4} \mathrm{HCO}_{3}, \mathrm{CaC}_{2}, \mathrm{Al}_{4} \mathrm{C}_{3}$ các dung dịch $\mathrm{NaOH}, \mathrm{HCl}_{\text {đặc và }} \mathrm{H}_{2} \mathrm{O}$ có thể điều chế được những khí gì? Viết các phương trình hóa học.
Khi điều chế các khí ở trên thường có lẫn hơi nước. Để làm khô tất cả các khí đó chỉ bằng một hóa chất thì chọn các chất nào trong số các chất sau đây: $\mathrm{CaO}, \mathrm{CaCl}_{2}$ khan, $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc, $\mathrm{P}_{2} \mathrm{O}_{5}, \mathrm{NaOH}$ rắn? Vì sao?
Câu 7: (2,0 điểm)
Hỗn hợp $\mathrm{A}$ gồm $\mathrm{CH}_{4}, \mathrm{C}_{2} \mathrm{H}_{4}, \mathrm{C}_{2} \mathrm{H}_{2}$ khi đốt cháy hoàn toàn 20,2 gam hỗn hợp $\mathrm{A}$ thì thu được 85,8 gam hỗn hợp gồm $\mathrm{CO}_{2}$ và $\mathrm{H}_{2} \mathrm{O}$. Mặt khác dẫn 13,44 lít hỗn hợp trên ở (đktc) qua dung dịch $\mathrm{AgNO}_{3}$ trong $\mathrm{NH}_{3}$ thu được 48 gam kết tủa, khí thoát ra được dẫn qua dung dịch brom dư, sau khi phản ứng kết thúc thì lượng brom phản ứng là 80 gam. Tính phần trăm thể tích của mỗi khí trong hỗn hợp ban đầu.
Câu 8: (2,5 điểm)
Hỗn hợp bột X gồm Fe, FeO, MO, M (trong đó $\mathrm{M}$ là kim loại hóa trị II không đổi; $\mathrm{M}(\mathrm{OH})_{2}$ không tác dụng với $\mathrm{KOH}$ loãng) chia $\mathrm{m}$ thành ba phần bằng nhau:
– Dẫn luồng khí $\mathrm{CO}$ dư đi qua phần 1 đun nóng để khử hoàn toàn oxit thành kim loại thu được hỗn hợp khí Y và chất rắn $\mathrm{Z}$. Dẫn $\mathrm{Y}$ qua dung dịch $\mathrm{Ba}(\mathrm{OH})_{2}$ thu được 29,55 gam kết tủa và dung dịch $\mathrm{T}$. Cho dung dịch $\mathrm{NaOH} 0,75 \mathrm{M}$ vào dung dịch $\mathrm{T}$, để được lượng kết tủa lớn nhất thì lượng dung dịch $\mathrm{NaOH}$ cần dùng ít nhất là 100ml. Hòa tan chất rắn $\mathrm{Z}$ trong dung dịch $\mathrm{HCl}$ loãng dư còn lại 19,2 gam chất rắn không tan.
– Cho phần 2 vào dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ loãng dư thì thấy có 6,72 lít khí thoát ra (ở đktc)
– Nếu cho phần 3 hòa tan trong dung dịch $\mathrm{HCl}$, sau khi phản ứng xong thu được dung dịch $\mathrm{E}$, khí $\mathrm{G}$ vą̀̀hồn hợp chất rắn $\mathrm{F}$ chỉ gồm 2 kim loại. Cho dung dịch $\mathrm{E}$ tác dụng với dung dịch $\mathrm{KOH}$ dư, sau phản ứng ḅ̉ò̀n toàn thu được 36 gam một kết tủa duy nhất. Hòa tan chất rắn $\mathrm{F}$ vào dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc nóng dư thu được 13,44 lít $\mathrm{SO}_{2}$ (ở đktc, sản phẩm khử duy nhất). Xác định kim loại $\mathrm{M}$.
Cho: $C=12 ; H=1 ; O=16 ; \mathrm{Fe}=56 ; \mathrm{Cl}=35,5 ; \mathrm{Mg}=24 ; \mathrm{Al}=27 ; \mathrm{Cu}=64 ; \mathrm{S}=32 ; \mathrm{Na}=23$; $\mathrm{Zn}=65 ; \mathrm{Ca}=40 ; \mathrm{Ba}=137 ; \mathrm{S}=32 ; \mathrm{N}=14 ; \mathrm{Ag}=108, \mathrm{Mn}=55$.
Thí sinh không được sủ dụng bảng hệ thống tuần hoàn.