Đề thi HSG Hóa 9 – Nam Định – Năm học 2021 – 2022
Đề thi HSG Hóa 9 – Nam Định – Năm học 2021 – 2022
Câu 1. (3,75 điểm)
1. Dạng thù hình của nguyên tố là gì? Nêu 3 dạng thù hình chính của cacbon? Trong các dạng thù hình của cacbon dạng nào hoạt động hóa học mạnh nhất? Nêu 3 ứng dụng của than hoạt tính?
2. Viết các phương trình phản ứng xảy ra khi đốt than trong phòng kín? Nguyên nhân chính gây ngộ độc khi đốt than trong phòng kín? Chỉ ra một số lưu ý khi đốt than để tránh gây ngộ độc?
3. Tại sao khí $\mathrm{CO}_{2}$ được dùng để dập tắt đám cháy? Vì sao không dùng khí $\mathrm{CO}_{2}$ để dập tắt đám cháy kim loại magie?
4. Để tăng nhiệt độ của 1 gam nước thêm $1^{\circ} \mathrm{C}$ cần tiêu tốn $4,18 \mathrm{~J}$, biết rằng khi đốt cháy 1 mol cacbon tỏa ra 394 kJ. Tính khối lượng than chứa 75\% cacbon cần đốt cháy để sinh ra lượng nhiệt đủ đun nóng 1 lít nước $\left(\mathrm{D}=1 \mathrm{~g} / \mathrm{cm}^{3}\right)$ từ $25^{\circ} \mathrm{C}$ lên $100^{\circ} \mathrm{C}$, giả sử nhiệt lượng sinh ra chỉ dùng để làm tăng nhiệt độ của nước và các tạp chất của than không cháy.
Câu 2. (3 điểm)
1. Nhiên liệu là gì? Nhiên liệu được chia thành những loại nào? Lấy ví dụ minh họa cho từng loại nhiên liệu? Cuộc khủng hoảng chính trị ở Ucraina đẩy giá một số nhiên liệu tăng cao, hãy chỉ ra 2 nguồn năng lượng sạch có thể thay thế cho nhiên liệu hóa thạch?
2. Tiến hành 3 thí nghiệm sau:
Thí nghiệm 1: Đưa bình đựng hỗn hợp khí metan và clo (tỉ lệ mol 1:1) ra ánh sáng. Sau một thời gian, cho nước vào bình, lắc nhẹ rồi thêm vào một mẩu giấy quỳ tím.
Thí nghiệm 2: Dẫn khí axetilen đi chậm qua lượng dư dung dịch brom màu vàng.
Thí nghiệm 3: Cho 1 đến 2 giọt dầu ăn vào ống nghiệm đựng $2 \mathrm{ml}$ xăng rồi lắc nhẹ.
Nêu hiện tượng và viết phương trình phản ứng xảy ra trong các thí nghiệm trên (nếu có).
3. Cho sơ đồ chuyển hóa sau:
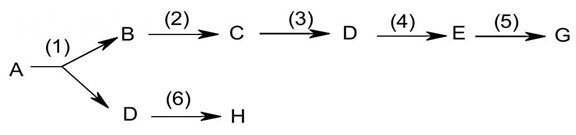
Biết $\mathrm{A}$ có công thức cấu tạo là $\mathrm{CH}_{3}-\mathrm{CH}_{2}-\mathrm{CH}_{3}, \mathrm{~B}$ là $\mathrm{CH}_{4}, \mathrm{H}$ thuộc loại polime, $\mathrm{G}$ có công thức dạng $\mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}+1} \mathrm{Cl},(1)$ là phản ứng phân cắt mạch cacbon. Xác định công thức cấu tạo thu gọn của $\mathrm{C}, \mathrm{D}, \mathrm{E}, \mathrm{G}$ và viết các phương trình hóa học dưới dạng công thức cấu tạo thu gọn (ghi rõ điều kiện phản ứng nếu có).
Câu 3. (3,5 điểm)
1. Hình vẽ sau đây minh họa thí nghiệm điều chế và thu khí $\mathrm{Cl}_{2}$ trong phòng thí nghiệm.
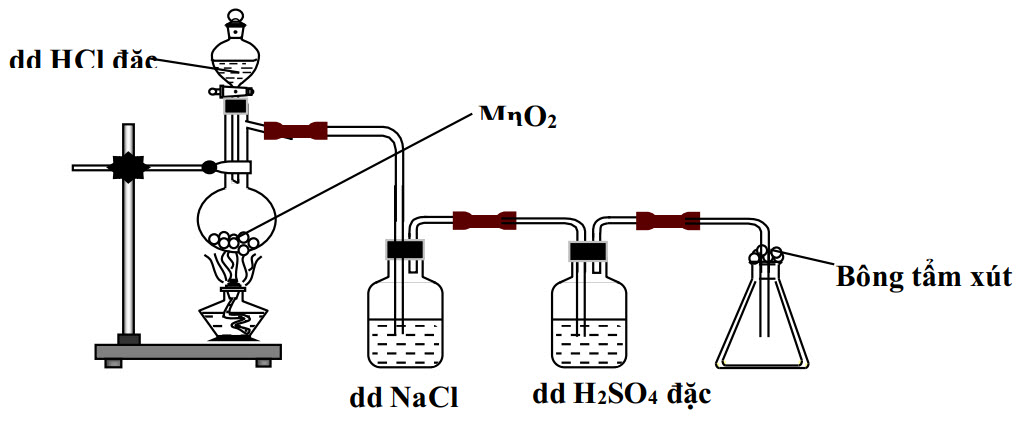
a. Viết tất cả các phương trình phản ứng có thể xảy ra trong thí nghiệm trên.
b. Nêu vai trò của dung dịch $\mathrm{NaCl}$ và dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc trong thí nghiệm trên.
c. Nêu vai trò của bông tẩm xút.
d. Tìm 2 chất thay thế $\mathrm{MnO}_{2}$ trong thí nghiệm trên, viết phương trình phản ứng của 2 chất này với dung dịch $\mathrm{HCl}$ đặc?
e. Nêu và giải thích hiện tượng xảy ra khi cho giấy quỳ tím ẩm (màu tím) vào bình đựng khí $\mathrm{Cl}_{2}$.
2. Viết phương trình hóa học để hoàn thành các phản ứng sau: (Biết $\mathrm{A}$ là hợp chất của $\mathrm{Na}$, mỗi chữ cái là một chất khác nhau).
(1) $\mathrm{A}+\mathrm{B} \rightarrow \mathrm{D}+\mathrm{H}_{2} \mathrm{O}$
(2) $\mathrm{A}+\mathrm{E} \rightarrow \mathrm{NaCl}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O}$
(3) $\mathrm{A}+\mathrm{G} \rightarrow \mathrm{BaCO}_{3}+\mathrm{B}+\mathrm{H}_{2} \mathrm{O}$
(4) $\mathrm{A}+\mathrm{I} \rightarrow \mathrm{D}+\mathrm{K}_{2} \mathrm{CO}_{3}+\mathrm{H}_{2} \mathrm{O}$
(5) $\mathrm{A} \rightarrow \mathrm{D}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O}$
(6) $\mathrm{A}+\mathrm{K} \rightarrow \mathrm{L}+\mathrm{K}_{2} \mathrm{SO}_{4}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O}$
3. Để kiểm tra hàm lượng hiđro sunfua $\left(\mathrm{H}_{2} \mathrm{~S}\right)$ có trong mẫu khí lấy từ một khu dân cư, người ta cho mẫu khí đó đi vào dung dịch đồng (II) sunfat dư với tốc độ 2,0 lít/phút trong thời gian 500 phút (giả thiết chỉ có phản ứng: $\mathrm{H}_{2} \mathrm{~S}+\mathrm{CuSO}_{4} \rightarrow \mathrm{CuS} \downarrow+\mathrm{H}_{2} \mathrm{SO}_{4}$ ). Lọc lấy kết tủa, làm khô thu được 1,44 mg chất rắn màu đen. Biểt tại thời điểm nghiên cứu, theo tiêu chuẩn Việt Nam đối với khu dân cư, hàm lượng hiđro sunfua trong không khí không được vượt quá $0,3 \mathrm{mg} / \mathrm{m}^{3}$. Xác định hàm lượng hiđro sunfua có trong mẫu khí trên và cho biết không khí tại khu dân cư đó có bị ô nhiễm không?
Câu 4. (5,75 điểm)
1. Phân tử $\mathrm{MX}_{3}$ có tổng các hạt cơ bản bằng 196, trong đó số hạt mang điện nhiều hơn số hạt không rị̣̂ng điện là 60 . Số hạt mang điện trong nguyên tử $M$ ít hơn số hạt mang điện trong nguyên tử $X$ là 8 . Xác định $\mathrm{M}, \mathrm{X}$ và công thức phân tử $\mathrm{MX}_{3}$ ?
2. Cho dung dịch $\mathrm{X}$ chứa $\mathrm{H}_{2} \mathrm{SO}_{4}$ nồng độ $\mathrm{xM}$, dung dịch $\mathrm{Y}$ chứa $\mathrm{NaOH}$ nồng độ $\mathrm{yM}$. Trộn $100 \mathrm{ml}$ dung dịch $\mathrm{X}$ với $200 \mathrm{ml}$ dung dịch $\mathrm{Y}$ thu được $300 \mathrm{ml}$ dung dịch $\mathrm{Z}$. Để trung hòa $100 \mathrm{ml}$ dung dịch Z cần $80 \mathrm{ml}$ dung dịch $\mathrm{HCl}$ nồng độ $0,5 \mathrm{M}$. Mặt khác, trộn $200 \mathrm{ml}$ dung dịch $\mathrm{X}$ với $100 \mathrm{ml}$ dung dịch $\mathrm{Y}$ thu được $300 \mathrm{ml}$ dung dịch $\mathrm{T}$. Biết rằng $100 \mathrm{ml}$ dung dịch $\mathrm{T}$ tác dụng vừa đủ với 0,405 gam $\mathrm{Al}$. Xác định $\mathrm{x}, \mathrm{y}$ ?
3. Hòa tan hoàn toàn $\mathrm{m}$ gam oxit $\mathrm{MO}\left(\mathrm{M}\right.$ là kim loại) trong 78,4 gam dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4} 6,25 \%$ (loãng) thì thu được dung dịch $\mathrm{X}$, trong đó nồng độ $\mathrm{H}_{2} \mathrm{SO}_{4}$ còn dư là 2,433\%. Mặt khác, khi cho $\mathrm{CO}$ dư đi qua $\mathrm{m}$ gam MO nung nóng, sau khi phản ứng xảy ra hoàn toàn thu được hỗn hợp khí Y. Cho Y qua $500 \mathrm{ml}$ dung dịch $\mathrm{NaOH} 0,1 \mathrm{M}$ thì chỉ còn một khí duy nhất thoát ra, dung dịch thu được sau phản ứng chứa 2,96 gam muối.
a. Xác định kim loại $M$ và tính $m$.
b. Cho $\mathrm{x}$ gam $\mathrm{Al}$ vào dung dịch $\mathrm{X}$ thu được ở trên, sau khi các phản ứng xảy ra hoàn toàn thu được 1,12 gam kim loại. Tính $\mathrm{x}$ ?
Câu 5. (4 điểm)
1. Hỗn hợp $\mathrm{A}$ gồm hai hiđrocacbon mạch hở có công thức dạng $\mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}}(\mathrm{X}), \mathrm{C}_{\mathrm{m}} \mathrm{H}_{2 \mathrm{~m}+2}(\mathrm{Y})$. Cho 8,96 lít $\mathrm{A}$ đi qua bình đựng dung dịch brom thấy khối lượng bình tăng 5,6 gam và thoát ra 6,72 lít khí. Đốt cháy hoàn toàn khí thoát ra này thu được 13,44 lít $\mathrm{CO}_{2}$ (thể tích các khí đo ở đktc).
a. Xác định công thức phân tử của $X$ và $Y$.
b. Cho 5,84 gam hỗn hợp $\mathrm{B}$ gồm khí $\mathrm{X}$ và $\mathrm{H}_{2}$ vào bình kín có chứa một ít bột $\mathrm{Ni}$ làm xúc tác, đun nóng bình, sau một thời gian thu được hỗn hợp khí C. Dẫn hỗn hợp $\mathrm{C}$ qua bình đựng dung dịch brom dư thấy có 2,688 lít hỗn hợp khí $\mathrm{D}$ thoát ra (đktc), biết tỉ khối hơi của $\mathrm{D}$ so với $\mathrm{H}_{2}$ là 22 . Tính $\%$ thể tích khí $\mathrm{X}$ trong hỗn hợp B? (Biết X có tính chất hóa học tương tự etilen).
2. Crăckinh $\mathrm{m}$ gam butan $\left(\mathrm{C}_{4} \mathrm{H}_{10}\right)$ thu được hỗn hợp khí $\mathrm{X}$ từ các phản ứng theo sơ đồ sau:
$$
\begin{gathered}
\mathrm{C}_{4} \mathrm{H}_{10} \stackrel{{ }^{0}, x t}{\longrightarrow} \mathrm{CH}_{4}+\mathrm{C}_{3} \mathrm{H}_{6}(1) \\
\mathrm{C}_{4} \mathrm{H}_{10} \stackrel{t^{0}, x t}{\longrightarrow} \mathrm{C}_{2} \mathrm{H}_{6}+\mathrm{C}_{2} \mathrm{H}_{4} \text { (2) }
\end{gathered}
$$
Cho toàn bộ hỗn hợp $\mathrm{X}$ vào dung dịch $\mathrm{Br}_{2}$ dư thì thấy thoát ra hỗn hợp khí $\mathrm{Y}$ có thể tích bằng $60 \%$ thể tích của $X$, khối lượng dung dịch $\mathrm{Br}_{2}$ tăng 5,6 gam và có 25,6 gam brom đã tham gia phản ứng. Đốt cháy hoàn toàn hỗn hợp khí $\mathrm{Y}$ thu được a mol $\mathrm{CO}_{2}$ và $\mathrm{b}$ mol $\mathrm{H}_{2} \mathrm{O}$. Tính giá trị $\mathrm{a}$, $\mathrm{b}$ ? (Biết $\mathrm{C}_{2} \mathrm{H}_{6}, \mathrm{C}_{4} \mathrm{H}_{10}$ có tính chất hóa học tương tự $\mathrm{CH}_{4} ; \mathrm{C}_{3} \mathrm{H}_{6}$ có tính chất tương tự $\mathrm{C}_{2} \mathrm{H}_{4}$ ).
Cho:
$\mathrm{H}=1 ; \mathrm{C}=12 ; \mathrm{O}=16 ; \mathrm{S}=32 ; \mathrm{Cl}=35,5 ; \mathrm{Br}=80 ; \mathrm{Na}=23 ; \mathrm{Mg}=24 ; \mathrm{K}=39 ; \mathrm{Fe}=56 ; \mathrm{Al}=27 ; \mathrm{Cu}=64$
(Thí sinh đự̣c sủ dụng bảng tuần hoàn các nguyên tố hóa học)
—Hết—-