Đề thi HSG Hóa 9 – Tỉnh Gia Lai – Năm học 2021 – 2022
Đề thi HSG Hóa 9 – Tỉnh Gia Lai – Năm học 2021 – 2022
Câu 1. (3,5 điểm)
1. Hãy hoàn thành các phương trình phản ứng theo sơ đồ sau (mỗi chữ cái trong ngoặc là một chất):
(A) $\stackrel{t^{o}}{\longrightarrow}$ (B) + (C) + (D)
$(\mathrm{C})+(\mathrm{E}) \stackrel{t^{o}}{\longrightarrow}$ (G) + $(\mathrm{H})+ (I)$
$(\mathrm{A})+(\mathrm{E}) \longrightarrow(\mathrm{K})+(\mathrm{G})+(\mathrm{I})+(\mathrm{H})$
$(\mathrm{K})+(\mathrm{H}) \stackrel{\text { diện phân dung dịch có màng ngăn }}{\longrightarrow}(\mathrm{L})+(\mathrm{I})+(\mathrm{M})$
Biết: (D); (I) ; (M) là các đơn chất ở trạng thái khí trong điều kiện thường, khí (I) có tỉ khối so với khí $\mathrm{H}_{2}$ là 35,$5 ; M_{I}-M_{L}=15$.
2. Hoà tan hoàn toàn $\mathrm{x}$ mol $\mathrm{Ca}$ vào dung dịch chứa $\mathrm{x}$ mol $\mathrm{HCl}$, thu được dung dịch $\mathrm{A}$. Cho dung dịch $\mathrm{A}$ lần lượt tác dụng với các chất sau: $\mathrm{Al}, \mathrm{Cu}\left(\mathrm{NO}_{3}\right)_{2}, \mathrm{~K}_{2} \mathrm{CO}_{3}, \mathrm{Ba}\left(\mathrm{HCO}_{3}\right)_{2}$.
Viết phương trình các phản ứng hoá học xảy ra (nếu có).
Câu 2. (4,0 điểm)
1. Có năm dung dịch không màu đựng trong các lọ mất nhãn riêng biệt: $\mathrm{Al}_{2}\left(\mathrm{SO}_{4}\right)_{3}, \mathrm{NaOH}, \mathrm{MgCl}_{2}, \mathrm{ZnCl}_{2}$, $\mathrm{BaCl}_{2}$. Chỉ được sử dụng thêm phenolphtalein, hãy trình bày cách phân biệt mỗi dung dịch và viết phương trình hóa học của các phản ứng xảy ra.
2. Nêu hiện tượng và viết các phương trình phản ứng trong các trường hợp sau:
a. Cho dung dịch $\mathrm{NaOH}$ dư vào dung dịch $\mathrm{FeCl}_{2}$. Sau đó lấy kết tủa thu được để lâu trong không khí.
b. Cho $\mathrm{Ba}$ vào dung dịch $\mathrm{Na}_{2} \mathrm{CO}_{3}$.
c. Cho từ từ dung dịch $\mathrm{HCl}$ đến dư vào dung dịch $\mathrm{KOH}$ loãng có chứa một lượng nhỏ dung dịch phenolphtalein.
3. Hình vẽ bên là thiết bị điều chế khí $\mathrm{Z}$ trong phòng thí nghiệm :
a. Hãy cho biết dung dịch $\mathrm{X}$ và chất rắn $\mathrm{Y}$ là chất nào trong số các chất sau:
– Dung dịch $\mathrm{X}$ : dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ loãng, dung dịch $\mathrm{NaOH}$ loãng, dung dịch $\mathrm{Na}_{2} \mathrm{SO}_{4}$.
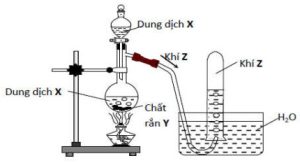
– Rắn Y: Fe, Cu, $\mathrm{Na}_{2} \mathrm{SO}_{3}$.
b. Xác định khí $Z$ từ những chất nào đã chọn ở câu (a). Viết phương trình hóa học điều chế khí $Z$.
Câu 3. (6,0 điểm)
1. Trộn $\mathrm{CuO}$ với một oxit của kim loại $\mathrm{R}$ ( $\mathrm{R}$ có hóa trị $\mathrm{II}$ không đổi) theo tỉ lệ mol tương ứng là 1:2 được hỗn hợp X. Dẫn một luồng khí CO dư đi qua 7,2 gam X nung nóng, thu được hỗn hợp $Y$. Đế hòa tan hết $Y$ cần $240 \mathrm{ml}$ dung dịch $\mathrm{HNO}_{3}$ nồng độ $1,25 \mathrm{M}$, thu được khí $\mathrm{NO}$ sản phẩm khử duy nhất và dung dịch chỉ chứa muối nitrat. Xác định kim loại $R$. Biết các phản ứng hóa học đều xảy ra hoàn toàn.
2. Hỗn hợp $\mathrm{X}$ gồm $\mathrm{Na}, \mathrm{Ba}, \mathrm{Na}_{2} \mathrm{O}, \mathrm{BaO}$. Hòa tan 21,9 gam $\mathrm{X}$ vào nước dư, thu được 1,12 lít khí $\mathrm{H}_{2}$ (ở điều kiện tiêu chuẩn) và dung dịch $Y$, trong đó có 20,52 gam $\mathrm{Ba}(\mathrm{OH})_{2}$. Hấp thụ hoàn toàn 6,72 lít $\mathrm{CO}_{2}$ (ở điều kiện tiêu chuẩn) vào dung dịch $Y$ thu được $m$ gam kết tủa. Tính giá trị của $\mathrm{m}$ và viết các phương trình hóa học của phản ứng xảy ra.
3. Hỗn hợp $\mathrm{X}$ gồm $\mathrm{M}$ và $\mathrm{R}_{2} \mathrm{O}$ trong đó $\mathrm{M}$ là kim loại kiềm thổ và $\mathrm{R}$ là kim loại kiềm. Cho $\mathrm{m}$ gam hỗn hợp $\mathrm{X}$ tan hết trong $320 \mathrm{ml}$ dung dịch $\mathrm{HCl}$ 1,2M dư, thu được dung dịch $\mathrm{Y}$ chứa 30,624 gam các chất tan có cùng số mol. Tính giá trị của $\mathrm{m}$.
Câu 4. (3,0 điểm)
1. Hoà tan hoàn toàn $\mathrm{MgO}$ vào dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4} 9,8 \%$ (vừa đủ) thu được dung dịch $\mathrm{A}$ chỉ chứa muối trung hòa có nồng độ là $\mathrm{x} \%$.
a. Tính giá trị của $x$.
b. Cho dung dịch $\mathrm{Na}_{2} \mathrm{~S}$ vào dd $\mathrm{A}$ thu được kết tủa $\mathrm{B}$. Viết phương trình hóa học của phản ứng xảy ra.
2. Nung nóng $\mathrm{m}$ gam hỗn hợp $\mathrm{X}$ gồm $\mathrm{Mg}, \mathrm{Al}$ và $\mathrm{Cu}$ trong $\mathrm{O}_{2}$ dư thu được 24,3 gam hỗn hợp $\mathrm{Y}$ gồm các oxit. Hòa tan hết $\mathrm{Y}$ bằng lượng vừa đủ dung dịch $\mathrm{Z}$ (gồm $\mathrm{HCl}$ và $\mathrm{H}_{2} \mathrm{SO}_{4}$ có tỉ lệ mol tương ứng $2: 1$ ), thu được dung dịch chứa 64,8 gam hỗn hợp muối trung hòa. Biết các phản ứng hóa học đều xảy ra hoàn toàn.
a. Viết các phương trình hóa học của phản ứng xảy ra.
b. Tính giá trị của $\mathrm{m}$.
Câu 5. (3,5 điểm)
1. Hỗn hợp $\mathrm{X}$ gồm $\mathrm{Fe}\left(\mathrm{NO}_{3}\right)_{2}, \mathrm{Cu}\left(\mathrm{NO}_{3}\right)_{2}$ và $\mathrm{AgNO}_{3}$. Biết thành phần $\%$ khối lượng của nitơ trong $\mathrm{X}$ là $11,864 \%$. Có thể điều chế được tối đa bao nhiêu gam hỗn hợp ba kim loại từ 28,32 gam X?
2. Cho hỗn hợp $\mathrm{A}$ có khối lượng $\mathrm{m}$ gam gồm bột $\mathrm{Al}$ và sắt oxit $\left(\mathrm{Fe}_{\mathrm{x}} \mathrm{O}_{\mathrm{y}}\right)$. Tiến hành phản ứng nhiệt nhôm hỗn? hợp A trong điều kiện không có không khí, được hỗn hợp B. Nghiền nhỏ, trộn đều B rồi chia thành hai phần: – Phần 1 có khối lượng 28,98 gam được hoà tan hết trong dung dịch $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc nóng dư, được dung dị̣̣̂ C và 11,088 lít khí $\mathrm{SO}_{2}$ sản phẩm khử duy nhất (ở điều kiện tiêu chuẩn).
– Phần 2 cho tác dụng với lượng dư dung dịch $\mathrm{NaOH}$ đun nóng thấy giải phóng 0,672 lít khí $\mathrm{H}_{2}$ (ở điềự̣̣̂̂̂n tiêu chuẩn) và còn lại 5,04 gam chất rắn.
Xác định công thức của sắt oxit và tính $\mathrm{m}$. Biết các phản ứng hóa học đều xảy ra hoàn toàn.
-HẾT——-
– Thí sinh không sủ dụng tài liệu, không được sủ dụng bảng Hệ thống tuần hoàn các nguyên tố hóa học.
(Cho biết khối lượng mol: $\mathrm{H}=1 ; \mathrm{C}=12 ; \mathrm{N}=14 ; \mathrm{O}=16 ; \mathrm{Na}=23 ; \mathrm{Mg}=24 ; \mathrm{Al}=27 ; \mathrm{S}=32 ; \mathrm{Cl}_{8} \Rightarrow 35,5 ; \mathrm{K}$
$$
=39 ; \mathrm{Ca}=40 ; \mathrm{Li}=7, \mathrm{Fe}=56 ; \mathrm{Cu}=64 ; \mathrm{Zn}=65 ; \mathrm{Be}=9 ; \mathrm{Ag}=108 ; \mathrm{Ba}=137 \text { ) }
$$