File word đề thi và đáp án HSG Hóa 9 Chu Văn An – Đề ôn thi số 4
File word đề thi và đáp án HSG Hóa 9 Chu Văn An – Đề ôn thi số 4
Câu 1: (2 điểm) Hợp chất A có công thức R2X, trong đó R chiếm 74,19% về khối lượng. Trong hạt nhân của nguyên tử R có số hạt không mang điện nhiều hơn số hạt mang điện là 1 hạt. Trong hạt nhân nguyên tử X có số hạt mang điện bằng số hạt không mang điện. Tổng số proton trong phân tử R2X là 30. Tìm công thức phân tử của R2X.
Câu 2: (6 điểm)
2.1/ (3 điểm) Hỗn hợp A gồm các dung dịch: NaCl, Ca(HCO3)2, CaCl2, MgSO4, Na2SO4. Làm thế nào để thu được muối ăn tinh khiết từ hỗn hợp trên?
2.2/ (3 điểm) Hòa tan hoàn toàn 13,45g hỗn hợp 2 muối hidro cacbonat và cacbonat trung của 1 kim loại kiềm bằng 300ml dung dịch HCl 1M. Sau phản ứng phải trung hòa HCl dư bằng 75ml dung dịch Ca(OH)2 1M.
- Tìm công thức 2 muối.
- Tính khối lượng mỗi muối có trong hỗn hợp ban đầu.
Câu 3: (5 điểm)
3.1/ Xác định B, C, D, E, G, M. Biết A là hỗn hợp gồm Mg và Cu. Hãy viết phương trình hóa học thực hiện sơ đồ chuyển hóa sau:
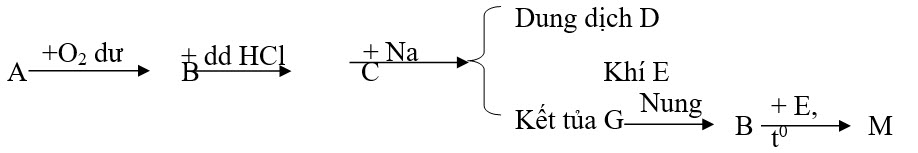
3.2/ Cho M là kim loại tạo ra hai muối MClx, MCly và tạo ra 2 oxit MO0,5x, M2Oy có thành phần về khối lượng của Clo trong 2 muối có tỉ lệ 1 : 1,173 và của oxi trong 2 oxit có tỉ lệ
1 : 1,352.
- Xác định tên kim loại M và công thức hóa học các muối, các oxit của kim loại M.
- Viết các phương trình phản ứng khi cho M tác dụng lần lượt với MCly; H2SO4 đặc, nóng.
Câu 5: Cho 13,6g hỗn hợp gồm Fe và Fe2O3 tác dụng hoàn toàn với 91,25g dung dịch HCl 20% vừa đủ.
- Tính thành phần phần trăm về khối lượng của mỗi chất có trong hỗn hợp ban đầu.
- Tính nồng độ phần trăm của chất tan có trong dung dịch sau phản ứng.
- Nếu hòa tan hoàn toàn 13,6g hỗn hợp nói trên vào H2SO4 đặc, nóng, khi phản ứng kết thúc dẫn toàn bộ khí sinh ra vào 64 ml dung dịch NaOH 10% (D = 1,25g/ml) thì thu được dung dịch A. Tính nồng độ mol của chất tan có trong dung dịch A.( Biết rằng thể tích dung dịch thay đổi không đáng kể)
—HẾT—
HƯỚNG DẪN CHẤM
| Câu | Đáp án | ||||||||||||||||||||
|
Câu 1 2 đ |
Đặt số proton, notron là P, N
Ta có: $\frac{2{{M}_{R}}x100}{2{{M}_{R}}+{{M}_{X}}}=74,19$ (1) NR – PR = 1 => NR = PR + 1 (2) PX = NX (3) 2PR + PX = 30 => PX = 30 – 2PR (4) Mà M = P + N (5) Thế (2),(3),(4), (5)vào (1) ta có: $\frac{{{P}_{R}}+{{N}_{R}}}{{{P}_{R}}+{{N}_{R}}+{{P}_{X}}}=0,7419$ ó $\frac{2{{P}_{R}}+1}{2{{P}_{R}}+1+30-2{{P}_{R}}}=0,7419$ ó$\frac{2{{P}_{R}}+1}{31}=0,7419$ óPR = 11 (Na) Thế PR vào (4) => PX = 30 – 22 = 8 ( Oxi) Vậy CTHH: Na2O |
||||||||||||||||||||
| Câu 2
2.1 3 đ
2.2 3 đ
|
– Cho dung dịch BaCl2 dư vào dung dịch A, lọc bỏ kết tủa, dung dịch còn lại: NaCl, MgCl2, BaCl2 dư, CaCl2, Ca(HCO3)2.
BaCl2 + MgSO4 à BaSO4 + MgCl2 Na2SO4 + BaCl2 à BaSO4 + 2NaCl – Cho dung dịch Na2CO3 dư vào dung dịch còn lại, lọc bỏ kết tủa, dung dịch còn lại: NaCl, NaHCO3, Na2CO3 dư. MgCl2 + Na2CO3 à MgCO3 + 2NaCl BaCl2 + Na2CO3 à BaCO3 + 2NaCl CaCl2 + Na2CO3 à CaCO3 + 2NaCl Ca(HCO3)2 + Na2CO3 à CaCO3 + 2NaHCO3 – Cho dung dịch HCl dư vào dung dịch còn lại. – cô cạn dung dịch thu được NaCl tinh khiết. NaHCO3 + HCl à NaCl + CO2 + H2O Na2CO3 + 2HCl à 2NaCl + CO2 + H2O
a. nHCl = 0,3 x 1 = 0,3 mol ${{n}_{Ca{{(OH)}_{2}}}}$= 0,075 x 1 = 0,075 mol AHCO3 + HCl à ACl + CO2 + H2O x x (mol)
A2CO3 + 2HCl à 2ACl + CO2 + H2O y 2y (mol)
Ca(OH)2 + 2HCl à CaCl2 + 2H2O 0,075 0,15 (mol) Ta có: x + 2y = 0,15 Với 0 < y < 0,075 Mặt khác: Ax + 61x + 2Ay +60y = 13,45 ó A ( 0,15 – 2y) + 61 ( 0,15 – 2y ) + 2Ay +60y = 13,45 ó 0,15A – 2Ay + 9,15 – 122y + 2Ay + 60y = 13,45 ó 0,15A – 4,3 = 62y ó y =$\frac{0,15A-4,3}{62}$ Với y > 0 => $\frac{0,15A-4,3}{62}$>0 ð A > 28,7 (1) Với y < 0,075 => $\frac{0,15A-4,3}{62}$ < 0,075 ð A< 59,7 (2) Từ (1) và (2) : 28,7 < A < 59,7 Vậy A là Kali => CTHH: KHCO3, K2CO3 b. Ta có hệ phương trình 100x + 138y = 13,45
x + 2y = 0,15 x = 0,1 ó y = 0,025 mKHCO$_{3}$ = 0,1 x 100 = 10 (g) mK$_{2}$CO$_{3}$= 0,025 x 138 = 3,45 (g) |
||||||||||||||||||||
| Câu 3
3.1 2 đ
3.2
3 đ |
Xác định:
B: MgO, CuO C: MgCl2, CuCl2 D: NaCl E: H2 G: Mg(OH)2, Cu(OH)2 M: MgO, Cu
2Cu + O2 2CuO 2Mg + O2 2MgO CuO + 2HCl CuCl2 + H2O MgO + 2HCl MgCl2 + H2O 2Na + 2H2O 2NaOH + H2 CuCl2 + 2NaOH Cu(OH)2 + 2NaCl
MgCl2 + 2NaOH Mg(OH)2 + 2NaCl Cu(OH)2 CuO + H2O
Mg(OH)2 MgO + H2O
CuO + H2 Cu + H2O
a. Theo giả thuyết ta có: $\frac{\frac{35,5x}{M+35,5x}}{\frac{35,5y}{M+35,5y}}=\frac{1}{1,173}$ ó 1,173 x M + 6,1415 xy = yM (1) Mặt khác ta có: $\frac{\frac{8x}{M+8x}}{\frac{16y}{2M+16y}}=\frac{1}{1,352}$ ó 1,352x M + 2,816 xy = yM (2) Từ (1) và (2) Þ M = 18,6 y
Vậy M là sắt (Fe) Thay M, y vào (1) ta được x = 2 Công thức hóa học 2 muối là FeCl2 và FeCl3 Công thức hóa học 2 oxit là FeO và Fe2O3 b. Fe + 2 FeCl3 → 3 FeCl2 2 Fe + 6 H2SO4 đ $\xrightarrow{{{t}^{0}}}$ Fe2(SO4)3 + 3 SO2 + 6 H2O
|
||||||||||||||||||||
| Câu 5
4 đ |
${{n}_{HCl}}=\frac{91,25×20}{100×36,5}=0,5mol$
Fe + 2 HCl → FeCl2 + H2 x 2x x x (mol) Fe2O3 + 6 HCl → 2FeCl3 + 3 H2O y 6y 2y (mol) a. Ta có: $\left\{ \begin{align} & 56x+160y=13,6 \\ & 2x+6y=0,5 \\ \end{align} \right.\Rightarrow \left\{ \begin{align} & x=0,1 \\ & y=0,05 \\ \end{align} \right.$ Vậy: $%{{m}_{Fe}}=\frac{0,1×56}{13,6}.100%=41,18%$ $%{{m}_{Fe{}_{2}{{O}_{3}}}}=100%-41,18%=58,82%$ b. mdd sau = 13,6 + 91,25 – 0,1 x 2 = 104,65 g Vậy: $C{{%}_{FeC{{l}_{2}}}}=\frac{0,1×127}{104,65}.100%=12,14%$
$C{{%}_{FeC{{l}_{3}}}}=\frac{0,05x2x162,5}{104,65}.100%=15,53%$
c. Fe2O3 + 3 H2SO4 đ $\xrightarrow{{{t}^{0}}}$ Fe2(SO4)3 + 3 H2O 2 Fe + 6H2SO4 đ $\xrightarrow{{{t}^{0}}}$ Fe2(SO4)3 + 3 SO2 + 6 H2O 0,1 0,15 (mol) ${{n}_{NaOH}}=\frac{64×1,25×10}{40×100}=0,2mol$ Ta có: $1<\frac{{{n}_{NaOH}}}{{{n}_{S{{O}_{2}}}}}=\frac{0,2}{0,15}=1,3<2$ $\Rightarrow $ Sản phẩm gồm 2 muối SO2 + 2 NaOH → Na2SO3 + H2O a 2a a (mol) SO2 + NaOH → NaHSO3 b b b (mol) Ta có: a + b = 0,15 a = 0,05 $\Rightarrow $ 2a + b = 0,2 b = 0,1 Vậy: CM$_{N{{a}_{2}}S{{O}_{3}}}$ = $\frac{0,05}{0,064}$ = 0,78125 M ${{C}_{MNaHS{{O}_{3}}}}=\frac{0,1}{0,064}=1,5625M$
|
File word ở phần comment



Tải về file word: https://docs.google.com/document/d/1dmWjqLQo11SQoXs9AB3AFZrT3ljF_PLb/edit?usp=sharing&ouid=107764747704887369372&rtpof=true&sd=true