Đề thi HSG Hóa 9 – Điện Biên – Năm học 2021 – 2022
Đề thi HSG Hóa 9 – Điện Biên – Năm học 2021 – 2022
Câu 1 (4,0 điểm)
1. Viết các phương trình hóa học thực hiện dãy chuyển hóa sau, ghi rõ điều kiện phản ứng (nếu có):
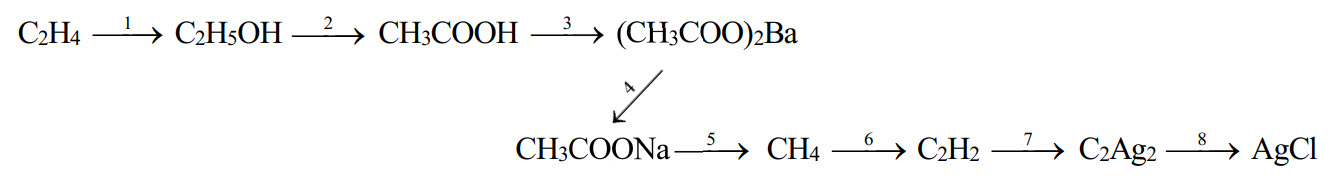
2. Nêu hiện tượng và viết phương trình hóa học xảy ra trong các thí nghiệm sau:
a) Cho một mẩu giấy quỳ tím vào ống nghiệm đựng dung dịch $\mathrm{NaOH}$, sau đó thêm từ từ dung dịch $\mathrm{CH}_{3} \mathrm{COOH}$ đến dư vào ống nghiệm trên.
b) Hòa tan một lượng Fe trong axit $\mathrm{H}_{2} \mathrm{SO}_{4}$ đặc, nóng, dư thu được khí $\mathrm{X}$ và dung dịch $\mathrm{Y}$. Sục khí $\mathrm{X}$ vào dung dịch $\mathrm{KMnO}_{4}$.
3. Bằng kiến thức đã học, em hãy giải thích tại sao không được đốt hoặc sưởi ấm bằng than trong phòng kín? Viết phương trình hóa học xảy ra.
Câu 2: (4,0 điểm)
1. Có 5 chất bột đựng trong các lọ riêng biệt mất nhãn: $\mathrm{NaCl}, \mathrm{K}_{2} \mathrm{CO}_{3}, \mathrm{MgSO}_{4}, \mathrm{BaCO}_{3}, \mathrm{BaSO}_{4}$. Chỉ dùng $\mathrm{CO}_{2}$ và $\mathrm{H}_{2} \mathrm{O}$, hãy trình bày phương pháp để nhận biết 5 chất trên. Viết các phương trình hóa học.
2. Cho hỗn hợp gồm 3 chất rắn $\mathrm{Al}_{2} \mathrm{O}_{3}, \mathrm{SiO}_{2}$ và $\mathrm{Fe}_{2} \mathrm{O}_{3}$ vào dung dịch chứa một chất tan $\mathrm{A}$ đun nóng thì thu được một chất rắn $\mathrm{B}$ duy nhất. Xác định $\mathrm{A}, \mathrm{B}$ với hai trường hợp khi $\mathrm{A}$ là hai loại hợp chất vô cơ khác nhaau, viết phương trình phản ứng minh họa.
3. Hỗn hợp gồm $\mathrm{C}_{2} \mathrm{H}_{5} \mathrm{OH}$ và $\mathrm{CH}_{3} \mathrm{COOH}$. Trình bày phương pháp thích hợp để tách hai chất trên ra khỏi hỗn hợp. Viết phương trình hóa học xảy ra (nếu có).
Câu 3: (4,0 điểm)
1. Đốt cháy hoàn toàn 3,1 gam photpho bằng một lượng oxi lấy dư, thu được chất rắn $\mathrm{A}$. Cho $\mathrm{A}$ tác đđ̣ing hết với $250 \mathrm{ml}$ dung dịch $\mathrm{NaOH}$ có nồng độ $\mathrm{x}$ mol/lít thu được dung dịch $\mathrm{B}$. Cô cạn dung dịch $\mathrm{B}$ thu được 14,64 gam hỗn hợp hai muối khan. Tính x.
2. Hòa tan hoàn toàn 39,96 gam tinh thể muối sunfat ngậm nước của kim loại $M$ (có hoá trị không đổi) vào nước được dung dịch $\mathrm{A}$. Chia dung dịch $\mathrm{A}$ thành hai phần bằng nhau:
– Phần 1: Cho dung dịch amoniac dư vào thu được kết tủa $\mathrm{B}$, nung $\mathrm{B}$ đến khối lượng không đổi thu được 3,06 gam chất rắn.
– Phần 2: Cho dung dịch $\mathrm{BaCl}_{2}$ dư vào thu được 20,97 gam kết tủa.
a) Xác định kim loại $M$ và công thức tinh thể muối trên.
b) Nếu cho toàn bộ dung dịch $\mathrm{A}$ tác dụng với dung dịch $\mathrm{NaOH} 10 \%$, tính khối lượng dung dịch $\mathrm{NaOH}$ cần dùng để thu được lượng kết tủa lớn nhất.
Câu 4: (4,0 điểm)
1. Cho kim loại natri đến dư vào dung dịch rượu etylic trong nước, thấy khối lượng $\mathrm{H}_{2}$ sinh ra bằng $4 \%$ khối lượng dung dịch đã dùng. Biết khối lượng riêng của rượu etylic là $0,8 \mathrm{~g} / \mathrm{ml}$ và khối lượng riêng của nước là $1,0 \mathrm{~g} / \mathrm{ml}$. Hãy tính độ rượu của dung dịch rượu etylic đã dùng.
2. Hòa tan hoàn toàn $\mathrm{m}$ gam kim loại $\mathrm{R}$ (có hóa trị không đổi) vào dung dịch $\mathrm{HCl}$ được dung dịch $\mathrm{D}$. Thêm 240 gam dung dịch $\mathrm{NaHCO}_{3} 7 \%$ vào $\mathrm{D}$ thì vừa đủ tác dụng hết với lượng $\mathrm{HCl}$ dư thu được dung dịch $\mathrm{E}$, trong dung dịch $\mathrm{E}$ nồng độ phần trăm của $\mathrm{NaCl}$ là $2,5 \%$ và muối $\mathrm{RCl}_{\mathrm{n}}$ là $8,12 \%$. Thêm tiếp lượng dư dung dịch $\mathrm{NaOH}$ vào $\mathrm{E}$, lọc kết tủa rồi nung đến khối lượng không đổi thì thu được 16 gam chất rắn.
a) Xác định kim loại R.
b) Tính nồng độ phần trăm của dung dịch $\mathrm{HCl}$ đã dùng.
Câu 5: (4,0 điểm)
1. Cho 5,04 lít (đktc) hỗn hợp khí $\mathrm{Y}$ gồm $\mathrm{C}_{2} \mathrm{H}_{2}$ và $\mathrm{H}_{2}$ qua bột niken nung nóng thu được hỗn hợp $\mathrm{Z}$ chỉ chứa 3 hiđrocacbon. Tỉ khối của $\mathrm{Z}$ so với $\mathrm{H}_{2}$ bằng 14,25.
a) Tính phần trăm theo thể tích của từng khí trong hỗn hợp Y.
b) Đốt cháy hết 2,52 lít (đktc) hỗn hợp Y ở trên rồi cho toàn bộ sản phẩm cháy hấp thụ vào 200 gam dung dịch $\mathrm{Ca}(\mathrm{OH})_{2} 2,775 \%$. Sau khi phản ứng xảy ra hoàn toàn, thu được $\mathrm{m}$ gam kết tủa. Tính $\mathrm{m}$.
2. Để trung hòa $50 \mathrm{ml}$ dung dịch một axit hữu cơ có công thức chung $\mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}+1} \mathrm{COOH}$ phải dùng vừa hết $30 \mathrm{ml}$ dung dịch $\mathrm{Ba}(\mathrm{OH})_{2} 1 \mathrm{M}$. Mặt khác khi trung hòa $125 \mathrm{ml}$ dung dịch axit trên bằng $200 \mathrm{ml}$ dung dịch $\mathrm{KOH}$ thì sau phản ứng thu được 16,8 gam muối khan.
a) Xác định công thức của axit hữu cơ trên.
b) Tính nồng độ mol của dung dịch axit và dung dịch $\mathrm{KOH}$ đã dùng.
Cho biết các nguyên tử khối của:
$
\mathrm{H}=1 ; \mathrm{C}=12 ; \mathrm{N}=14 ; \mathrm{O}=16 ; \mathrm{Na}=23 ; \mathrm{Mg}=24 ; \mathrm{Al}=27 ; \mathrm{P}=31 ; \mathrm{S}=32 ; \mathrm{Cl}=35,5 ; \mathrm{K}=39 ;
$
$
\mathrm{Ca}=40 ; \mathrm{Fe}=56 ; \mathrm{Cu}=64 ; \mathrm{Ba}=137
$