Đề thi HSG Hóa THCS Tỉnh Nghệ An – Năm học 2016 – 2017
Đề thi HSG Hóa THCS Tỉnh Nghê An – Năm học 2016 – 2017
Nội dung Đề thi HSG Hóa THCS Tỉnh Nghệ An – Năm học 2016 – 2017
Câu I (3 điểm)
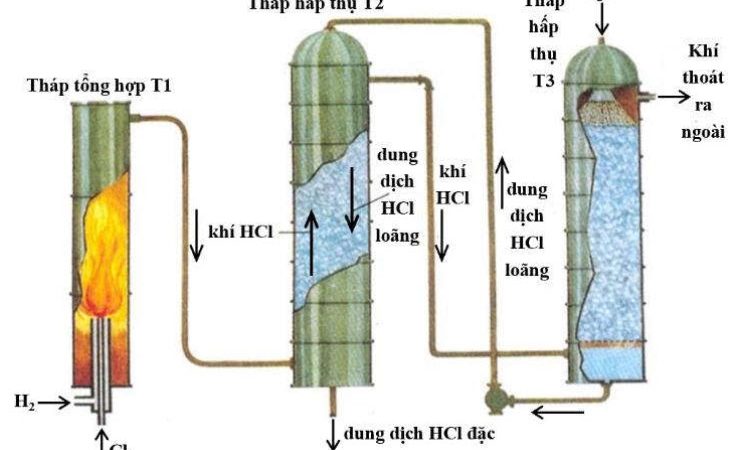
- Viết phương trình hóa học của phản ứng điều chế khí clo trong phòng thí nghiệm và trong công nghiệp.
- Khí clo điều chế trong phòng thí nghiệm thường có lẫn khí hiđroclorua và hơi nước. Nêu cách để thu khí clo tinh khiết.
- Trong công nghiệp nước Gia-ven được điều chế bằng cách điện phân dung dịch NaCl bão hòa, với điện cực trơ và không có màng ngăn giữa hai điện cực.
a) Viết phương trình hóa học của phản ứng xảy ra? Cho biết ứng dụng của nước Gia-ven?
b) Viết phương trình hóa học của phản ứng xảy ra khi cho nước Gia-ven tác dụng với:
– Khí CO2 dư.
– Dung dịch HCl đặc, đun nóng.
Câu II. (4 điểm)
1. Viết phương trình hóa học (nếu có) khi cho bột sắt tác dụng với
a) dung dịch CuSO4. b) khí Cl2 ,đun nóng. c) dung dịch H2SO4 (đặc, nguội)
d) dung dịch AgNO3. e) dung dịch FeCl3.
2. Cho luồng khí CO dư qua hỗn hợp Ba, Al2O3, Fe2O3 đốt nóng thu được chất rắn A. Cho A vào nước dư thu được dung dịch D và chất rắn E. Sục CO2 dư vào D thu được kết tủa F. Cho E vào dung dịch NaOH dư thấy tan một phần. Xác định các chất trong A, D, E, F và viết phương trình hóa học của các phản ứng xảy ra. (biết các phản ứng xảy ra hoàn toàn)
Câu III. (4 điểm)
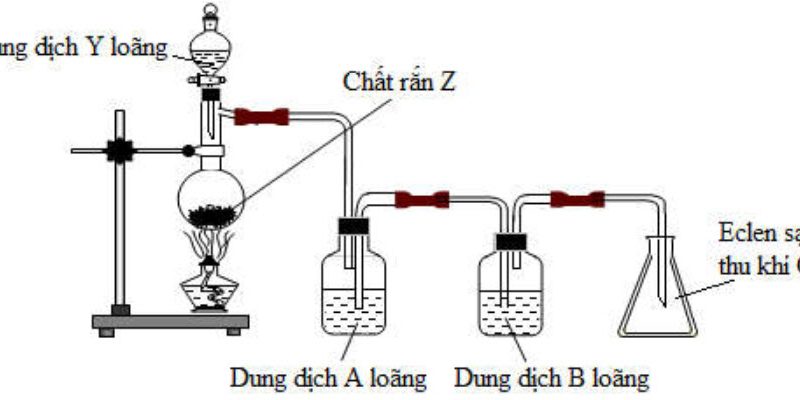
- Trình bày phương pháp hóa học nhận biết các chất bột đựng trong các lọ riêng biệt sau: Al2O3, FeO, Fe3O4, Fe2O3.
- Tách các chất sau ra khỏi hỗn hợp với điều kiện nguyên chất và không thay đổi khối lượng: NaCl, CaCl2, AlCl3, FeCl3.
Câu IV. (6 điểm)
1. Sục V lít CO2 (ở đktc) vào 100 ml dung dịch hỗn hợp NaOH 0,2 M và Ba(OH)2 0,4 M, đến phản ứng hoàn toàn thu được dung dịch A và m gam kết tủa B.
a) Tính m khi V = 0,448 lít.
b) Tính V khi m = 1,97 gam.
c) Biết khi cho dung dịch HCl dư vào dung dịch A, đến phản ứng hoàn toàn thu được 0,896 lít CO2 (ở đktc). Tính V, m.
2. Chia m gam hỗn hợp Na và Al thành hai phần bằng nhau:
Phần 1: Cho vào nước thu được dung dịch A, chất rắn B và 8,96 lít H2 (ở đktc).
Phần 2: Cho vào dung dịch NaOH dư thu được dung dịch D và 12,32 lít H2 (ở đktc).
(biết các phản ứng hóa học xảy ra hoàn toàn).
a) Tính m?
b) Lấy 350 ml dung dịch HCl x M vào dung dịch A thu được 3a gam kết tủa. Mặt khác cho 500 ml dung dịch HCl x M vào dung dịch A thu được 2a gam kết tủa. Tính x và a?
Câu V. (3 điểm)
- Vẽ hình biểu diễn thí nghiệm về sự hấp phụ màu của than gỗ. Cho biết những ứng dụng về tính hấp phụ của than hoạt tính.
- Nêu hiện tượng, viết phương trình hóa học khi cho từ từ đến dư
a) dung dịch NaOH vào dung dịch AlCl3.
b) dung dịch AlCl3 vào dung dịch NaOH.
Cho biết: Na= 23, Ba = 137, C = 12, O = 16, H = 1, Cl = 35,5, Fe = 56.
(Giám thị xem thi không giải thích gì thêm)
Hướng dẫn giải đề thi HSG Hóa THCS Tỉnh Nghệ An – Năm học 2016 – 2017
Câu 1:
1.
4HCl + MnO2 $\xrightarrow{{{t}^{o}}}$MnCl2 + Cl2$\uparrow $+ 2H2O
2NaCl + 2H2O $\xrightarrow[mang\,ngan]{dpdd}$2NaOH + Cl2$\uparrow $+ H2$\uparrow $
2.
– Dùng dung dịch NaCl bão hòa để hấp thụ khí HCl
– Dùng H2SO4 đặc để hấp thụ hơi nước
3.
a.
2NaCl + 2H2O $\xrightarrow[{}]{dpdd}$2NaOH + Cl2$\uparrow $+ H2$\uparrow $
Cl2 + 2NaOH $\xrightarrow{{}}$NaCl + NaClO + H2O
– Nước javen được sử dụng để tẩy trắng, tẩy uế và diệt khuẩn
b.
CO2 + NaClO + H2O $\xrightarrow{{}}$NaHCO3 + HClO
2HCl + 2NaClO $\xrightarrow{{{t}^{o}}}$ 2NaCl + Cl2$\uparrow $ + H2O
Câu 2:
Fe + CuSO4 $\xrightarrow{{}}$ FeSO4 + Cu
2Fe + 3Cl2 $\xrightarrow{{{t}^{o}}}$ 2FeCl3
Không xảy ra
Fe + 2AgNO3 $\xrightarrow{{}}$ Fe(NO3)2 + 2Ag (1)
Sau (1) nếu AgNO3 dư thì tiếp tục xẩy ra phản ứng
Fe(NO3)2 + AgNO3 $\xrightarrow{{}}$ Fe(NO3)3 + Ag (2)
Fe + 2FeCl3 $\xrightarrow{{}}$ 3FeCl2
A chứa: Ba, Al2O3, Fe.
D chứa: Ba(AlO2)2
E chứa: Al2O3, Fe
F chứa: Al(OH)3
Fe2O3 + 3CO $\xrightarrow{{{t}^{o}}}$ 2Fe + 3CO2
Ba + 2H2O $\xrightarrow{{}}$ Ba(OH)2 + H2$\uparrow $
Al2O3 + Ba(OH)2 $\xrightarrow{{}}$ Ba(AlO2)2 + 2H2O
2CO2 + Ba(AlO2)2 + 4H2O $\xrightarrow{{}}$ 2Al(OH)3$\downarrow $ + Ba(HCO3)2
Al2O3 + 2NaOH $\xrightarrow{{}}$ 2NaAlO2 + H2O
Trích mẫu thử
Cho dung dịch HCl dư vào các mẫu thử, sau đó cho NaOH đến dư vào các dung dịch tạo thành
Mẫu thử nào tạo kết tủa sau tan là AlCl3 $\Rightarrow $ Al2O3
Al2O3 + 6HCl $\xrightarrow{{}}$ 2AlCl3 + 3H2O
AlCl3 + 3NaOH $\xrightarrow{{}}$Al(OH)3$\downarrow $ + 3NaCl
Al(OH)3 + NaOH $\xrightarrow{{}}$ NaAlO2 + 2H2O
Mẫu thử nào xuất hiện kết tủa trắng xanh hóa nâu ngoài không khí là FeCl2 $\Rightarrow $ FeO
FeO + 2HCl $\xrightarrow{{}}$ FeCl2 + H2O
FeCl2 + 2NaOH $\xrightarrow{{}}$Fe(OH)2$\downarrow $ + 2NaCl
4Fe(OH)2 + O2 + 2H2O $\xrightarrow{{}}$ 4Fe(OH)3$\downarrow $
Hai mẫu còn lại tạo kết tủa màu nâu đỏ
Fe3O4 + 8HCl $\xrightarrow{{}}$2FeCl3 + FeCl2 + 4H2O
FeCl2 + 2NaOH $\xrightarrow{{}}$Fe(OH)2$\downarrow $ + 2NaCl
4Fe(OH)2 + O2 + 2H2O $\xrightarrow{{}}$ 4Fe(OH)3$\downarrow $
FeCl3 + 3NaOH $\xrightarrow{{}}$Fe(OH)3$\downarrow $ + 3NaCl
Fe2O3 + 6HCl $\xrightarrow{{}}$ 2FeCl3 + 3H2O
FeCl3 + 3NaOH $\xrightarrow{{}}$Fe(OH)3$\downarrow $ + 3NaCl
Cho hai mẫu thử còn lại tác dụng với dung dịch HNO3 mẫu thử nào xuất hiện khí không màu hóa nâu ngoài không khí là Fe3O4, mẫu còn lại là Fe2O3.
3Fe3O4 + 28HNO3 $\xrightarrow{{}}$ 9Fe(NO3)3 + NO$\uparrow $ + 14H2O
2NO + O2 $\xrightarrow{{}}$2NO2 (nâu)
Fe2O3 + 6HNO3 $\xrightarrow{{}}$ 2Fe(NO3)3 + 3H2O
Hòa tan hỗn hợp vào nước và sục NH3 dư vào dung dịch thu được dung dịch A chứa NaCl, CaCl2, NH4Cl và kết tủa B chứa Al(OH)3, Fe(OH)3.
AlCl3 + 3NH3 + 3H2O $\xrightarrow{{}}$ Al(OH)3$\downarrow $ + 3NH4Cl
FeCl3 + 3NH3 + 3H2O $\xrightarrow{{}}$ Fe(OH)3$\downarrow $ + 3NH4Cl
Cho NaOH dư vào kết tủa B thu được dung dịch chứa NaAlO2, NaOH và kết tủa Fe(OH)3
Al(OH)3 + NaOH $\xrightarrow{{}}$ NaAlO2 + 2H2O
Cho HCl dư vào Fe(OH)3 lấy dung dịch tạo thành sau đó cô cạn thu được FeCl3
Fe(OH)3 + 3HCl $\xrightarrow{{}}$ FeCl3 + 3H2O
Sục CO2 dư vào dung dịch NaAlO2, NaOH, lấy kết tủa tạo thành cho tác dụng với HCl dư sau đó cô cạn được AlCl3.
CO2 + NaOH $\xrightarrow{{}}$ NaHCO3
CO2 + NaAlO2 + 2H2O $\xrightarrow{{}}$Al(OH)3$\downarrow $ + NaHCO3
Al(OH)3 + 3HCl $\xrightarrow{{}}$ AlCl3 + 3H2O
Cho dung dịch (NH4)2CO3 dư vào dung dịch A thu được kết tủa CaCO3 và dung dịch hỗn hợp: NaCl, NH4Cl, (NH4)2CO3.
CaCl2 + (NH4)2CO3 $\xrightarrow{{}}$ CaCO3$\downarrow $ + 2NH4Cl
Cho CaCO3 tác dụng với dung dịch HCl dư, sau đó cô cạn dung dịch thu được CaCl2.
CaCO3 + 2HCl $\xrightarrow{{}}$CaCl2 + CO2 + H2O
Cô cạn dung dịch NaCl, NH4Cl, (NH4)2CO3, sau đó nhiệt phân đến khối lượng không đổi thu được NaCl
NH4Cl $\xrightarrow{{{t}^{o}}}$ NH3 + HCl
(NH4)2CO3 $\xrightarrow{{{t}^{o}}}$ 2NH3 + CO2 + H2O
Ba(OH)2 + CO2 $\xrightarrow{{}}$ BaCO3$\downarrow $ + H2O
0,04 0,02 $\xrightarrow{{}}$ 0,02
$\Rightarrow $ m = 0,02.197 = 3,94 (gam)
${{n}_{BaC{{O}_{3}}}}$= 0,01 (mol).
Ta có số mol kết tủa thực tế < kết tủa cực đại (0,04) nên có hai trường hợp xẩy ra.
TH1: Ba(OH)2 dư
Ba(OH)2 + CO2 $\xrightarrow{{}}$ BaCO3$\downarrow $ + H2O
0,01 0,01 $\xleftarrow{{}}$ 0,01
$\Rightarrow $ V = 0,224 lít.
TH2: Ba(OH)2 hết
Ba(OH)2 + CO2 $\xrightarrow{{}}$ BaCO3$\downarrow $ + H2O (1)
0,04 0,04 $\xrightarrow{{}}$ 0,04
2NaOH + CO2 $\xrightarrow{{}}$ Na2CO3 + H2O (2)
0,02 0,01 $\xrightarrow{{}}$ 0,01
Na2CO3 + CO2 + H2O $\xrightarrow{{}}$ 2NaHCO3 (3)
0,01 0,01 $\xrightarrow{{}}$ 0,02
BaCO3 + CO2 + H2O $\xrightarrow{{}}$ Ba(HCO3)2 (4)
0,03 0,03 $\xrightarrow{{}}$ 0,03
$\Rightarrow $ V = 0,09.22.4 = 2,016 (lít)
Vì khi cho HCl dư vào dung dịch A thu được 0,04 mol khí CO2 và dựa vào thứ tự phản ứng (1,2,3,4) nên có các trường hợp sau
TH1: Dung dịch A chứa: $\left\{ \begin{matrix}N{{a}_{2}}C{{O}_{3}} \\NaOH \\\end{matrix}\Rightarrow \,{{n}_{N{{a}_{2}}C{{O}_{3}}}}={{n}_{C{{O}_{2}}}}=0,04\Rightarrow {{n}_{NaOH}} \right.\ge 0,08\,\Rightarrow \,$ Loại
TH2: Dung dịch A chứa:
$\left\{ \begin{matrix}N{{a}_{2}}C{{O}_{3}}\,x\,(mol) \\NaHC{{O}_{3}}\,y(mol) \\\end{matrix} \right.\Rightarrow \left\{ \begin{matrix}2x\,+\,y\,=\,0,02 \\x+y\,=\,0,08 \\\end{matrix} \right.\,\Rightarrow $Vô nghiệm
TH3: Dung dịch A chứa:
$\left\{ \begin{matrix}NaHC{{O}_{3}}\,(0,02) \\Ba{{(HC{{O}_{3}})}_{2}}\,x\,(mol) \\\end{matrix} \right.\Rightarrow \,$Bảo toàn cacbon $\Rightarrow $0,02 + 2x = 0,08
$\Rightarrow $ x = 0,03 (mol)
Ta có sơ đồ phản ứng
$\left\{ \begin{matrix}NaOH\,\,\,\,\,\,\,0,02 \\Ba{{(OH)}_{2}}\,0,04 \\\end{matrix} \right.\xrightarrow{+\,C{{O}_{2}}}\left\langle \begin{matrix}BaC{{O}_{3}}\,y\,(mol)\,\,\,\,\,\,\, \\{} \\{} \\\left\{ \begin{matrix}NaHC{{O}_{3}}\,\,\,\,\,\,\,0,02 \\Ba{{(HC{{O}_{3}})}_{2}}\,0,03 \\\end{matrix} \right. \\\end{matrix} \right.$
Áp dụng bảo toàn nguyên tố Ba $\Rightarrow $ y = 0,04 – 0,03 = 0,01 (mol)
Áp dụng bảo toàn nguyên tố C $\Rightarrow $${{n}_{C{{O}_{2}}}}=$0,09 (mol)
$\Rightarrow $$\left\{ \begin{matrix}V\,=\,2,016\,(l\text{ }\!\!\acute{\mathrm{i}}\!\!\text{ t}) \\m\,=\,1,97\,(gam) \\\end{matrix} \right.$
Phương trình phản ứng:
* Phần 1:
2Na + 2H2O $\xrightarrow{{}}$ 2NaOH + H2 (1)
x $\xrightarrow{{}}$ x x/2
2Al + 2NaOH + 2H2O $\xrightarrow{{}}$ 2NaAlO2 + 3H2 (2)
x $\xleftarrow{{}}$ x $\xrightarrow{{}}$ x 3x/2
* Phần 2:
2Na + 2H2O $\xrightarrow{{}}$ 2NaOH + H2 (3)
x $\xrightarrow{{}}$ x/2
2Al + 2NaOH + 2H2O $\xrightarrow{{}}$ 2NaAlO2 + 3H2 (4)
y $\xrightarrow{{}}$ 3y/2
Vì thể tích H2 thoát ra ở phần 2 nhiều hơn phần 1 nên ở phản ứng (2) Al dư
Gọi x, y lần lượt là số mol của Na, Al trong một phần:
Từ (1,2,3,4) ta có hệ phương trình
\[\left\{ \begin{matrix}2x\,=\,0,4\,\,\,\,\,\,\,\,\,\,\, \\\frac{x}{2}+\frac{3y}{2}=0,55 \\\end{matrix} \right.\Leftrightarrow \left\{ \begin{matrix}x\,=\,0,2 \\y\,=\,0,3 \\\end{matrix} \right.\]
Giá trị m là: m = (0,2.23 + 0,3.27).2 = 25,4 (gam)
Dung dịch A chứa 0,2 mol NaAlO2.
Khi cho HCl vào dung dịch A thì phản ứng xẩy ra theo thứ tự ưu tiên sau:
NaAlO2 + HCl + H2O $\xrightarrow{{}}$ Al(OH)3$\downarrow $ + NaCl (1)
Al(OH)3 + 3HCl $\xrightarrow{{}}$AlCl3 + 3H2O (2)
Ta có: \[\left\{ \begin{matrix}{{n}_{HCl\,}}=\,0,35x\,\Rightarrow \,{{m}_{\downarrow }}=3a\,\Leftrightarrow \,3y\,(mol)\,\,(*) \\{{n}_{HCl}}=0,5x\Rightarrow \,{{m}_{\downarrow }}=2a\,\Leftrightarrow \,2y\,(mol)\,(**) \\\end{matrix} \right.\]
Vì khi tăng số mol HCl lên thấy lượng kết tủa giảm đi $\Rightarrow $ ở (**) lượng kết tủa đã bị hòa tan (đã xảy ra phản ứng 2)
TH1: ở (*) kết tủa chưa bị hòa tan $\Rightarrow $ ở (*) chưa xảy ra phản ứng (2) $\Rightarrow $ 0,35x $\le $ 0,2 $\Rightarrow $ x $\le $ $\frac{4}{7}$
$\Rightarrow $ Ở (*) ${{n}_{\downarrow }}=$0,35x $\Rightarrow $ 0,35x = 3y $\Rightarrow $ y = $\frac{0,35x}{3}$
Xét ở (**)
NaAlO2 + HCl + H2O $\xrightarrow{{}}$ Al(OH)3$\downarrow $ + NaCl (1)
0,2 $\xrightarrow{{}}$0,2 $\xrightarrow{{}}$ 0,2
Al(OH)3 + 3HCl $\xrightarrow{{}}$AlCl3 + 3H2O (2)
$\frac{0,35x}{3}$ $\xrightarrow{{}}$ 0,35x
$\Rightarrow $ 0,2 + 0,35x = 0,5x $\Rightarrow $ x = $\frac{4}{3}$
đối chiếu điều kiện (x $\le $ $\frac{4}{7}$) $\Rightarrow $ Loại
TH2: Ở (*) kết tủa đã bị hòa tan $\Rightarrow $ ở (*) đã xảy ra phản ứng (2) $\Rightarrow $ 0,35x > 0,2 $\Rightarrow $ x > $\frac{4}{7}$
Xét ở (*)
NaAlO2 + HCl + H2O $\xrightarrow{{}}$ Al(OH)3$\downarrow $ + NaCl (1)
0,2 $\xrightarrow{{}}$0,2 $\xrightarrow{{}}$ 0,2
Al(OH)3 + 3HCl $\xrightarrow{{}}$ AlCl3 + 3H2O (2)
$\frac{0,35x-0,2}{3}$ $\xleftarrow{{}}$ (0,35x – 0,2)
$\Rightarrow $ ${{n}_{\downarrow }}=\,0,2-\frac{0,35x-0,2}{3}=\frac{0,8-0,35x}{3}$ = 3y (I)
Xét ở (**)
NaAlO2 + HCl + H2O $\xrightarrow{{}}$ Al(OH)3$\downarrow $ + NaCl (1)
0,2 $\xrightarrow{{}}$0,2 $\xrightarrow{{}}$ 0,2
Al(OH)3 + 3HCl $\xrightarrow{{}}$ AlCl3 + 3H2O (2)
$\frac{0,5x-0,2}{3}$$\xleftarrow{{}}$ (0,5x – 0,2)
$\Rightarrow $ ${{n}_{\downarrow }}=\,0,2-\frac{0,5x-0,2}{3}=\frac{0,8-0,5x}{3}$= 2y (II)
Từ (I), (II) ta suy ra: $\left\{ \begin{matrix}x=1\,\,\,\,\,\,\, \\y=0,05 \\\end{matrix} \right.$
Đối chiếu điều kiện x > $\frac{4}{7}$ thấy x = 1 là thỏa mãn
Đáp số: \[\left\{ \begin{matrix}x\,=\,1\,(M)\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \\a\,=\,0,05.78\,=\,3,9\,(gam) \\\end{matrix} \right.\]
Hình vẽ:
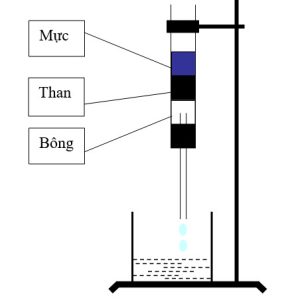
Ứng dụng tính hấp phụ của than hoạt tính: Than hoạt tính được dùng để làm trắng đường, chế tạo mặt nạ phòng độc, lọc nước …
Hiện tượng: tạo kết tủa keo trắng, kết tủa tăng dần đến cực đại, sau đó giảm dần đến trong suốt
AlCl3 + 3NaOH $\xrightarrow{{}}$ Al(OH)3$\downarrow $ + 3NaCl
Al(OH)3 + NaOH $\xrightarrow{{}}$ NaAlO2 + 2H2O
Hiện tượng: ban đầu tạo kết tủa và tan ngay, đến một lúc nào đó kết tủa xuất hiện trở lại và tăng dần đến cực đại.
AlCl3 + 4NaOH $\xrightarrow{{}}$ NaAlO2 + 3NaCl + 2H2O
AlCl3 + 3NaAlO2 + 6H2O $\xrightarrow{{}}$ 4Al(OH)3$\downarrow $ + 3NaCl